인간 유도 만능 줄기 세포 유래 심근 세포에서 단세포 광학 작용 잠재적 측정
Summary
여기서는 고속 모듈식 광혈약 시스템을 사용하여 유도된 다능줄기 세포 유래 심근세포로부터의 작용 잠재력의 광학 획득 및 특성화를 설명합니다.
Abstract
기존의 세포내 미세 전기 전극 기술은 심근세포 전기 생리학을 정량화하는 매우 복잡하고 노동 집약적이며 일반적으로 낮은 처리량에서 수행됩니다. 유도 된 다능성 줄기 세포 (iPSC) 기술의 신속하고 지속적인 확장은 심장 혈관 연구에서 새로운 표준을 제시하고 대체 방법은 이제 단일 세포 수준에서 전기 생리 학적 데이터의 처리량을 증가하는 데 필요한. VF2.1Cl은 최근 유래된 전압 민감 성 염료로, 멤브레인 전위변동에 대한 신속한 단일 채널, 높은 크기 응답을 제공한다. 다른 기존 전압 지표보다 우수한 운동학을 보유하고 있으며 기존의 미세 전극 기술과 동등한 기능성 데이터를 제공합니다. 여기서는 모듈식및 매우 저렴한 광합성 시스템을 사용하여 외부적으로 진행되는 인간 iPSC 파생 심근세포에서 단순화되고 비침습적인 작용 잠재적 특성화를 입증합니다.
Introduction
심근세포의 전기생리학적 모델링과 심장 약물 스크리닝을 위한 효율적인 플랫폼 구축은 다양한 부정맥 장애에 대한 치료 전략의 개발에 필수적이다. 유도 된 다능성 줄기 세포 (iPSC) 기술의 급속한 확장은 고립 된 환자 파생 심근 세포 (iPSC-CM)를 사용하여 인간 질병 모델링 및 약리학적 조사에 유망한 진입을 일으켰습니다. 패치 클램프(current-clamp)를 통해 이들 세포의 전기생리학적 특성화를 위한 “골드 스탠다드” 기술은 작용 전위(AP) 형태및 지속시간을 정량화할 수 있지만, 이 방법은 매우 복잡하고 느리며 높은 처리량 데이터 수집1에적합하지 않다. iPSC-CM은 성인 토착 심근세포2에비해 확장막 전위 및 누출 전류가 증가하는 것으로 정기적으로 보고된다. iPSC-CM에서 관찰된 더 작은 세포 크기 및 감소된 막 정전용량이 현재 클램프 기술을 사용할 때 일부 체계적인 오류를 생성할 수 있으며, 아마도 이러한 편차를 설명할 수 있는 것으로나타났다3. iPSC-CM 플랫폼의 유용성을 극대화하기 위해 iPSC-CM의 단일 셀 수준에서 막 전압 변화를 특성화할 때 처리량을 늘리고 데이터 정확도를 보장하는 추가 방법이 중요합니다.
전압 민감염료(VSD)는 기존의 기술4와비교한 심장 AP 역학의 더 빠르고 비침습적이며 동등한 분석을 제공하는 제안된 방법이다. 최근 연구는 정확하게 심장 AP5를정량화하는 비율 전압 민감한 프로브 광합성의 적합성을 입증했다. 더욱이, 광학 광합성 접근법을 용이하게 확장하는 능력은 치료 약물 개발(예를 들어 CiPA)에서 중요한 대규모 심폐성 스크린에 이 기술을 빌려준다. 마이크로 전극 어레이 및 전압 감지 광학 기술을 이용한 시각 장애인 다중 현장 연구에서 표준화된 심폐성 프로토콜의 개발은 이 접근법6의핵심 가치를 입증했다.
많은 전능성 염료는 시판되고, 새로운 프로브의 지속적인 합성 개발은 다양한 심장 및 신경 구조물에 걸쳐 그들의 효과를 간소화하기위한 흥미로운 잠재력을 보여줍니다. 이상적인 VSD는 증가 된 운동과 감도를 가지며 정전 용량 부하, 광 표백 및 세포 독성을 줄입니다. 최근 합성 된 VF2.1Cl (FluoVolt)은 새로운 전압 플루어 (VF) 제품군7의다른 구성원이 공유하는 새로운 와이어 기반 분자 구조로 인해 이러한 유익한 특성의 대부분을 표현한다. 간단한 프로브가 플라즈마 멤브레인에 분자및 전기적으로 컨쥬게이트되는 일반적인 전기 색소와 는 달리,이 염료는 변형 된 형광성 불소 호레 (FITC)와 전자가 풍부한 기증자를 페어링 하는 수동적으로 삽입된 멤브레인 스패닝 합성 와이어로 구성됩니다. 기계학적 세부 사항은 그림 1에서제공됩니다. 이 염료는 멤브레인 전압 변동에 대한 우수한 감도를 나타내며, 비교 가능한 속도7에서다른 일반적인 프로브에서 볼 수 있는 ~10%와 달리 100mV당 배출 강도의 27% 변화를 나타낸다. 또한, 와이어 기반 PeT 시스템은 셀룰러 전기장과 직접 상호 작용하지 않아 최소한의 전기 간섭과 셀룰러 정전 용량 부하의 무시할 수 있는 변화를 일으킵니다.
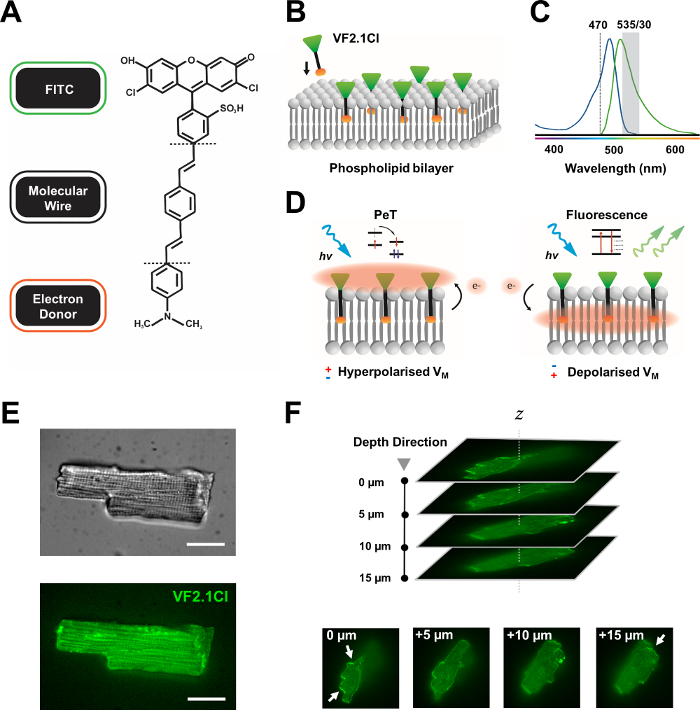
그림 1: VF2.1Cl 염료의 화학, 스펙트럼 및 기계론 파라미터. (A)VF2.1Cl. 분자 피처의 화학적 구조는 플라즈마 멤브레인내로 삽입을 용이하게 하는 페닐렌 비닐렌 분자 와이어 내의 다중 알킬 군을 포함한다. FITC 프로브에 접합된 음전하 황포산 단은 세포외 표면의 불소 안정화를 보장하고 지질 이중층의 전기장에 비해 수직 삽입 부근에 보조를 지원한다. (b)표적 세포의 혈장 막에 수직 VF2.1Cl을 포함시키는 단순화된 회로도. (C)VF2.1Cl 염료의 흡수 및 방출 스펙트럼. 스펙트럼은 표준 FITC 및 GFP 프로브와 동일합니다. (D)VF2.1Cl의 기계주의 적 행동 모드 묘사. 휴식 조건 (과극성)에서, 음의 세포 내 전압은 로스트랄 불소로 전환기쪽으로 무료 전자를 구동한다. 전자 풍부는 광 유발 전자 전달(PeT)이 광 흥분 상태에서 나오는 통로로서 선호되고, 효과적으로 형광을 담금질할 수 있도록 보장한다. 대조적으로, 탈극막 전위는 광학 여기에 형광을 선호하는 하향 전자 운동에 영향을 미칩니다. 결과 형광 반응은 멤브레인 전압과 선형적으로 관련되어 있으며 세포 전기 생리학적 운동학에 대한 상세한 측두정보를 수집하기 위해 정확하게 활용할 수 있습니다. (E)대표적인 브라이트필드(upper) 및 470nm(하부)의 형광은 VF2.1Cl로 로드된 leporine 심근세포의이미지(이하)단일 하중심근세포의 Z 스택이다. 화살표는 세포 막에 VF2.1Cl의 명확한 국소화영역을 나타낸다. 이미지는 X-lightv3 회전 디스크 공초점 헤드로 구성된 회전 디스크 공초점 시스템으로 50 μm 핀홀 패턴을 획득했습니다. LDI-7 조명기; Prime95B 카메라와 PlanApo Lambda 100x 목표. 스케일 바: 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
VF2.1Cl에 컨쥬게이트된 FITC 프로브는 표준 및 GFP 필터 구성에 따라 효과적으로 사용할 수 있도록 보장하며, 형광 이미징 플랫폼의 공통 특징인 단일 채널 수집 시스템만 필요합니다. 이 염료를 가진 조밀한 인간 iPSC-CM 단층의 분석은 최근에보고되었습니다 8,9,10,11. 우리의 프로토콜은 조밀한 싱크로나단층의 전기 및 파라크리안 영향에 흔들리지 않는 단일 격리 된 iPSC-CM에 대한 조사와 복잡한 공초점 또는 넓은 현장 이미징 준비와는 달리 저렴하고 사용자 정의 가능한 광측정 시스템의 사용으로 인해 이러한 연구와 다릅니다.
여기서는 고립된 인간 iPSC 유래 심근세포및 원심근세포로부터 견고한 광학 AP를 빠르게 획득하고 분석하기 위한 프로토콜을 설명합니다(보충 파일참조). 우리는 단일 셀 광측정 측정을위한 아트 플랫폼의 사용자 정의 상태와 함께 VF2.1Cl을 사용합니다. 이러한 실험 프로토콜은 대학 의료 센터 괴팅겐의 윤리위원회에 의해 승인되었습니다 (번호 10/9/15).
Protocol
Representative Results
Discussion
여기서 우리는 전기 생리학적 모델링 및 심장 약물 스크리닝에 적합한 격리된 iPSC-CM에서 상세한 AP 프로파일을 쉽게 획득하기 위한 기본 프로토콜을 설명합니다. 우리는 표시기 기능과 방법론 적 충실도를 모두 시사하는 희소하게 시드 된 iPSC-CM에서 정기적이고 견고한 AP를 감지합니다.
iPSC 재프로그래밍을 위한 광범위한 상용 방법론과 심장 분화 프로토콜에 대한 표준화 부족…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
저자는 이 출판물의 생산 비용을 충당한 Cairn Research Ltd.의 친절한 재정적 기여에 대해 인정하고 싶습니다. 또한, 이네스 뮬러 씨와 스테파니 케스텔(Stefanie Kestel) 씨의 뛰어난 기술 지원에 감사드립니다.
저자의 연구는 심장 혈관 연구를위한 독일 센터에 의해 지원됩니다 (DZHK), 도이치 포르스충스게마인샤프트 (DFG, 독일 연구 재단, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 및 독일의 우수 전략 – EXC 2067/1- 390729940) 및 엘스 크뢰너-프레세니우스 스티프퉁(EKFS 2016_A20).
Materials
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
Riferimenti
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochimica. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).

