Sondes de tension de l’ADN pour cartographier les forces transitoires du récepteur Piconewton par les cellules immunitaires
Summary
Cet article décrit un protocole détaillé pour l’utilisation de sondes de tension basées sur l’ADN pour imager les forces réceptrices appliquées par les cellules immunitaires. Cette approche permet de cartographier les forces du récepteur >4,7pN en temps réel et d’intégrer les forces au fil du temps.
Abstract
Les forces mécaniques transmises à la jonction entre deux cellules voisines et à la jonction entre les cellules et la matrice extracellulaire sont essentielles pour réguler de nombreux processus allant du développement à l’immunologie. Par conséquent, le développement des outils pour étudier ces forces à l’échelle moléculaire est essentiel. Notre groupe a développé une suite de capteurs de tension moléculaire pour quantifier et visualiser les forces générées par les cellules et transmises à des ligands spécifiques. La classe la plus sensible des capteurs de tension moléculaire est composée d’épingles à cheveux à boucle tige d’acide nucléique. Ces capteurs utilisent des paires fluorophore-quencher pour rendre compte de l’extension mécanique et du dépliage des épingles à cheveux ADN sous force. L’un des défis des capteurs de tension en épingle à cheveux à ADN est qu’ils sont réversibles avec un repliement rapide en épingle à cheveux à la fin de la tension et que les forces transitoires sont donc difficiles à enregistrer. Dans cet article, nous décrivons les protocoles de préparation des capteurs de tension de l’ADN qui peuvent être « verrouillés » et empêchés de se replier pour permettre le « stockage » des informations mécaniques. Cela permet d’enregistrer des forces de piconewton hautement transitoires, qui peuvent ensuite être « effacées » par l’ajout d’acides nucléiques complémentaires qui suppriment le verrou. Cette capacité à basculer entre la cartographie de tension en temps réel et le stockage d’informations mécaniques révèle des forces faibles, de courte durée et moins abondantes, qui sont couramment utilisées par les cellules T dans le cadre de leurs fonctions immunitaires.
Introduction
Les cellules immunitaires se défendent contre les agents pathogènes et les cellules cancéreuses en rampant et en balayant continuellement les surfaces des cellules cibles à la recherche d’antigènes, en cloutant leur surface 1,2. La reconnaissance de l’antigène est initiée lors de la liaison entre le récepteur des lymphocytes T (TCR) et le complexe peptide-majeur d’histocompatibilité CMH (pMHC) exprimé à la surface des cellules cibles. Parce que la reconnaissance TCR-pMHC se produit à la jonction entre deux cellules mobiles, il a longtemps été soupçonné de subir des forces mécaniques. De plus, cela a conduit au modèle mécanocapteur d’activation TCR, qui suggère que les forces TCR contribuent à sa fonction 3,4. Pour comprendre quand, où et comment les forces mécaniques contribuent au fonctionnement des lymphocytes T, il est impératif de développer des outils pour visualiser les forces moléculaires transmises par les lymphocytes T. Traditionnellement, des méthodes telles que la microscopie à force de traction (TFM) et les réseaux de micropiliers sont utilisés pour étudier les forces cellulaires 5,6. Cependant, la sensibilité aux forces de la TFM et des réseaux de micropiliers est à l’échelle du nanonewton (nN) et est donc souvent insuffisante pour étudier les forces moléculaires du piconewton (pN) transmises par les récepteurs cellulaires7. Pour améliorer la force et la résolution spatiale de la détection, notre laboratoire a été le pionnier du développement de sondes de tension moléculaire, qui ont été initialement synthétisées à l’aide de polymères de polyéthylèneglycol (PEG)7. Les sondes de tension moléculaire sont composées d’un « ressort » moléculaire extensible (PEG, protéine, ADN) flanqué d’un fluorophore et d’un quencher et sont ancrées sur une surface. Les forces appliquées à l’extrémité de la sonde conduisent à son extension, séparant le fluorophore et l’anti-quenceur, et générant ainsi un fort signal de fluorescence (Figure 1A)8,9,10.
Au cours de la dernière décennie, nous avons développé une bibliothèque de différentes classes de sondes de tension moléculaire avec des éléments à ressort fabriqués à partir d’acides nucléiques11, de protéines10 et de polymères8. Parmi celles-ci, les sondes de tension basées sur l’ADN fournissent le rapport signal sur bruit le plus élevé et la plus grande sensibilité à la force, qui est facilement réglée de quelques pN à ~20 pN11. Nous avons utilisé ces sondes de tension d’ADN en temps réel pour étudier les forces moléculaires générées par de nombreux types de cellules, y compris les fibroblastes, les cellules cancéreuses, les plaquettes et les cellules immunitaires11,12,13. Ce manuscrit décrira des protocoles pour synthétiser et assembler des sondes de tension d’ADN sur une surface afin de cartographier les forces des récepteurs moléculaires avec une résolution de force pN à l’aide d’un microscope à fluorescence conventionnel. Bien que la procédure actuelle comprenne des modifications chimiques de l’acide nucléique pour introduire le rapporteur fluorescent (figure 1B), il est important de noter que de nombreuses étapes de modification et de purification peuvent être sous-traitées à des entreprises de synthèse d’ADN personnalisées. Par conséquent, la technologie des sondes de tension de l’ADN est facile et accessible aux communautés plus larges de la biologie cellulaire et de la mécanobiologie.
Brièvement, pour assembler des capteurs de tension d’ADN, une épingle à cheveux à ADN est hybridée à un brin de ligand fluorescent sur un bras et à un brin d’ancrage de quencher sur l’autre bras, puis immobilisée sur un substrat de verre (Figure 1C, tension en temps réel). En l’absence de force mécanique, l’épingle à cheveux est fermée et la fluorescence est donc éteinte. Cependant, lorsque la force mécanique appliquée est supérieure à la F1/2 (la force à l’équilibre qui conduit à une probabilité de 50% de se déplier), l’épingle à cheveux fond mécaniquement et un signal fluorescent est généré.
En nous appuyant sur le capteur de tension de l’ADN en temps réel, nous décrivons également des protocoles pour cartographier les forces accumulées, ce qui est particulièrement utile pour étudier les interactions entre les récepteurs des cellules immunitaires et leur ligand naturel. En effet, les récepteurs immunitaires présentent souvent des liaisons de courte durée 3,14. Les forces accumulées sont imagées à l’aide d’un brin de « verrouillage » qui se lie préférentiellement aux épingles à cheveux d’ADN ouvertes et permet le stockage des signaux de fluorescence associés aux événements de traction mécanique (Figure 1C, tension verrouillée). Le brin de verrouillage est conçu pour lier un site de liaison cryptique qui est exposé lors de la fusion induite mécaniquement de l’épingle à cheveux et verrouiller l’épingle à cheveux à l’état ouvert en bloquant le repliement de l’épingle à cheveux, stockant ainsi le signal de tension et générant une carte de tension accumulée. De plus, le brin de verrouillage est conçu avec un toehold à huit nucléotides, ce qui permet une réaction de déplacement du brin médiée par le teil avec son complément complet, le brin de « déverrouillage ». Avec l’ajout du brin de déverrouillage, le brin de verrouillage lié est retiré de la construction en épingle à cheveux, effaçant le signal de tension stocké et réinitialisant l’épingle à cheveux à l’état temps réel.
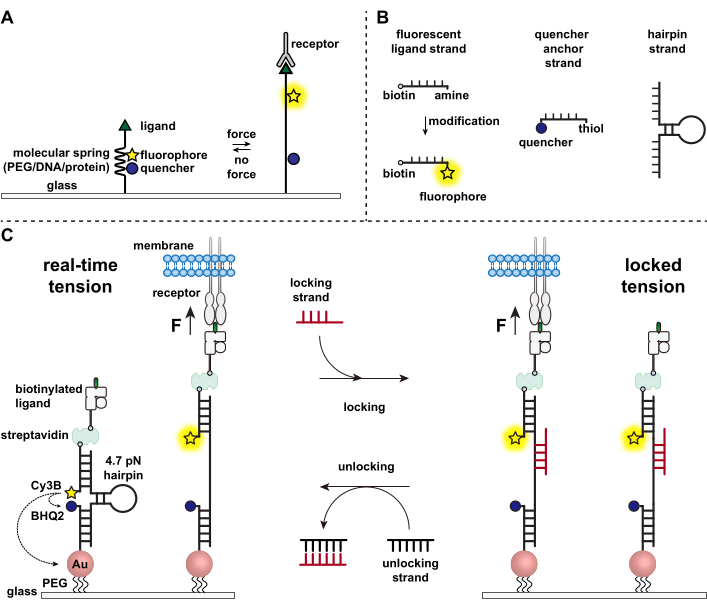
Figure 1 : Schéma des sondes de tension moléculaire de pointe. (A) Conception générale de sonde de tension moléculaire en temps réel, (B) Brins pour la construction de sonde de tension basée sur l’ADN, et (C) sondes de tension basées sur l’ADN et leur basculement entre l’état en temps réel et l’état verrouillé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le protocole principal comprend quatre sections principales: préparation des oligonucléotides, préparation de surface, imagerie et analyse des données. Ce protocole a été démontré avec succès par notre laboratoire et d’autres dans des lymphocytes T CD8+ OT-1 naïfs et activés, des cellules CD4+ OT-II, ainsi que des hybridomes, et peut être appliqué pour interroger différents récepteurs de cellules immunitaires, y compris le récepteur des cellules T, le récepteur de mort cellulaire programmée (PD1) et les forces de l’antigène 1 associé à la fonction lymphocytaire (LFA-1). Les lymphocytes T naïfs de CD8+ OT-1 sont utilisés comme exemple de lignée cellulaire dans cet article.
Protocol
Representative Results
Discussion
Avec les procédures détaillées fournies ici, on peut préparer des substrats de sonde de tension en épingle à cheveux ADN pour cartographier et quantifier la tension du récepteur produite par les cellules immunitaires. Lorsque les cellules sont plaquées sur le substrat de la sonde de tension en épingle à cheveux de l’ADN, elles atterrissent, se fixent et se propagent lorsque les récepteurs détectent les ligands à la fois chimiquement et mécaniquement, ce dernier étant détecté par nos sondes. Cependant, …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par les subventions NIH R01GM131099, NIH R01GM124472 et NSF CAREER 1350829. Nous remercions le NIH Tetramer Facility pour les ligands pMHC. Cette étude a été appuyée, en partie, par le Emory Comprehensive Glycomics Core.
Materials
| 3-hydroxypicolinic acid (3-HPA) | Sigma | 56197 | maldi-TOF-MS matrix |
| mPEG-SC | Biochempeg | MF001023-2K | surface prep |
| (3-Aminopropyl)triethoxysilane | Acros | AC430941000 | surface prep |
| 10x Red blood cell lysis buffer | Biolegend | 00-4333-57 | buffer |
| 8.8 nm gold nanoparticles, tannic acid | Nanocomposix | customized order | surface prep |
| Atto647N NHS ester | Sigma | 18373-1MG-F | fluorophore, oligo prep |
| Attofluor Cell Chamber, for microscopy | Thermo Fisher Scientific | A7816 | imaging |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | cells |
| biotinylated anti-mouse CD3e | ebioscience | 13-0031-82 | antibody/ligand |
| Biotinylated pMHC ovalbumin (SIINFEKL) | NIH Tetramer Core Facility at Emory University | NA | antibody/ligand |
| bovine serum albumin | Sigma | 735078001 | block non-specific interactions |
| Cell strainers | Biologix | 15-1100 | cells |
| Coverslip Mini-Rack, teflon | Thermo Fisher Scientific | C14784 | surface prep |
| Cy3B NHS ester | GE Healthcare | PA63101 | fluorophore, oligo prep |
| Dulbecco's phosphate-buffered saline (DPBS) | Corning | 21-031-CM | buffer |
| ethanol | Sigma | 459836 | surface prep |
| Hank’s balanced salts (HBSS) | Sigma | H8264 | buffer |
| hydrogen peroxide | Sigma | H1009 | surface prep |
| LA-PEG-SC | Biochempeg | HE039023-3.4K | surface prep |
| Midi MACS (LS) startup kit | Miltenyi Biotec | 130-042-301 | cells |
| mouse CD8+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | cells |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | oligo prep |
| No. 2 round glass coverslips | VWR | 48382-085 | surface prep |
| NTA-SAM | Dojindo Molecular Technologies | N475-10 | surface prep |
| P2 gel | Bio-rad | 1504118 | oligo prep |
| sufuric acid | EMD Millipore Corporation | SX1244-6 | surface prep |
| Sulfo-NHS acetate | Thermo Fisher Scientific | 26777 | surface prep |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | 653950-702 | oligonucleotide preparation | |
| Barnstead Nanopure water purifying system | Thermo Fisher | water | |
| CFI Apo 100× NA 1.49 objective | Nikon | Microscopy | |
| Cy5 cube | CHROMA | Microscopy | |
| evolve electron multiplying charge coupled device (EMCCD) | Photometrics | Microscopy | |
| High-performance liquid chromatography | Agilent 1100 | oligonucleotide preparation | |
| Intensilight epifluorescence source | Nikon | Microscopy | |
| Matrix-assisted laser desorption/ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | oligonucleotide preparation | |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | oligonucleotide preparation | |
| Nikon Eclipse Ti inverted microscope | Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM cube | CHROMA | Microscopy | |
| TIRF launcher with 488 nm (50 mW), 561 nm (50 mW), and 640 nm | Coherent | Microscopy | |
| TRITC cube | CHROMA | Microscopy | |
| oligo name | 5' modification / 3' modification | sequence (5' to 3') | Use |
| 15mer amine locking strand | 5' modification: no modification 3' modification: /3AmMO/ |
AAA AAA CAT TTA TAC CCT ACC TA | locking real-time tension signal |
| 15mer Atto647N locking strand | 5' modification: Atto647N 3' modification: /3AmMO/ |
AAA AAA CAT TTA TAC CCT ACC TA | locking real-time tension signal |
| 15mer non-fluoresccent locking strand | 5' modification: no modification 3' modification: no modification |
A AAA AAC ATT TAT AC | locking real-time tension signal for quantitative analysis |
| 4.7 pN hairpin strand | 5' modification: no modification 3' modification: no modification |
GTGAAATACCGCACAGATGCGT TTGTATAAATGTTTTTTTCATTTAT ACTTTAAGAGCGCCACGTAGCC CAGC |
hairpin probe |
| amine ligand strand | 5' modification: /5AmMC6/ 3' modification: /3Bio/ |
CGCATCTGTGCG GTA TTT CAC TTT | hairpin probe |
| BHQ2 anchor strand | 5' modification: /5ThiolMC6-D/ 3' modification: /3BHQ_2/ |
TTTGCTGGGCTACGTGGCGCTCTT | hairpin probe |
| Cy3B ligand strand | 5' modification: Cy3B 3' modification: /3Bio/ |
CGCATCTGTGCG GTA TTT CAC TTT | hairpin probe |
| unlocking strand | 5' modification: no modification 3' modification: no modification |
TAG GTA GGG TAT AAA TGT TTT TTT C | unlocking accumulated tension signal |
Riferimenti
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunological Reviews. 221 (1), 77-89 (2008).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. Journal of Cell Biology. 216 (1), 217-230 (2017).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences. 114 (39), 8204-8213 (2017).
- Hong, J., et al. A TCR mechanotransduction signaling loop induces negative selection in the thymus. Nature Immunology. 19 (12), 1379-1390 (2018).
- Basu, R., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences. 111 (6), 2241-2246 (2014).
- Ma, V. P. Y., Salaita, K. DNA nanotechnology as an emerging tool to study mechanotransduction in living systems. Small. 15 (26), 1900961 (2019).
- Liu, Y., Yehl, K., Narui, Y., Salaita, K. Tension sensing nanoparticles for mechano-imaging at the living/nonliving interface. Journal of the American Chemical Society. 135 (14), 5320-5323 (2013).
- Glazier, R., et al. DNA mechanotechnology reveals that integrin receptors apply pN forces in podosomes on fluid substrates. Nature Communications. 10 (1), 1-13 (2019).
- Galior, K., Liu, Y., Yehl, K., Vivek, S., Salaita, K. Titin-based nanoparticle tension sensors map high-magnitude integrin forces within focal adhesions. Nano Letters. 16 (1), 341-348 (2016).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences. 115 (2), 325-330 (2018).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464 (7290), 932-936 (2010).
- Ma, R., et al. DNA probes that store mechanical information reveal transient piconewton forces applied by T cells. Proceedings of the National Academy of Sciences. 116 (34), 16949-16954 (2019).
- Hui, E., et al. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition. Science. 355 (6332), 1428-1433 (2017).
- Whitley, K. D., Comstock, M. J., Chemla, Y. R. Elasticity of the transition state for oligonucleotide hybridization. Nucleic Acids Research. 45 (2), 547-555 (2016).
- Brockman, J. M., et al. Live-cell super-resolved PAINT imaging of piconewton cellular traction forces. Nature Methods. 17 (10), 1018-1024 (2020).

