Analyse de suivi des nanoparticules pour la quantification et la détermination de la taille des vésicules extracellulaires
Summary
Nous montrons comment utiliser un nouvel instrument d’analyse de suivi des nanoparticules pour estimer la distribution de taille et la concentration totale de particules de vésicules extracellulaires isolées du tissu adipeux périgornadique de souris et du plasma humain.
Abstract
Les rôles physiologiques et physiopathologiques des vésicules extracellulaires (VE) sont de plus en plus reconnus, faisant du domaine des VÉHICULES électriques un domaine de recherche en évolution rapide. Il existe de nombreuses méthodes différentes pour l’isolation des véhicules électriques, chacune présentant des avantages et des inconvénients distincts qui affectent le rendement en aval et la pureté des véhicules électriques. Ainsi, caractériser la préparation EV isolée d’une source donnée par une méthode choisie est importante pour l’interprétation des résultats en aval et la comparaison des résultats entre les laboratoires. Diverses méthodes existent pour déterminer la taille et la quantité de VE, qui peuvent être modifiées par des états pathologiques ou en réponse à des conditions externes. L’analyse de suivi des nanoparticules (NTA) est l’une des principales technologies utilisées pour l’analyse à haut débit des véhicules électriques individuels. Nous présentons ici un protocole détaillé pour la quantification et la détermination de la taille des VE isolés du tissu adipeux périgornadique de souris et du plasma humain à l’aide d’une technologie révolutionnaire pour la NTA représentant des avancées majeures dans le domaine. Les résultats démontrent que cette méthode peut fournir des données reproductibles et valides sur la concentration totale des particules et la distribution granulométrique pour les VE isolés de différentes sources à l’aide de différentes méthodes, comme le confirme la microscopie électronique à transmission. L’adaptation de cet instrument à la NTA permettra de répondre à la nécessité d’une normalisation des méthodes de la NTA afin d’accroître la rigueur et la reproductibilité dans la recherche sur les VE.
Introduction
Les vésicules extracellulaires (VE) sont de petites vésicules membranaires (0,03-2 μm) sécrétées par presque tous les types de cellules1. Ils sont souvent appelés « exosomes », « microvésicules » ou « corps apoptotiques » en fonction de leur mécanisme de libération et de leur taille2. Alors qu’on pensait au départ que les VE étaient simplement un moyen d’éliminer les déchets de la cellule pour maintenir l’homéostasie3,nous savons maintenant qu’ils peuvent également participer à la communication intercellulaire via le transfert de matériel moléculaire – y compris l’ADN, l’ARN (ARNm, microARN), les lipides et les protéines4,5 – et qu’ils sont d’importants régulateurs de la physiologie normale ainsi que des processus pathologiques1, 5,6,7,8.
Il existe de nombreuses méthodes différentes pour isoler et quantifier les VE, qui ont été décritesailleurs 9,10,11,12. Le protocole d’isolement utilisé ainsi que la source des véhicules électriques peuvent avoir un impact considérable sur le rendement et la pureté des véhicules électriques. Même la centrifugation différentielle, longtemps considérée comme l’approche « étalon-or » pour l’isolement des exosomes, peut être sujette à une variabilité substantielle ayant par la suite un impact sur la population de VE obtenue et les analyses en aval13. Ainsi, les différentes méthodologies d’isolement et de quantification des VE rendent difficile la comparaison, la reproduction et l’interprétation des résultats des expériences rapportées dans la littérature14. En outre, la libération de VE peut être régulée par des conditions cellulaires ou divers facteurs externes. Il a été suggéré que les VE jouent un rôle dans le maintien de l’homéostasie cellulaire en protégeant les cellules contre le stress intracellulaire15, car plusieurs études ont montré que le stress cellulaire stimule la sécrétion de VE. Parexemple, une augmentation de la libération de VE a été rapportée après une exposition cellulaire à l’hypoxie, au stress du réticulum endoplasmique, au stress oxydatif, au stress mécanique, à l’extrait de fumée de cigarette et à la pollution de l’air par les particules16,17,18,19, 20,21,22. Il a également été démontré que la libération de VE est modifiée in vivo; les souris soumises à un régime riche en graisses ou à un jeûne pendant seize heures ont libéré plus de VE adipocytaires23. Pour déterminer si un traitement ou une affection spécifique modifie la libération de VE, le nombre de VE doit être déterminé avec précision. L’évaluation de la distribution de la taille des VE peut également indiquer l’origine subcellulaire prédominante des VE (p. ex., fusion d’endosomes/corps multivésiculaires tardifs avec la membrane plasmique par rapport au bourgeonnement de la membrane plasmique)24. Il est donc nécessaire de mettre au point des méthodes robustes pour mesurer avec précision la concentration totale et la distribution granulométrique de la préparation ev étudiée.
Une méthode rapide et très sensible pour la visualisation et la caractérisation des véhicules électriques en solution est l’analyse de suivi des nanoparticules (NTA). Une explication détaillée des principes de cette méthode et une comparaison avec d’autres méthodes d’évaluation de la taille et de la concentration des VE ont été décrites précédemment25,26,27,28. En bref, lors de la mesure NTA, les véhicules électriques sont visualisés par la lumière diffusée lorsqu’ils sont irradiés avec un faisceau laser. La lumière diffusée est focalée par un microscope sur une caméra qui enregistre le mouvement des particules. Le logiciel NTA suit le mouvement thermique aléatoire de chaque particule, connu sous le nom de mouvement brownien, pour déterminer le coefficient de diffusion qui est utilisé pour calculer la taille de chaque particule à l’aide de l’équation de Stokes-Einstein. La NTA a été appliquée pour la première fois à la mesure des VE dans un échantillon biologique en 201125. Jusqu’à récemment, il n’y avait que deux sociétés grand public offrant des instruments NTA commerciaux29 jusqu’à l’introduction du ViewSizer 3000 (ci-après dénommé l’instrument de suivi des particules) qui utilise une combinaison de nouvelles solutions matérielles et logicielles pour surmonter les limites importantes d’autres techniques NTA.
L’instrument de suivi des particules caractérise les nanoparticules dans les échantillons liquides en analysant leur mouvement brownien et caractérise les particules plus grosses de la taille d’un micron en analysant la décantation gravitationnelle. Le système optique unique de cet instrument, qui comprend un éclairage multispectral avec trois sources de lumière laser (à 450 nm, 520 nm et 635 nm), permet aux chercheurs d’analyser simultanément un large éventail de tailles de particules (par exemple, exosomes, microvésicules). Un schéma de la configuration de l’instrument est illustré à la figure 1.
Ici, nous montrons comment effectuer des mesures de distribution granulométrique et de concentration de véhicules électriques isolés de souris et d’humains à l’aide d’un nouvel instrument NTA.
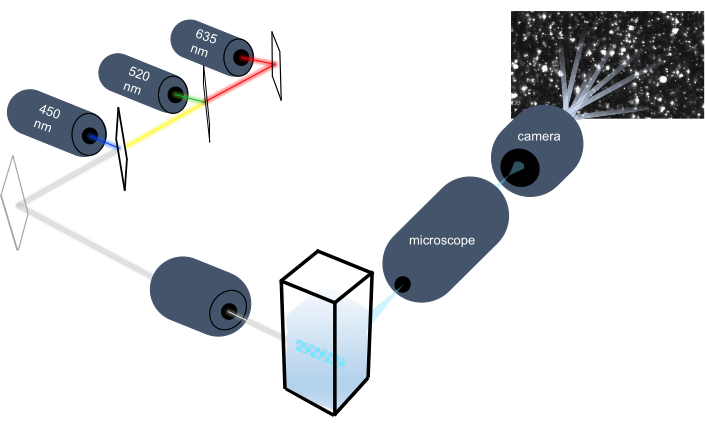
Figure 1: Système optique d’instrument de suivi des particules. L’instrument NTA éclaire les particules à l’aide de trois lasers avec les longueurs d’onde suivantes : 450 nm, 520 nm, 635 nm. L’enregistrement vidéo de la lumière diffusée à partir de particules individuelles est détecté et suivi par une caméra vidéo numérique orientée à 90 ° de la cuvette. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Ici, nous démontrons un protocole pour la NTA des VE pour mesurer simultanément la distribution granulométrique d’une large gamme de tailles de particules et mesurer la concentration totale de VE dans un échantillon polydispersé. Dans cette étude, le tissu adipeux périgornadique de souris et le plasma humain ont été utilisés comme source de VE. Cependant, les VE isolés d’autres tissus ou liquides biologiques tels que le sérum, l’urine, la salive, le lait maternel, le liquide amniotique et le surnageant …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par les National Institutes of Health (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Nous reconnaissons Jeffrey Bodycomb, Ph.D. de HORIBA Instruments Incorporated pour son aide à calibrer l’instrument.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
Riferimenti
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

