Анализ отслеживания наночастиц для количественной оценки и определения размера внеклеточных везикул
Summary
Мы демонстрируем, как использовать новый инструмент для анализа отслеживания наночастиц для оценки распределения по размеру и общей концентрации частиц внеклеточных везикул, выделенных из перигонадной жировой ткани мыши и плазмы человека.
Abstract
Физиологические и патофизиологические роли внеклеточных везикул (EV) становятся все более признанными, что делает область EV быстро развивающейся областью исследований. Существует множество различных методов изоляции электромобилей, каждый из которых имеет свои преимущества и недостатки, которые влияют на выход и чистоту электромобилей. Таким образом, характеристика подготовки EV, изолированной от заданного источника выбранным методом, важна для интерпретации последующих результатов и сравнения результатов в разных лабораториях. Существуют различные методы определения размера и количества EV, которые могут быть изменены болезненными состояниями или в ответ на внешние условия. Анализ отслеживания наночастиц (NTA) является одной из выдающихся технологий, используемых для высокопроизводительного анализа отдельных электромобилей. Здесь мы представляем подробный протокол количественной оценки и определения размера EV, выделенных из перигонадной жировой ткани мыши и плазмы человека, с использованием прорывной технологии для NTA, представляющей основные достижения в этой области. Результаты показывают, что этот метод может предоставлять воспроизводимые и достоверные данные об общей концентрации частиц и распределении по размеру для электромобилей, выделенных из разных источников с использованием различных методов, что подтверждается просвечиваюрной электронной микроскопией. Адаптация этого инструмента для NTA позволит рассмотреть необходимость стандартизации методов NTA для повышения строгости и воспроизводимости в исследованиях EV.
Introduction
Внеклеточные везикулы (EV) представляют собой небольшие (0,03-2 мкм) связанные с мембраной везикулы, секретируемые почти всеми типами клеток1. Их часто называют «экзосомами», «микровезикулами» или «апоптотическими телами» в зависимости от их механизма высвобождения и размера2. Хотя первоначально считалось, что электромобили были просто средством устранения отходов из клетки для поддержания гомеостаза3,теперь мы знаем, что они также могут участвовать в межклеточной коммуникации посредством переноса молекулярного материала, включая ДНК, РНК (мРНК, микроРНК), липиды и белки4,5, и что они являются важными регуляторами нормальной физиологии, а также патологических процессов1, 5,6,7,8.
Существует множество различных методов выделения и количественной оценки электромобилей, которые были описаны в других разделах9,10,11,12. Используемый протокол изоляции, а также источник электромобилей могут сильно повлиять на выход и чистоту электромобилей. Даже дифференциальное центрифугирование, долгое время считавшийся подходом «золотого стандарта» для выделения экзосом, может подвергаться существенной изменчивости, впоследствии влияющей на популяцию электромобилей, полученную и последующий анализ13. Таким образом, различные методологии изоляции и количественной оценки электромобилей затрудняют сравнение, воспроизведение и интерпретацию результатов экспериментов, о которых сообщается в литературе14. Кроме того, высвобождение EV может регулироваться клеточными условиями или различными внешними факторами. Было высказано предположение, что EV играют роль в поддержании клеточного гомеостаза, защищая клетки от внутриклеточного стресса15,поскольку несколько исследований показали, что клеточный стресс стимулирует секрецию EV. Например, сообщалось об увеличении высвобождения EV после клеточного воздействия гипоксии, эндоплазматического стресса риткулума, окислительного стресса, механического стресса, экстракта сигаретного дыма и загрязнения воздуха твердыми частицами16,17,18,19,20,21,22. Также было показано, что релиз EV модифицируется in vivo; мыши, подвергаемые диете с высоким содержанием жиров или голодания в течение шестнадцати часов, высвобождали больше адипоцитарных EV23. Чтобы выяснить, изменяет ли конкретное лечение или состояние высвобождение EV, количество EV должно быть точно определено. Оценка распределения EV по размерам может также указывать на преобладающее субклеточное происхождение EV (например, слияние поздних эндосом/мультивезикулярных тел с плазматической мембраной против почкоделения плазматической мембраны)24. Таким образом, существует потребность в надежных методах для точного измерения общей концентрации и распределения по размерам изучаемого ev prep.
Быстрым и высокочувствительным методом визуализации и характеристики электромобилей в растворе является анализ отслеживания наночастиц (NTA). Подробное объяснение принципов применения данного метода и сравнение с альтернативными методами оценки размера и концентрации ЭВ были описаныранее 25,26,27,28. Вкратце, во время измерения NTA электромобили визуализируются светом, рассеянным при их облучении лазерным лучом. Рассеянный свет фокусируется микроскопом на камере, которая записывает движение частиц. Программное обеспечение NTA отслеживает случайное тепловое движение каждой частицы, известное как броуновское движение, чтобы определить коэффициент диффузии, который используется для расчета размера каждой частицы с использованием уравнения Стокса-Эйнштейна. NTA был впервые применен для измерения EV в биологическом образце в 2011году25. До недавнего времени существовало только две основные компании, предлагающие коммерческие инструменты NTA29 до появления ViewSizer 3000 (далее именуемого инструментом отслеживания частиц), который использует комбинацию новых аппаратных и программных решений для преодоления значительных ограничений других методов NTA.
Инструмент отслеживания частиц характеризует наночастицы в жидких образцах путем анализа их броуновского движения и характеризует более крупные частицы микронный размером, анализируя гравитационное оседание. Уникальная оптическая система этого прибора, которая включает в себя мультиспектральное освещение с тремя лазерными источниками света (при 450 нм, 520 нм и 635 нм), позволяет исследователям анализировать широкий диапазон размеров частиц (например, экзосомы, микровезикулы) одновременно. Схема установки прибора показана на рисунке 1.
Здесь мы демонстрируем, как выполнять измерения размера частиц и концентрации изолированных электромобилей мышей и человека с помощью нового инструмента NTA.
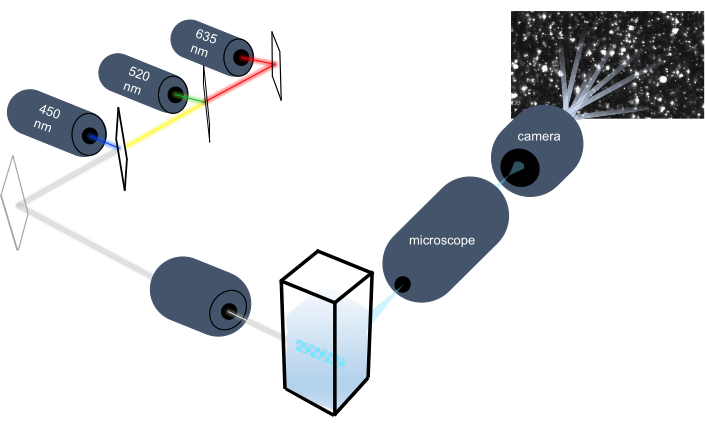
Рисунок 1:Оптическая система прибора слежения за частицами. Прибор NTA освещает частицы с помощью трех лазеров со следующими длинами волн: 450 нм, 520 нм, 635 нм. Видеозапись рассеянного света от отдельных частиц обнаруживается и отслеживается цифровой видеокамерой, ориентированной на 90° от кюветы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Здесь мы демонстрируем протокол для NTA электромобилей для измерения распределения по размерам широкого диапазона размеров частиц одновременно и измерения общей концентрации EV в полидисперсном образце. В этом исследовании перигонадная жировая ткань мыши и плазма человека были исполь…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана Национальными институтами здравоохранения (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Мы благодарим Джеффри Бодикомба, доктора философии HORIBA Instruments Incorporated, за его помощь в калибровке прибора.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
Riferimenti
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

