スクリーニング用途のための線維芽細胞由来ヒト工学的結合組織
Summary
ここで提示されるプロトコルは、機械研究、疾患モデリング、およびスクリーニング用途に適した、二重極を有するマルチウェルプレートで48組織の平行培養のための設計された結合組織を生成するプロトコルである。プロトコルは、異なる臓器や種からの線維芽細胞と互換性があり、ヒトの原発性心臓線維芽細胞とここで例示される。
Abstract
線維芽細胞は、生化学的および生体力学的刺激に応答して、すぐに筋線維芽細胞にトランスファ分化する、典型的に非常に動的な細胞である。心臓線維症を含む線維化プロセスの現在の理解は貧弱なままであり、新しい抗線維化療法の開発を妨げている。制御可能で信頼性の高いヒトモデルシステムは、線維症病理をよりよく理解するために重要です。これは、3次元(3D)環境における線維芽細胞および線維組織の病態生理学の研究を容易にするために、48ウェル鋳造板で設計された結合組織(ECT)を生成する高度に再現性と拡張性の高いプロトコルです。ECTは、調整可能な剛性を有する極の周りに生成され、定義された生体力学的負荷の下での研究を可能にする。定義された荷重条件の下で、細胞とマトリックスの相互作用によって制御される表述法の適応を検討することができる。並列テストは、負荷に対する組織圧縮や収縮などの複数のパラメータのタイムコース分析の機会を持つ48ウェル形式で実現可能です。これらのパラメータから、組織の剛性や弾力性などの生体力学的特性を検討することができる。
Introduction
線維性疾患の研究における大きな障害は、線維芽細胞とその病理学的誘導体の挙動に関する洞察を提供する代表的なヒト3D組織モデルの欠如である。繊維プロセスを研究するために、標準的な2D培養システムは、非準拠の2D基質上で培養した場合、分離繊維芽細胞がα平滑筋アクチン(SMA)に急速にトランス分化されるため、最適ではない。したがって、標準2D培養における線維芽細胞は、規則的な「健康な」組織表現型3、4、5、6を反映していない。柔軟な基質上の培養物は、非繊維性(10kPa)および繊維(35kPa)組織環境をシミュレートするために導入されているが、これらは、病態生理学に関して非常に重要である第3の次元を欠いている。組織工学は、定義された実験的に調整可能な細胞外マトリックス(ECM)コンテキストにおいて線維芽細胞培養を可能にすることによって、この限界を克服する機会を提供する。例えば、細胞性、ECM組成、およびECM濃度の変化によって、そのすべてが組織バイオメカニクスを決定することができる。
線維芽細胞を用いて様々な3Dモデルが生成されている。フローティングディスクとマイクロスフィアは、最初の一つであったし、コラーゲンが再モデリングされ、時間に依存して圧縮されていることを実証しました。線維芽細胞は、コラーゲン線維に対して牽引力を発揮し、成長因子-β1(TGF-β1)を変換するなどのプロ線維化剤の添加によって促進できるプロセスである。8,9,10,11,12,13,14,15,16.しかし、自由に浮動するカルチャでは、制御された外部ローディングが許可されないため、モデルの縮小や圧縮が連続的に行われます。シート状の工学的組織は、ユニ、バイ、多軸、または周期株試験を通じて、組織の生体力学的特性のホメオ静電気調節を研究する可能性を開いた17,18,19,20.これらのモデルは、例えば、細胞数が組織の剛性に及ぼす影響を実証するために使用されており、細胞骨格の完全性およびアトミオシン細胞骨格収縮と正の相関性を有することが判明した。18,19.ただし、力変換器とアンカーポイントのクランプポイントの周囲の不均一な組織変形によって、力と歪みへの変換が複雑であることに注意することが重要です。この固有の制限は、犬の骨やリング状の組織によってバイパスすることができ、アンカーポイントでいくつかの組織執行を提供します21,22,23.リング状の組織は、細胞コラーゲンヒドロゲルをリング型の金型に分散させることで作製できます。ヒドロゲルがコンパクト化するにつれて、組織は型の非圧縮性の内側の棒の周りに形成され、さらなる組織収縮のための抵抗性を提供する24,25,26,27.最初および典型的な最大圧縮の後、組織はまた、定義された組織の長さで円形ECTをさらに抑制するために調節可能なスペーサーに移すことができる3,24,25,26,27,28,29,30.生物物理学的特性は、単方向または動的歪みの下で適切なロードセルを備えた標準的な水平または垂直歪みストレスデバイスで評価することができます3.組織は大部分が均一な円形構造を持ち、バー/フック(アンカレッジポイントおよび/または力トランスデューサ)に保持することができるので、これらはまだローディングバーの周りの圧縮領域を囲むかもしれませんが、この形式はクランプと比較してより均一な歪みの変化を可能にします3.さらに、アンカー組織は双極細胞形状を惹起し、異方性牽引を促進する力線に沿った伸びによって細胞が組織力に適応する31,32,33,34,35,36.我々は以前、機能的ストレス株実験で単一の硬い極の周りにラットおよびヒト心臓線維芽細胞(CF)からリング状のECTを適用し、ウイルスに感染した線維芽細胞を使用して機能の利益と喪失の研究を行った24,25,26 および薬理学的研究37.さらに、ECTモデルにおけるCF媒介性線維症の性差を特定できる27.
商業ベンダーから凍結保存CFとして得られたヒトの一次CF( 資料表を参照)で得られたヒトECTの生成のための次のプロトコルは、リング状の組織の利点と、並列高コンテンツテスト用に設計された48ウェルプラットフォーム用の巨視組織を簡単かつ迅速に製造する方法を組み合わせたものです。
重要なことに、ECTモデルは、特定の線維芽細胞型に限定されず、他の線維芽細胞の調査における文書化された使用、例えば、皮膚線維芽細胞38,39である。さらに、患者の生検からの線維芽細胞も同様にうまく機能し、線維芽細胞の選択は最終的に取り組む科学的な質問に依存する。
このプロトコルに記載されたECTの生成に使用されるプラットフォームは、市販の48ウェル3D細胞/組織培養プレートである(図1A)。48ウェルプレートの助けを借りて、定義された幾何学と機械的負荷の下でECTの形成と機能を調製、培養、およびモニタリングするための方法が記載されています。形成されたECTは統合された適用可能な極によって握られ、機械負荷は異なった硬度の極(Shore A値36-89)を使用して、曲げ剛性に影響を与えることによって最終的な目的に従って微調整することができる。海岸の電柱 値は 46 です。プロトコルは、さらに、ECTが単一の堅いrod37の周りに保持される、以前に説明されたカスタム円形の金型と互換性がある。この金型の寸法は 図1Bに示されています。
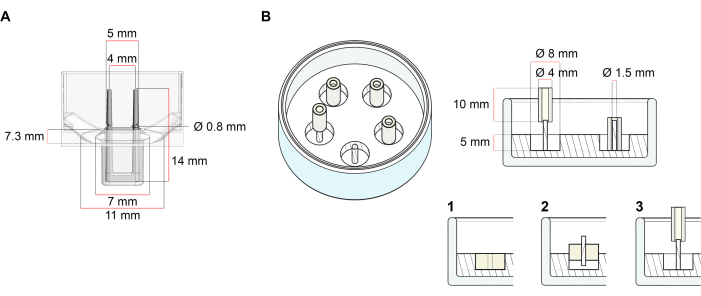
図1:鋳造金型の概略図 (A) 2つの柔軟なポールを持つ鋳造金型の技術図面と寸法。金型は、金型本体に二重保持極を保持する短い壁で区切られた内周を含みます。柔軟な極は互いに自由な水平距離を有し、基盤で接続されている。金型は180 μLの鋳造体積を可能にします。各金型のウェルは、少なくとも600 μLの培養培地の体積容量を可能にします。異なる材料組成物は、特定の剛性を有する極(例えば、TM5MED-TM9MED)を製造するために使用することができる。(B)技術的な図面と単一の硬いロッドを持つリング状の金型の寸法。これは、ECT鋳造プロトコル37で使用できる、明確な幾何学と機械環境を備えた代替金型です。リング状の金型組立方法は、公開された大きなフォーマット28,41から適応した。簡単に言えば、この方法は、(1)ポリテトラフルオロエチレン(PTFE)成形スペーサー(8mm径)をガラス皿に注いだポリジメチルシロキサン(PDMS、シリコーン)(直径60mm)、および(2)PDMSポールホルダー(直径1.5mm)を固定して、形成された中空空洞の内側に同心円状に固定し、(3)直径(3)を固定する。中空空間により、180 μLの鋳造体積が可能になります。各ガラス皿は、複数のインプリント型(例えば5つの金型で示される)をコンポートすることができ、培養培地の最大5 mLの容量を有する。この図の大きなバージョンを表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
提示されたプロトコルは、細胞外マトリックス環境に対するこれらの細胞の機械的影響を研究することを可能にする、一次ヒトCFからのECTの生成を記述し、その逆もまた同様である。
線維芽細胞は、計画されたECT実験(0.75 x 106 細胞/ECT)に十分な細胞を得るために拡張する必要があります。最良の再現性のために、ECT生成で使用する前に、各通路内で80%の合流度ま?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この研究は、ドイツ心臓協会(GLSのためのDGK研究フェローシップ)とドイツ研究財団(GLSおよびADのためのプロジェクトIRTG 1816を通じてDFG)によって支えられました。MT の DFG 417880571および DFG TI 956/1-1;MT および WHZ のための SFB 1002 TP C04;WHZ のための SFB 1002 TP S01;および EXC 2067/1-390729940J WHZ 用)。WHZは、ドイツ連邦科学教育省(プロジェクトIndiHEARTを通じてBMBF)とフォンダシオン・ルデュック(20CVD04)によってサポートされています。MT、WHZ、SLはドイツ心臓血管研究センター(DZHK)によってサポートされています。
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Riferimenti
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Biologia dello sviluppo. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

