Fibroblast Türetilmiş İnsan Tarafından Tasarlanmış Bağ Dokusu Tarama Uygulamaları için
Summary
Burada sunulan, mekanistik çalışmalar, hastalık modelleme ve tarama uygulamaları için uygun, çift kutuplu çok kuyulu bir plakada 48 dokudan oluşan paralel bir kültür için tasarlanmış bağ dokuları üretmek için bir protokoldür. Protokol, farklı organ ve türlerden fibroblastlarla uyumludur ve burada insan primer kardiyak fibroblastlarla örneklenmiştir.
Abstract
Fibroblastlar fenotipik olarak son derece dinamik hücrelerdir ve biyokimyasal ve biyomekanik uyaranlara yanıt olarak hızla miyofibroblastlara transdifferentiate. Kardiyak fibrozis de dahil olmak üzere fibrotik süreçlerin mevcut anlayışı zayıf kalır ve bu da yeni anti-fibrotik tedavilerin gelişimini engeller. Kontrol edilebilir ve güvenilir insan modeli sistemleri fibrozis patolojisinin daha iyi anlaşılması için çok önemlidir. Bu, fibroblastların ve fibrotik dokunun patofizyolojisinin 3 boyutlu (3D) bir ortamda çalışmalarını kolaylaştırmak için 48 kuyulu bir döküm plakasında mühendislik bağ dokuları (EKT) oluşturmak için son derece tekrarlanabilir ve ölçeklenebilir bir protokoldür. EKT, kutupların etrafında ayarlanabilir sertlik ile üretilir ve tanımlanmış bir biyomekanik yük altında çalışmalara izin verir. Tanımlanan yükleme koşullarında hücre-matris etkileşimleri ile kontrol edilen fenotipik adaptasyonlar incelenebilir. Paralel test, doku sıkıştırma ve yüke karşı kasılma gibi birden fazla parametrenin zaman dilimi analizi fırsatı ile 48 kuyu formatında uygulanabilir. Bu parametrelerden doku sertliği ve elastikiyet gibi biyomekanik özellikler incelenebilir.
Introduction
Fibrotik hastalıkların incelenmesinde önemli bir engel, fibroblastların davranışları ve patolojik türevleri hakkında fikir veren temsili insan 3D doku modellerinin olmamasıdır. Fibrotik süreçleri incelemek için, standart 2D kültür sistemleri alt optimaldir, çünkü izole fibroblastlar, uyumlu olmayan 2D substratlarda kültürlendiğinde α düz kas aktinine (SMA) hızla transdifferentiate olurlar1,2,3. Bu nedenle, standart 2D kültüründeki fibroblastlar düzenli bir “sağlıklı” doku fenotipini yansıtmaz3,4,5,6. Fibrotik olmayan (10 kPa) ve fibrotik (35 kPa) doku ortamlarını simüle etmek için esnek substratlardaki kültürler tanıtılmıştır7, ancak bunlar patofizyoloji açısından çok önemli olan üçüncü boyuttan yoksundur. Doku mühendisliği, fibroblast kültürüne tanımlanmış ve deneysel olarak tonlanabilir hücre dışı matris (ECM) bağlamında, örneğin hücresellik, ECM bileşimi ve ECM konsantrasyonundaki değişikliklerle izin vererek bu sınırlamanın üstesinden gelme fırsatı sağlar, bunların hepsi doku biyomekaniğini belirleyebilir.
Fibroblastlar kullanılarak çeşitli 3D modeller üretilmiştir. Yüzen diskler ve mikroküreler ilkler arasındaydı ve kolajenin zamana bağlı bir şekilde yeniden şekillendirildiğini ve sıkıştırıldığını gösteriyor. Fibroblastlar kollajen fibriller üzerinde çekiş kuvvetleri uygular, büyüme faktörü-beta 1 (TGF-β1) gibi pro-fibrotik ajanların eklenmesiyle kolaylaştırılabilir bir süreçtir.8,9,10,11,12,13,14,15,16. Bununla birlikte, serbestçe yüzen kültürler kontrollü dış yüklemeye izin vermez ve bu nedenle sürekli küçülen veya sıkıştırıcı modeller oluşturur. Levha benzeri mühendislik dokuları, dokuların biyomekanik özelliklerinin homeostatik düzenlemesini, yani uni, bi, multiaksiyel veya döngüsel suş testi yoluyla inceleme imkanını açtı.17,18,19,20. Bu modeller, örneğin, hücre sayısının doku sertliği üzerindeki etkisini göstermek için kullanılmıştır, bu da sitoskeleton bütünlüğü ve aktomiyosin sitoskeleton kontrtilitesi ile pozitif olarak ilişkili bulunmuştur.18,19. Bununla birlikte, gerinim kuvveti dönüşümlerinin, kuvvet dönüştürücülerinin ve çapa noktalarının kelepçe noktalarının etrafındaki homojen olmayan doku deformasyonu ile karmaşık olduğunu belirtmek önemlidir. Bu doğal sınırlama, köpek kemiği veya halka şeklindeki dokular tarafından atlanabilir ve çapa noktalarında bazı doku uygulamaları sunar21,22,23. Halka şeklindeki dokular, hücre-kollajen hidrojelleri halka şeklindeki kalıplara dağıtılarak hazırlanabilir. Hidrojel sıkıştırırken, kalıbın sıkıştırılamaz iç çubuğunun etrafında bir doku oluşur ve bu da daha fazla doku kasılması için direnç sunar.24,25,26,27. İlk ve tipik olarak maksimum sıkıştırmadan sonra, dokular tanımlanmış bir doku uzunluğunda dairesel EKT’yi daha fazla kısıtlamak için ayarlanabilir aralayıcılara da aktarılabilir3,24,25,26,27,28,29,30. Biyofiziksel özellikler, tek yönlü veya dinamik gerinim altında uygun yük hücrelerine sahip standart yatay veya dikey gerinim gerinim cihazlarında değerlendirilebilir3. Dokular büyük ölçüde düzgün dairesel bir yapıya sahip olduğu ve çubuklar / kancalar (ankraj noktaları ve / veya kuvvet dönüştürücüleri) üzerinde tutulabildiğinden, bunlar hala yükleme çubuklarının etrafındaki sıkıştırma alanlarını kaplayabilir, ancak bu format sıkıştırmaya kıyasla daha düzgün bir gerinim varyasyonu sağlar.3. Ayrıca, bağlantılı dokular bipolar hücre şekli ortaya çıkarır ve hücreler anisotropik çekişi teşvik eden kuvvet çizgileri boyunca uzayarak doku kuvvetlerine uyum sağlar.31,32,33,34,35,36. Daha önce fonksiyonel stres-suş deneylerinde tek bir sert kutbun etrafına sıçan ve insan kardiyak fibroblastlarından (CF) halka şeklinde EKT uyguladık ve viral olarak transdüklenmiş fibroblastlar kullanarak fonksiyon çalışmaları kazandır ve kaybettik.24,25,26 ve farmakolojik çalışmalar37. Ayrıca, ECT modelinde CF aracılı fibroziste cinsiyet farklılıklarını belirleyebiliriz.27.
Ticari satıcılardan kriyoprezer korunmuş CF olarak elde edilen birincil insan CF’si ile örneklendirilen insan EKT’nin üretimi için aşağıdaki protokol (bkz. Malzeme Tablosu), halka şeklindeki dokuların avantajlarını paralel yüksek içerikli testler için tasarlanmış 48 kuyulu bir platform için makroskopik dokular üretmenin kolay ve hızlı bir yolu ile birleştirir.
Daha da önemlisi, EKT modeli belirli bir fibroblast tipi ile sınırlı değildir, örneğin cilt fibroblastları38,39 gibi diğer fibroblastların araştırılmasında belgelenmiş kullanım ile. Ayrıca, hastanın biyopsilerinden elde edilen fibroblastlar eşit derecede iyi çalışır ve fibroblast seçimi sonuçta ele alınacak bilimsel soruya bağlıdır.
Bu protokolde açıklanan ECT üretimi için kullanılan platform, piyasada bulunan 48 kuyulu 3D hücre/doku kültürü plakasıdır (Şekil 1A). 48 kuyu plakası yardımıyla tanımlanmış bir geometri ve mekanik yük altında AİHM oluşumu ve işlevinin hazırlanması, kültlenmesi ve izlenmesi yöntemleri açıklanmıştır. Oluşan EKT entegre esnek kutuplar tarafından tutulur ve mekanik yük, bükme sertliklerini etkileyen farklı sertliğe sahip kutuplar (Shore A değeri 36-89) kullanılarak nihai amaca göre ince ayar yapılabilir. Kıyı A değeri 46 olan kutuplar önerilir. Protokol ayrıca, AİHM’nin tek bir sert çubuk etrafında tutulduğu daha önce tanımlanmış özel dairesel bir kalıpla uyumludur37. Bu kalıbın boyutları Şekil 1B’de verilmiştir.
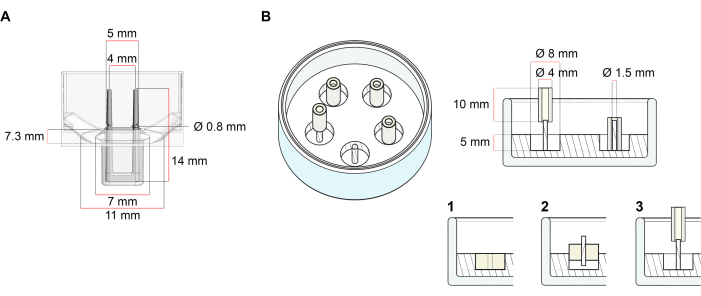
Şekil 1: Döküm kalıplarının şematik gösterimi. (A) İki esnek kutuplu döküm kalıbın teknik çizimi ve boyutları. Kalıp, kalıbın ana gövdesinde çift istinat direkleri tutan kısa bir duvarla sınırlandırılmış bir iç çevreden oluşur. Esnek direkler birbirine serbest yatay mesafeye sahiptir ve tabana bağlanır. Kalıp 180 μL döküm hacmine izin verir. Her kalıbın kuyusu, en az 600 μL kültür ortamı hacim kapasitesi sağlar. Farklı malzeme bileşimleri, belirli sertliklere sahip kutuplar üretmek için kullanılabilir (örneğin, TM5MED-TM9MED). (B) Tek bir sert çubuklu halka şeklindeki kalıbın teknik çizimi ve boyutları. Bu, AİHM döküm protokolü37 ile kullanılabilen farklı geometriye ve mekanik ortama sahip alternatif bir kalıptır. Halka şeklindeki kalıp montaj yöntemi yayınlanan daha büyük formatlardan uyarlanmıştır28,41. Kısacası, yöntem (1) polidimetilsiloksan (PDMS), silikon) cam tabaklara dökülür (çapı 60 mm) ve (2) bir PDMS kutup tutucusunu (1,5 mm çapında) oluşan içi boş boşluğun içine merkezi olarak sabitlemek, bu da (3) çıkarılabilir bir direği (4 mm çapında silikon tüp) tutmaya yarar. İçi boş alan sonucu 180 μL döküm hacmi sağlar. Her cam tabak birden fazla baskılı kalıbı (örnek olarak 5 kalıpla gösterilmiştir) komporte edebilir ve 5 mL’ye kadar kültür ortamı kapasitesine sahiptir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Sunulan protokol, bu hücrelerin hücre dışı matris ortamları üzerindeki mekanik etkisinin incelenmesine izin veren birincil insan CF’sinden EKT’nin üretilmesini açıklar.
Planlanan EKT deneyleri (0,75 x 106 hücre/EKT) için yeterli hücre elde etmek için fibroblastların genişletilmesi gerekir. En iyi tekrarlanabilirlik için, 2D monolayer kültüründe kültür öncesi dondurulmuş veya dokudan türetilmiş fibroblastların, her pasajda % 80’e kadar standartlaştırılm?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Bu çalışma Alman Kardiyak Derneği (GLS için DGK Araştırma Bursu) ve Alman Araştırma Vakfı (DFG tarafından GLS ve AD için IRTG 1816 projesi aracılığıyla desteklenmiştir; MT için DFG 417880571 ve DFG TI 956/1-1; MT ve WHZ için SFB 1002 TP C04; WHZ için SFB 1002 TP S01; ve WHZ için EXC 2067/1-390729940J). WHZ, IndiHEART projesi aracılığıyla Alman Federal Bilim ve Eğitim Bakanlığı (BMBF) ve Fondation Leducq (20CVD04) tarafından desteklenmektedir. MT, WHZ ve SL, Alman Kardiyovasküler Araştırmalar Merkezi (DZHK) tarafından desteklenmektedir.
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Riferimenti
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Biologia dello sviluppo. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

