Tecido conjuntivo de engenharia humana derivada do fibroblasto para aplicações de triagem
Summary
Apresentado aqui é um protocolo para gerar tecidos conjuntivos projetados para uma cultura paralela de 48 tecidos em uma placa multi-bem com polos duplos, adequado para estudos mecanísticos, modelagem de doenças e aplicações de rastreamento. O protocolo é compatível com fibroblastos de diferentes órgãos e espécies e é exemplificado aqui com fibroblastos cardíacos primários humanos.
Abstract
Os fibroblastos são células fenotipicamente altamente dinâmicas, que rapidamente se transviam em miofibroblasts em resposta a estímulos bioquímicos e biomecânicos. A compreensão atual dos processos fibrosos, incluindo a fibrose cardíaca, continua fraca, o que dificulta o desenvolvimento de novas terapias anti-fibrosas. Sistemas de modelos humanos controláveis e confiáveis são cruciais para uma melhor compreensão da patologia da fibrose. Trata-se de um protocolo altamente reprodutível e escalável para gerar tecidos conjuntivos projetados (ECT) em uma placa de fundição de 48 poços para facilitar estudos de fibroblastos e da fisiopatologia do tecido fibroso em um ambiente tridimensional (3D). A ECT é gerada ao redor dos polos com rigidez tabilidade, permitindo estudos sob uma carga biomecânica definida. Sob as condições de carregamento definidas, podem ser estudadas adaptações fenotípicas controladas por interações célula-matriz. Testes paralelos são viáveis no formato 48-well com a oportunidade de análise de tempo-curso de múltiplos parâmetros, como compactação tecidual e contração contra a carga. A partir desses parâmetros, podem ser estudadas propriedades biomecânicas como rigidez tecidual e elasticidade.
Introduction
Um grande obstáculo no estudo de doenças fibrosas é a falta de modelos representativos de tecido 3D humano que forneçam insights sobre o comportamento dos fibroblastos e seus derivados patológicos. Para estudar processos fibrosos, os sistemas de cultura 2D padrão são sub-ideais, uma vez que os fibroblastos isolados transdiferem rapidamente em α-smooth muscle actin (SMA) expressando miofibroblasts quando cultivados em substratos 2D não compatíveis1,2,3. Assim, os fibroblastos na cultura 2D padrão não refletem um fenótipo de tecido “saudável” regular3,4,5,6. Culturas em substratos flexíveis foram introduzidas para simular ambientes de tecidos não fibrosos (10 kPa) e fibrosos (35 kPa), mas estes não têm a terceira dimensão, o que é muito importante no que diz respeito à fisiopatologia. A engenharia de tecidos proporciona a oportunidade de superar essa limitação, permitindo a cultura do fibroblasto em um contexto de matriz extracelular (ECM) definida e experimentalmente, por alterações na celularidade, composição de ECM e concentração de ECM, tudo isso pode determinar a biomecânica tecidual.
Vários modelos 3D foram gerados usando fibroblastos. Discos flutuantes e microesferas estiveram entre os primeiros e demonstram que o colágeno é remodelado e compactado de forma dependente do tempo. Os fibroblastos exercem forças de tração em fibrilas de colágeno, um processo que pode ser facilitado pela adição de agentes pró-fibrosos, como a transformação do fator de crescimento-beta 1 (TGF-β1)8,9,10,11,12,13,14,15,16. No entanto, culturas livremente flutuantes não permitem o carregamento externo controlado e, portanto, constituem modelos de encolhimento ou compactação continuamente. Tecidos projetados em forma de folha abriram a possibilidade de estudar a regulação homeostática de propriedades biomecânicas dos tecidos, ou seja, através de testes de cepas uni, bi, multiaxial ou cíclica17,18,19,20. Esses modelos têm sido usados, por exemplo, para demonstrar a influência do número celular na rigidez tecidual, que foi encontrada para se correlacionar positivamente com a integridade do citoesqueleto e a contratilidade do citosqueleto18,19. No entanto, é importante notar que as conversões de força-a-tensão são complicadas pela deformação de tecido não uniforme em torno de pontos de fixação de transdutores de força e pontos de ancoragem. Essa limitação inerente pode ser contornada por tecidos em forma de osso de cachorro ou anel, oferecendo alguma aplicação tecidual em pontos de ancoragem21,22,23. Tecidos em forma de anel podem ser preparados distribuindo um hidrogel de colágeno celular em moldes em forma de anel. À medida que o hidrogel compacta, um tecido se forma em torno da haste interna descompressível do molde, que oferece resistência para maior contração tecidual24,25,26,27. Após a compactação inicial e tipicamente máxima, os tecidos também podem ser transferidos para espaçadores ajustáveis para conter ainda mais a ECT circular em um comprimento de tecido definido3,24,25,26,27,28,29,30. As propriedades biofísicas podem ser avaliadas em dispositivos de tensão horizontal ou vertical padrão com células de carga apropriadas sob tensão unidirecional ou dinâmica3. Como os tecidos possuem uma estrutura circular em grande parte uniforme e podem ser mantidos em barras/ganchos (pontos de ancoragem e/ou transdutores de força), embora estes ainda possam incluir áreas de compressão ao redor das barras de carregamento, este formato permite uma variação de tensão mais uniforme em comparação com a fixação3. Além disso, tecidos ancorados provocam uma forma celular bipolar, e as células se adaptam às forças teciduais pelo alongamento ao longo das linhas de força promovendo tração anisotrópico31,32,33,34,35,36. Nós já aplicamos ECT em forma de anel de fibroblastos cardíacos de ratos e humanos (CF) em torno de um único polo rígido em experimentos funcionais de tensão de estresse e realizamos ganhos e perdas de estudos de função usando fibroblastos viralmente transduzidos24,25,26 e estudos farmacológicos37. Além disso, poderíamos identificar diferenças sexuais na fibrose mediada por CF no modelo ECT27.
O seguinte protocolo para a geração de ECT humano, exemplificado com CF humano primário obtido como CF criopreservado de fornecedores comerciais (ver Tabela de Materiais), combina as vantagens dos tecidos em forma de anel com uma maneira fácil e rápida de produzir tecidos macroscópicos para uma plataforma de 48 poços projetada para testes paralelos de alto teor de conteúdo.
É importante ressaltar que o modelo ECT não se restringe a um tipo específico de fibroblasto, com o uso documentado na investigação de outros fibroblastos, por exemplo, fibroblastos de pele38,39. Além disso, os fibroblastos das biópsias do paciente funcionam igualmente bem, e a escolha dos fibroblastos depende, em última análise, da questão científica a ser abordada.
A plataforma utilizada para a geração de ECT descrita neste protocolo é uma placa de cultura celular/tecido 3D disponível comercialmente (Figura 1A). Os métodos para a formação, cultivo e monitoramento da formação e função ect sob uma geometria definida e carga mecânica com a ajuda da placa de 48 poços são descritos. A ECT formada é mantida por polos flexíveis integrados e a carga mecânica pode ser ajustada de acordo com o propósito final usando postes com dureza diferentes (Valor 36-89 da Costa A), influenciando suas rigidezs de dobra. Polos com uma costa Um valor de 46 são recomendados. O protocolo é, além disso, compatível com um molde circular personalizado descrito anteriormente, onde o ECT é mantido em torno de uma única haste rígida37. As dimensões deste molde são dadas na Figura 1B.
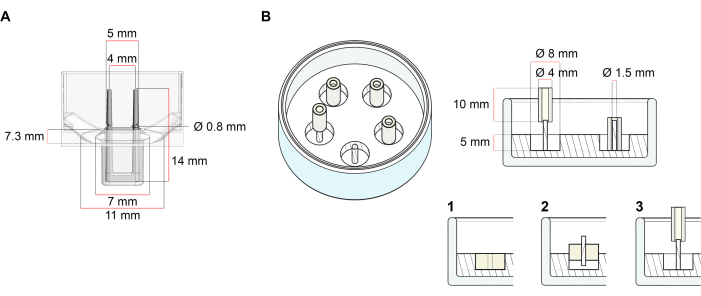
Figura 1: Representação esquemática dos moldes de fundição. (A) Desenho técnico e dimensões de um molde de fundição com dois polos flexíveis. O molde compreende uma circunferência interna delimitada por uma parede curta que contém polos de retenção duplas no corpo principal do molde. Os polos flexíveis têm uma distância horizontal livre entre si e estão conectados na base. O molde permite um volume de fundição de 180 μL. O poço de cada molde permite uma capacidade de volume de pelo menos 600 μL de mídia cultural. Diferentes composições materiais podem ser usadas para produzir polos com rigidezs específicas (por exemplo, TM5MED-TM9MED). (B) Desenho técnico e dimensões de um molde em forma de anel com uma única haste dura. Trata-se de um molde alternativo com geometria distinta e ambiente mecânico, que pode ser usado com o protocolo de fundição ECT37. O método de montagem do molde em forma de anel foi adaptado a partir de formatos maiores publicados28,41. Em suma, o método inclui (1) fixação de espaçadores de moldagem politetrafluoroetileno (PTFE) (8 mm de diâmetro) em polidimtilsiloxano (PDMS, silicone) derramado em pratos de vidro (diâmetro de 60 mm) e (2) fixação de um suporte de poste PDMS (1,5 mm de diâmetro) concentricamente dentro da cavidade oca formada, que serve para (3) segurar um poste removível (tubo de silicone de 4 mm de diâmetro). O resultante do espaço oco permite 180 μL de volume de fundição. Cada prato de vidro pode portar múltiplos moldes impressos (exemplarmente mostrados com 5 moldes) e tem capacidade para até 5 mL de meio de cultura. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O protocolo apresentado descreve a geração de ECT a partir de CF humano primário, o que permite estudar o impacto mecânico dessas células em seu ambiente de matriz extracelular e vice-versa.
Os fibroblastos precisam ser expandidos para produzir células suficientes para os experimentos planejados da ECT (0,75 x 106 células/ECT). Para a melhor reprodutibilidade, é aconselhável pré-cultura de fibroblastos congelados ou derivados de tecido na cultura de monocamadas 2D por uma …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pela Sociedade Cardíaca Alemã (DGK Research Fellowship for GLS) e pela German Research Foundation (DFG através do projeto IRTG 1816 para GLS e AD; DFG 417880571 e DFG TI 956/1-1 para MT; SFB 1002 TP C04 para MT e WHZ; SFB 1002 TP S01 para WHZ; e EXC 2067/1-390729940J para WHZ). A WHZ conta com o apoio do Ministério Federal alemão da Ciência e Educação (BMBF), através do projeto IndiHEART, e da Fondation Leducq (20CVD04). MT, WHZ e SL são apoiados pelo Centro Alemão de Pesquisa Cardiovascular (DZHK).
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Riferimenti
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Biologia dello sviluppo. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

