Tidsopløste Förster Resonans Energy Transfer Assays til måling af endogene fosforylerede STAT-proteiner i humane celler
Summary
Tidsopløste Förster-resonansenergioverførselscellebaserede assayprotokoller er beskrevet for den enkle, specifikke, følsomme og robuste kvantificering af endogene phosphorylerede signaltransducer og aktivator af transkription (STAT) 1/3/4/5/6 proteiner i cellelysater i et 384-brøndsformat.
Abstract
Janus kinase (JAK) / signaltransducer og aktivator af transkription (STAT) signalvejen spiller en afgørende rolle i formidlelsen af cellulære reaktioner på cytokiner og vækstfaktorer. STAT-proteiner aktiveres af tyrosinphosphorylering medieret hovedsageligt af JAB’er. Den unormale aktivering af STAT-signalveje er impliceret i mange menneskelige sygdomme, især kræft og immunrelaterede tilstande. Derfor er evnen til at overvåge STAT-proteinfosforylering inden for det oprindelige cellesignalmiljø vigtig for både akademisk og lægemiddelopdagelsesforskning. De traditionelle assayformater, der er tilgængelige for at kvantificere fosforylerede STAT-proteiner, omfatter western blotting og det enzymbundne immunosorbentassay (ELISA). Disse heterogene metoder er arbejdskrævende, lav gennemstrømning og ofte ikke pålidelige (specifikke) i tilfælde af vestlig blotting. Homogene (no-wash) metoder er tilgængelige, men forbliver dyre.
Her leveres detaljerede protokoller til følsom, robust og omkostningseffektiv måling i et 384-brøndsformat af endogene niveauer af fosforyleret STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694 / Y699) og STAT6 (Y641) i cellelysater fra klæbende eller suspensionsceller ved hjælp af den nye THUNDER tidsopløste Förster resonansenergioverførsel (TR-FRET) platform. Arbejdsgangen for det cellulære assay er enkel, hurtig og designet til screening med høj kapacitet (HTS). Assayprotokollen er fleksibel, bruger en prøve med lavt volumen (15 μL), kræver kun et reagenstilsætningstrin og kan tilpasses applikationer med lav gennemstrømning og høj gennemstrømning. Hvert phospho-STAT sandwich immunassay valideres under optimerede betingelser med kendte agonister og hæmmere og genererer de forventede farmakologi- og Z’-faktorværdier. Da TR-FRET-assays er ratiometriske og ikke kræver vasketrin, giver de meget bedre reproducerbarhed end traditionelle tilgange. Sammen giver denne række assays nye omkostningseffektive værktøjer til en mere omfattende analyse af specifikke fosforylerede STAT-proteiner efter cellebehandling og screening og karakterisering af specifikke og selektive modulatorer af JAK / STAT-signalvejen.
Introduction
JAK / STAT-signalvejen spiller en nøglerolle i formidlelsen af cellulære reaktioner på forskellige cytokiner, interferoner, vækstfaktorer og relaterede molekyler1,2. Bindingen af disse ligander til specifikke celleoverfladereceptorer resulterer i aktivering af DYK’er, som igen aktiverer STAT-proteiner ved fosforylering af specifikke tyrosinrester. STAT fosforylering resulterer i deres dimerisering og translokation i kernen, hvor de udøver deres virkning på transkriptionen af regulerede målgener. STAT-familien består af syv medlemmer: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b og STAT6. Medlemmerne spiller en kompleks og væsentlig rolle i reguleringen af fysiologiske celleprocesser, herunder spredning, differentiering, apoptose, angiogenese og immunsystemregulering. Den unormale aktivering af STAT-signalveje er impliceret i mange humane sygdomme, især kræft og immunrelaterede tilstande3,4. Derfor er evnen til at vurdere STAT-proteinfosforylering inden for det oprindelige cellesignalmiljø vigtig for både akademisk og lægemiddelopdagelsesforskning.
Til dato er de konventionelle metoder, der anvendes til måling af intracellulære fosforylerede proteinniveauer, herunder STET’er, antistofbaserede og omfatter western blotting, ELISA og phosphoflowcytometri. Disse heterogene metoder er arbejdskrævende, tidskrævende, fejlbehæftede, lave gennemstrømninger og ofte upålidelige (f.eks. Specificitetsproblemer) i tilfælde af vestlig blotting5. I modsætning hertil kræver homogene assays færre eksperimentelle trin, bruger mindre prøvevolumener og er modtagelige for HTS. Der er fem homogene cellebaserede immunassay platforme kommercielt tilgængelige, der kan bruges til kvantitativt at overvåge JAK-afhængig fosforylering af STAT’er i cellelysater: SureFire, HTRF, LANCE, LanthaScreen og Lumit. Hver af disse platforme har sine fordele og ulemper.
SureFire er baseret på selvlysende iltkanaliseringsteknologi, der bruger donor- og acceptorperler belagt til specifikt at fange et par antistoffer, hvoraf den ene er biotinyleret. I nærvær af fosforyleret protein bringer de to antistoffer donor- og acceptorperlerne i umiddelbar nærhed, hvilket muliggør dannelsen af et kemiluminescerende signal6. Selvom den er alsidig og følsom, er denne teknologi dyr, påvirkes af biotin i kulturmediet, er meget følsom over for omgivelsestemperatur og lys og kræver en særlig læser til detektion. HTRF og LANCE er begge baseret på TR-FRET-teknologi, der anvender selvlysende lanthanidionkomplekser med lang levetid (Europium- eller Terbiumchelater eller Europiumkryptat) som donormolekyler og langtrøde fluoroforer som acceptormolekyler7. Når to proteinspecifikke antistoffer mærket med enten donor- eller acceptormolekyler bringes i nærheden, finder FRET sted, hvilket forårsager en stigning i acceptorfluorfluorescens og et fald i donorfluorescens. Disse langlivede fluorescerende signaler kan måles på en tidsopløst og ratiometrisk måde for at reducere assayinterferens og øge datakvaliteten. Andre fordele ved TR-FRET er, at det ikke er lysfølsomt, tillader gentagne aflæsninger og udviser lang signalstabilitet. Mens TR-FRET er bredt implementeret i HTS på grund af dets alsidighed, følsomhed og høje robusthed, er alle kommercielle TR-FRET-baserede analyseplatforme dyre, hvilket forhindrer dets brede vedtagelse i akademiske og små industrielle laboratorier. LanthaScreen-analysen bruger også en TR-FRET-baseret udlæsning, men er afhængig af en konstrueret U2OS-cellelinje, der stabilt udtrykker grønt fluorescerende protein (GFP)-STAT1-fusionsprotein kombineret med et terbiummærket phospho-specifikt STAT1-antistof8. Ud over at være begrænset med hensyn til valg af signalproteiner kræver denne metode køb af dyre transfekterede cellelinjer, hvilket reducerer dets anvendelighed og øger muligheden for eksperimentelle artefakter. Lumit er en generisk bioluminescerende immunassay platform, der udnytter sekundære antistoffer (anti-mus og anti-kanin) kemisk mærket med de små og store NanoBit underenheder af NanoLuc Luciferase9. Bindingen af to primære antistoffer til målproteinet bringer de sekundære antistoffer i nærheden for at danne et aktivt enzym, der genererer et luminescenssignal. Mens luminescens generelt er en følsom og robust aflæsning, begrænser kravet om primære antistoffer, der er rejst i to forskellige arter, valgene til analysedesign. Derudover kan brugen af sekundære antistoffer i komplekse prøvematrixer være tilbøjelig til assayinterferens.
Der er således stadig behov for en pålidelig, hurtig, men alligevel overkommelig cellebaseret analyseplatform til måling af individuelle fosforylerede og samlede STAT-proteiner på en måde, der er kompatibel med HTS. For at imødekomme dette behov blev der udviklet en ny cellebaseret immunassayplatform med høj kapacitet baseret på en forbedret TR-FRET-teknologi (THUNDER) og designet til at muliggøre enkel, følsom, robust og omkostningseffektiv måling af endogent udtrykte intracellulære proteiner (fosforyleret eller total) i cellelysater. Fordelene ved denne teknologi stammer fra kombinationen af et donor / acceptor FRET-par, der udviser enestående spektral kompatibilitet og TR-FRET-signal, strengt validerede antistoffer og optimerede lysisbuffere. Disse assays er formateret som sandwichimmunassays og bruger en ligetil tretrins arbejdsgang (figur 1). Celler behandles først for at modulere proteinphosphorylering og lyseres derefter med den specifikke lysisbuffer, der er tilvejebragt i sættet. Det målphosphorylerede eller totale STAT-protein i cellelysatet detekteres i et enkelt reagenstilsætnings- og inkubationstrin med et par fluoroformærkede antistoffer, der genkender forskellige epitoper på målproteinet (figur 2). Et antistof er mærket med en Europiumchelatdonor (Eu-Ab1), mens det andet antistof er mærket med en langt rød acceptorfluorofor (FR-Ab2). De to mærkede antistoffer binder sig til proteinet i opløsning, hvilket bringer de to etiketter i nærheden. Excitation af donoren Europiumchelat ved 320 eller 340 nm udløser en FRET til acceptoren, som udsender et langlivet TR-FRET-signal ved 665 nm proportionalt med koncentrationen af målprotein (fosforyleret eller total) i cellelysat.
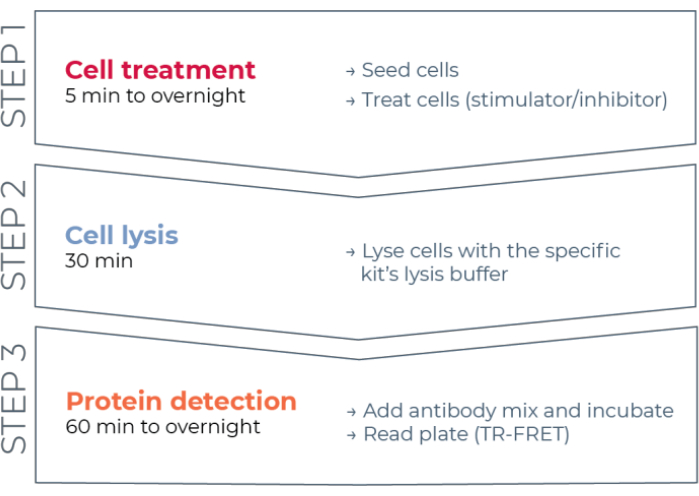
Figur 1: TR-FRET assay arbejdsgang. Arbejdsgangen består af tre trin: cellebehandling, cellelyse og proteindetektion ved hjælp af TR-FRET. I to-plade-assayprotokollen overføres lysater til en hvid 384-brønds detektionsplade, mens i en-pladeprotokollen udføres alle trin i den samme hvide 384-brønds detektionsplade (alt-i-en-brønd-protokol). Uanset hvilken analyseprotokol der anvendes, udføres proteindetektion i samme samlede volumen (20 μL pr. Brønd). Forkortelse: TR-FRET = tidsopløst Förster resonans energioverførsel. Klik her for at se en større version af denne figur.
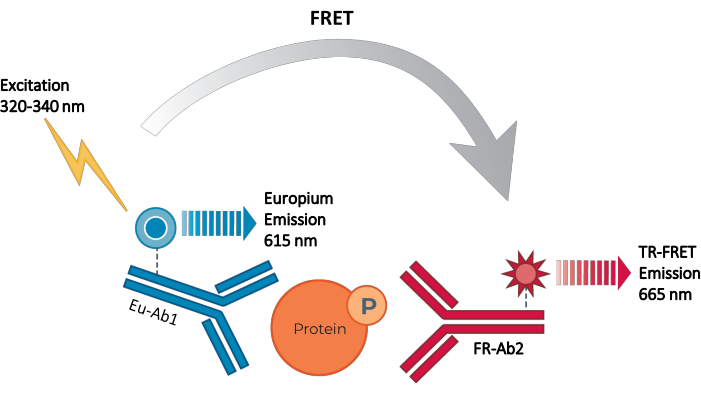
Figur 2: TR-FRET sandwich immunoassay princip. Det ene antistof er mærket med Europiumchelatdonoren (Eu-Ab1) og det andet med den langtrøde lille fluoroforacceptor (FR-Ab2). De to mærkede antistoffer binder specifikt til forskellige epitoper på målproteinet (fosforyleret eller totalt) i cellelysatet, hvilket bringer de to fluoroforer i nærheden. Excitation af donoren Europiumchelat ved 320 eller 340 nm udløser en FRET fra donoren til acceptormolekylerne, som igen udsender et signal ved 665 nm. Dette signal er proportionalt med koncentrationen af protein i cellelysatet. I mangel af det specifikke målprotein er donor- og acceptorfluoroforerne for fjernt fra hinanden til, at FRET kan forekomme. Forkortelser: FRET = Förster resonans energioverførsel; TR-FRET = tidsopløst FRET; Ab = antistof; FR = langt rødt; Eu – Europium chelat; P = fosforylering. Klik her for at se en større version af denne figur.
Her tilvejebringes detaljerede protokoller til måling i et 384-brøndsformat af de intracellulære niveauer af fosforyleret STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694 / Y699) og STAT6 (Y641) sammen med total STAT1, STAT3, STAT5 og STAT6 i cellelysater fra klæbende eller suspensionsceller ved hjælp af THUNDER TR-FRET-platformen. Disse protokoller definerer trin til cellebehandling, lysis og TR-FRET-baseret målproteindetektion ved hjælp af enten en to-pladeoverførselsprotokol eller en en-plade alt-i-en-brønd-protokol. Disse cellebaserede assays anvendes til bestemmelse af den farmakologiske profil af kendte aktivatorer og hæmmere af JAK/STAT-vejen. Robustheden og egnetheden af udvalgte assays for HTS er påvist. Endelig diskuteres nøgleeksperimenter til analyseoptimering sammen med anbefalinger til fejlfinding af assay.
Protocol
Representative Results
Discussion
Sammenlignet med konventionelle metoder til phosphoproteinanalyse såsom western blotting og ELISA-baserede metoder er arbejdsgangen for et THUNDER TR-FRET-cellulært assay enkel og hurtig, bruger en prøve med lavt volumen (15 μL), er designet til HTS i et 384-brøndsformat og er meget modtagelig for automatisering. Analyseprotokollen er fleksibel og kan let tilpasses til både mellem- og højkapacitetsapplikationer. Assays kan køres ved hjælp af enten en to-plade overførselsprotokol eller en en-384-brønds pladepro…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ingen.
Materials
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) + Total STAT4 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4PT-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
Riferimenti
- Villarino, A., Kanno, Y., O’Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O’Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).

