मानव कोशिकाओं में अंतर्जात फॉस्फोराइलेटेड स्टेट प्रोटीन के मापन के लिए समय-हल Förster अनुनाद ऊर्जा स्थानांतरण Assays
Summary
समय हल Förster अनुनाद ऊर्जा हस्तांतरण सेल आधारित परख प्रोटोकॉल सरल, विशिष्ट, संवेदनशील, और अंतर्जात फॉस्फोराइलेटेड सिग्नल ट्रांसड्यूसर और प्रतिलेखन (STAT) के उत्प्रेरक के मजबूत परिमाणीकरण के लिए वर्णित कर रहे हैं 1/3/4/5/6 एक 384 अच्छी तरह से प्रारूप में सेल lysates में प्रोटीन.
Abstract
जेनस किनेज (जेएके)/सिग्नल ट्रांसड्यूसर और ट्रांसक्रिप्शन (एसटीएटी) सिग्नलिंग पाथवे के उत्प्रेरक साइटोकिन्स और विकास कारकों के लिए सेलुलर प्रतिक्रियाओं की मध्यस्थता करने में एक महत्वपूर्ण भूमिका निभाता है। स्टेट प्रोटीन मुख्य रूप से जेएके द्वारा मध्यस्थता टायरोसिन फॉस्फोराइलेशन द्वारा सक्रिय होते हैं। स्टेट सिग्नलिंग मार्गों की असामान्य सक्रियता कई मानव रोगों, विशेष रूप से कैंसर और प्रतिरक्षा से संबंधित स्थितियों में फंस गई है। इसलिए, देशी सेल सिग्नलिंग वातावरण के भीतर स्टेट प्रोटीन फॉस्फोराइलेशन की निगरानी करने की क्षमता अकादमिक और दवा खोज अनुसंधान दोनों के लिए महत्वपूर्ण है। पारंपरिक परख फॉस्फोराइलेटेड STAT प्रोटीन की मात्रा निर्धारित करने के लिए उपलब्ध प्रारूपों पश्चिमी blotting और एंजाइम से जुड़े immunosorbent परख (एलिसा) शामिल हैं. ये विषम तरीके श्रम-गहन, कम-थ्रूपुट हैं, और अक्सर पश्चिमी ब्लोटिंग के मामले में विश्वसनीय (विशिष्ट) नहीं होते हैं। सजातीय (नो-वॉश) विधियां उपलब्ध हैं लेकिन महंगी रहती हैं।
यहां, विस्तृत प्रोटोकॉल संवेदनशील, मजबूत, और लागत प्रभावी माप के लिए फॉस्फोराइलेटेड STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694 / Y699), और STAT6 (Y641) के अंतर्जात स्तरों के अंतर्जात स्तरों के 384-अच्छी तरह से प्रारूप में प्रदान किए जाते हैं, जो उपन्यास थंडर टाइम-हल किए गए Förster अनुनाद ऊर्जा हस्तांतरण (TR-FRET) प्लेटफ़ॉर्म का उपयोग करके अनुयायी या निलंबन कोशिकाओं से सेल लिसेट में हैं। सेलुलर परख के लिए वर्कफ़्लो सरल, तेजी से है, और उच्च थ्रूपुट स्क्रीनिंग (एचटीएस) के लिए डिज़ाइन किया गया है। परख प्रोटोकॉल लचीला है, एक कम मात्रा के नमूने (15 μL) का उपयोग करता है, केवल एक अभिकर्मक इसके अलावा कदम की आवश्यकता है, और कम थ्रूपुट और उच्च थ्रूपुट अनुप्रयोगों के लिए अनुकूलित किया जा सकता है। प्रत्येक फॉस्फो-स्टेट सैंडविच इम्यूनोएसे को ज्ञात एगोनिस्ट और अवरोधकों के साथ अनुकूलित परिस्थितियों में मान्य किया जाता है और अपेक्षित फार्माकोलॉजी और जेड-फैक्टर मूल्यों को उत्पन्न करता है। चूंकि टीआर-फ्रेट एसेस रेशियोमेट्रिक हैं और उन्हें धोने के चरणों की आवश्यकता नहीं होती है, इसलिए वे पारंपरिक दृष्टिकोणों की तुलना में बहुत बेहतर पुनरुत्पादकता प्रदान करते हैं। साथ में, assays का यह सूट सेल उपचार के बाद विशिष्ट फॉस्फोराइलेटेड स्टेट प्रोटीन के अधिक व्यापक विश्लेषण के लिए नए लागत प्रभावी उपकरण प्रदान करता है और JAK / STAT सिग्नलिंग मार्ग के विशिष्ट और चयनात्मक मॉड्यूलेटरों की स्क्रीनिंग और लक्षण वर्णन करता है।
Introduction
JAK / STAT सिग्नलिंग मार्ग विविध साइटोकिन्स, इंटरफेरॉन, विकास कारकों और संबंधित अणुओं के लिए सेलुलर प्रतिक्रियाओं की मध्यस्थता में एक महत्वपूर्ण भूमिका निभाता है1,2। विशिष्ट सेल-सतह रिसेप्टर्स के लिए इन लिगेंडों के बंधन के परिणामस्वरूप जेएके की सक्रियता होती है, जो बदले में विशिष्ट टायरोसिन अवशेषों के फॉस्फोराइलेशन द्वारा स्टेट प्रोटीन को सक्रिय करती है। STAT फॉस्फोराइलेशन के परिणामस्वरूप नाभिक में उनके dimerization और स्थानांतरण होता है, जहां वे विनियमित लक्ष्य जीन के प्रतिलेखन पर अपना प्रभाव डालते हैं। STAT परिवार में सात सदस्य होते हैं: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b, और STAT6। सदस्य शारीरिक सेल प्रक्रियाओं के विनियमन में एक जटिल और आवश्यक भूमिका निभाते हैं, जिसमें प्रसार, भेदभाव, एपोप्टोसिस, एंजियोजेनेसिस और प्रतिरक्षा प्रणाली विनियमन शामिल हैं। STAT सिग्नलिंग मार्गों की असामान्य सक्रियण कई मानव बीमारियों, विशेष रूप से कैंसर और प्रतिरक्षा से संबंधित स्थितियों में फंस गई है3,4। इसलिए, देशी सेल सिग्नलिंग वातावरण के भीतर स्टेट प्रोटीन फॉस्फोराइलेशन का आकलन करने की क्षमता अकादमिक और दवा खोज अनुसंधान दोनों के लिए महत्वपूर्ण है।
आज तक, इंट्रासेल्युलर फॉस्फोराइलेटेड प्रोटीन के स्तर को मापने के लिए उपयोग किए जाने वाले पारंपरिक तरीके, एसटीएटी सहित, एंटीबॉडी-आधारित हैं और इसमें पश्चिमी ब्लोटिंग, एलिसा और फॉस्फोफ्लो साइटोमेट्री शामिल हैं। ये विषम तरीके श्रम-गहन, समय लेने वाली, त्रुटि-प्रवण, कम-थ्रूपुट, और अक्सर अविश्वसनीय (जैसे, विशिष्टता के मुद्दे) पश्चिमी ब्लोटिंग 5 के मामले में हैं। इसके विपरीत, सजातीय assays कम प्रयोगात्मक चरणों की आवश्यकता है, छोटे नमूना मात्रा का उपयोग करें, और HTS के लिए amenable हैं। व्यावसायिक रूप से पांच सजातीय सेल-आधारित इम्यूनोएसे प्लेटफ़ॉर्म उपलब्ध हैं जिनका उपयोग सेल लिसेट में एसटीएटी के जेएके-निर्भर फॉस्फोराइलेशन की मात्रात्मक रूप से निगरानी करने के लिए किया जा सकता है: SureFire, HTRF, LANCE, LanthaScreen, और Lumit। इन प्लेटफार्मों में से प्रत्येक के अपने फायदे और नुकसान हैं।
SureFire luminescent ऑक्सीजन चैनलिंग तकनीक पर आधारित है, जो विशेष रूप से एंटीबॉडी की एक जोड़ी पर कब्जा करने के लिए लेपित दाता और स्वीकर्ता मोतियों का उपयोग करता है, जिनमें से एक बायोटिनिलेटेड है। फॉस्फोराइलेटेड प्रोटीन की उपस्थिति में, दो एंटीबॉडी दाता और स्वीकर्ता मोतियों को निकटता में लाते हैं, जिससे एक केमिल्यूमिनेसेंट सिग्नल 6 की पीढ़ी को सक्षम किया जा सकता है। जबकि बहुमुखी और संवेदनशील है, यह तकनीक महंगी है, संस्कृति माध्यम में बायोटिन से प्रभावित है, परिवेश के तापमान और प्रकाश के प्रति बहुत संवेदनशील है, और पता लगाने के लिए एक विशेष पाठक की आवश्यकता होती है। HTRF और LANCE दोनों TR-FRET तकनीक पर आधारित हैं जो लंबे जीवनकाल के ल्यूमिनेसेंट लैंथेनाइड आयन परिसरों (यूरोपियम या टेरबियम चेलेट्स, या यूरोपियम क्रिप्टेट) का उपयोग दाता अणुओं के रूप में करते हैं और स्वीकर्ता अणुओं के रूप में दूर-लाल फ्लोरोफोरस 7। जब दाता या स्वीकर्ता अणुओं के साथ लेबल किए गए दो प्रोटीन-विशिष्ट एंटीबॉडी को निकटता में लाया जाता है, तो FRET होता है, जिससे स्वीकर्ता प्रतिदीप्ति में वृद्धि होती है और दाता प्रतिदीप्ति में कमी आती है। इन लंबे समय तक रहने वाले फ्लोरोसेंट संकेतों को परख हस्तक्षेप को कम करने और डेटा की गुणवत्ता बढ़ाने के लिए एक समय-हल और रेशियोमेट्रिक तरीके से मापा जा सकता है। टीआर-फ्रेट के अन्य फायदे यह हैं कि यह प्रकाश-संवेदनशील नहीं है, बार-बार रीडिंग की अनुमति देता है, और लंबे समय तक सिग्नल स्थिरता प्रदर्शित करता है। जबकि टीआर-फ्रेट को एचटीएस में व्यापक रूप से अपनी बहुमुखी प्रतिभा, संवेदनशीलता और उच्च मजबूती के कारण लागू किया जाता है, सभी वाणिज्यिक टीआर-फ्रेट-आधारित परख प्लेटफ़ॉर्म महंगे होते हैं, जिससे अकादमिक और छोटे औद्योगिक प्रयोगशालाओं में व्यापक गोद लेने से पहले होता है। LanthaScreen परख भी एक TR-FRET आधारित रीडआउट का उपयोग करता है, लेकिन एक इंजीनियर U2OS सेल लाइन है कि stably हरे फ्लोरोसेंट प्रोटीन (GFP) -STAT1 संलयन प्रोटीन एक terbium लेबल फॉस्फो-विशिष्ट STAT1 एंटीबॉडी 8 के साथ संयुक्त व्यक्त पर निर्भर है. सिग्नलिंग प्रोटीन की पसंद के मामले में सीमित होने के अलावा, इस विधि को महंगी ट्रांसफेक्टेड सेल लाइनों को खरीदने, इसकी प्रयोज्यता को कम करने और प्रयोगात्मक कलाकृतियों की संभावना को बढ़ाने की आवश्यकता होती है। Lumit एक सामान्य bioluminescent immunoassay मंच है कि द्वितीयक एंटीबॉडी (विरोधी माउस और विरोधी खरगोश) रासायनिक रूप से NanoLuc Luciferase9 के छोटे और बड़े NanoBit subunits के साथ लेबल का उपयोग करता है. लक्ष्य प्रोटीन के लिए दो प्राथमिक एंटीबॉडी का बंधन द्वितीयक एंटीबॉडी को एक सक्रिय एंजाइम बनाने के लिए निकटता में लाता है जो एक ल्यूमिनेसेंस सिग्नल उत्पन्न करता है। जबकि luminescence आम तौर पर एक संवेदनशील और मजबूत readout है, प्राथमिक एंटीबॉडी के लिए दो अलग अलग प्रजातियों में उठाया की आवश्यकता परख डिजाइन के लिए विकल्पों को सीमित. इसके अलावा, जटिल नमूना मैट्रिक्स में माध्यमिक एंटीबॉडी का उपयोग परख हस्तक्षेप के लिए प्रवण हो सकता है।
इस प्रकार, एचटीएस के साथ संगत तरीके से व्यक्तिगत फॉस्फोराइलेटेड और कुल स्टेट प्रोटीन को मापने के लिए एक विश्वसनीय, तेजी से, अभी तक सस्ती सेल-आधारित परख मंच के लिए अभी भी एक आवश्यकता मौजूद है। इस आवश्यकता को पूरा करने के लिए, एक नया उच्च-थ्रूपुट सेल-आधारित इम्यूनोएसे प्लेटफ़ॉर्म एक एन्हांस्ड टीआर-फ्रेट तकनीक (थंडर) के आधार पर विकसित किया गया था और सेल लिसेट में अंतर्जात रूप से व्यक्त इंट्रासेल्युलर प्रोटीन (फॉस्फोराइलेटेड या कुल) के सरल, संवेदनशील, मजबूत और लागत प्रभावी माप को सक्षम करने के लिए डिज़ाइन किया गया था। इस तकनीक के फायदे एक दाता / स्वीकर्ता FRET जोड़ी के संयोजन से स्टेम असाधारण वर्णक्रमीय संगतता और टीआर-FRET संकेत, कड़ाई से मान्य एंटीबॉडी, और अनुकूलित लाइसिस बफर का प्रदर्शन करते हैं। इन assays सैंडविच immunoassays के रूप में स्वरूपित कर रहे हैं और एक सीधा, तीन कदम वर्कफ़्लो (चित्रा 1) का उपयोग करें. कोशिकाओं को पहले प्रोटीन फॉस्फोराइलेशन को संशोधित करने के लिए इलाज किया जाता है और फिर किट में प्रदान किए गए विशिष्ट लाइसिस बफर के साथ झूठ बोला जाता है। सेल लिसेट में लक्ष्य फॉस्फोराइलेटेड या कुल एसटीएटी प्रोटीन को एक एकल अभिकर्मक के अलावा और फ्लोरोफोर-लेबल एंटीबॉडी की एक जोड़ी के साथ इनक्यूबेशन चरण में पाया जाता है जो लक्ष्य प्रोटीन पर अलग-अलग एपिटोप को पहचानते हैं (चित्रा 2)। एक एंटीबॉडी को यूरोपियम चेलेट दाता (Eu-Ab1) के साथ लेबल किया गया है, जबकि दूसरे एंटीबॉडी को दूर-लाल स्वीकर्ता फ्लोरोफोर (FR-Ab2) के साथ लेबल किया गया है। दो लेबल एंटीबॉडी समाधान में प्रोटीन से बंधते हैं, जिससे दो लेबल निकटता में आते हैं। 320 या 340 एनएम पर दाता यूरोपियम चेलेट की उत्तेजना स्वीकर्ता को एक फ्रेट ट्रिगर करती है, जो सेल लिसेट में लक्ष्य प्रोटीन (फॉस्फोराइलेटेड या कुल) की एकाग्रता के लिए आनुपातिक 665 एनएम पर एक लंबे समय तक रहने वाले टीआर-फ्रेट सिग्नल का उत्सर्जन करती है।
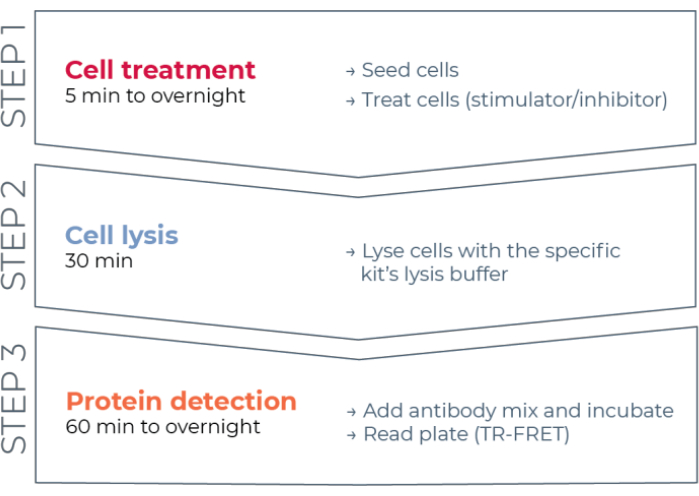
चित्रा 1: TR-FRET परख वर्कफ़्लो. वर्कफ़्लो में तीन चरण होते हैं: सेल उपचार, सेल लाइसिस, और TR-FRET का उपयोग करके प्रोटीन का पता लगाना। दो-प्लेट परख प्रोटोकॉल में, लिसेट को एक सफेद 384-अच्छी तरह से पता लगाने वाली प्लेट में स्थानांतरित कर दिया जाता है, जबकि एक-प्लेट प्रोटोकॉल में, सभी चरणों को एक ही सफेद 384-अच्छी तरह से पता लगाने वाली प्लेट (ऑल-इन-वन-वेल प्रोटोकॉल) में आयोजित किया जाता है। परख प्रोटोकॉल का उपयोग किया के बावजूद, प्रोटीन का पता लगाने एक ही कुल मात्रा (20 μL प्रति अच्छी तरह से) में किया जाता है. संक्षिप्त नाम: TR-FRET = समय-हल Förster अनुनाद ऊर्जा हस्तांतरण. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
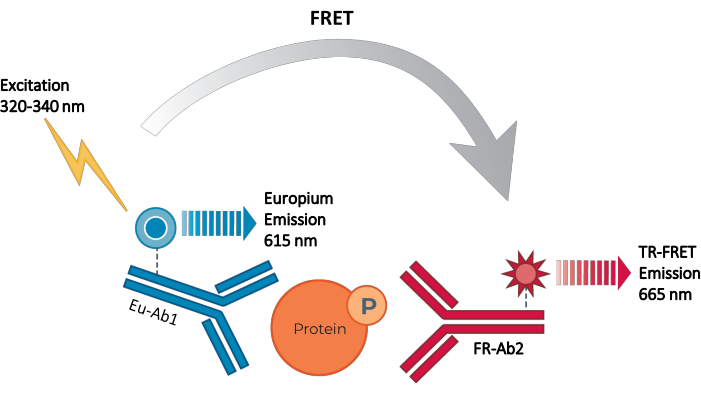
चित्रा 2: TR-FRET सैंडविच immunoassay सिद्धांत. एक एंटीबॉडी को यूरोपियम चेलेट दाता (Eu-Ab1) के साथ लेबल किया गया है और दूसरा दूर-लाल छोटे फ्लोरोफोर स्वीकर्ता (FR-Ab2) के साथ है। दो लेबल एंटीबॉडी विशेष रूप से सेल लिसेट में लक्ष्य प्रोटीन (फॉस्फोराइलेटेड या कुल) पर अलग-अलग एपिटोप से बंधते हैं, जिससे दो फ्लोरोफोरेस निकटता में आते हैं। 320 या 340 एनएम पर दाता यूरोपियम चेलेट की उत्तेजना दाता से स्वीकर्ता अणुओं तक एक फ्रेट को ट्रिगर करती है, जो बदले में 665 एनएम पर एक संकेत का उत्सर्जन करती है। यह संकेत सेल लिसेट में प्रोटीन की एकाग्रता के लिए आनुपातिक है। विशिष्ट लक्ष्य प्रोटीन की अनुपस्थिति में, दाता और स्वीकर्ता फ्लोरोफोरेस FRET होने के लिए एक दूसरे से बहुत दूर हैं। संक्षेप: FRET = Förster अनुनाद ऊर्जा हस्तांतरण; TR-FRET = समय हल FRET; Ab = एंटीबॉडी; FR = दूर-लाल; यूरोपीय संघ – यूरोपियम चेलेट; पी = फॉस्फोराइलेशन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
यहां, विस्तृत प्रोटोकॉल को मापने के लिए प्रदान किया जाता है, एक 384-अच्छी तरह से प्रारूप में, फॉस्फोराइलेटेड STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/ Y699), और STAT6 (Y641), कुल STAT1, STAT3, STAT5, और STAT6 के इंट्रासेल्युलर स्तरों को, थंडर TR-FRET प्लेटफ़ॉर्म का उपयोग करके अनुयायी या निलंबन कोशिकाओं से सेल लिसेट में। ये प्रोटोकॉल सेल उपचार, लाइसिस, और टीआर-फ्रेट-आधारित लक्ष्य प्रोटीन का पता लगाने के लिए चरणों को परिभाषित करते हैं या तो दो-प्लेट ट्रांसफर प्रोटोकॉल या एक-प्लेट ऑल-इन-वन-वेल प्रोटोकॉल का उपयोग करते हैं। इन सेल-आधारित assays ज्ञात activators और JAK / STAT मार्ग के अवरोधकों के औषधीय प्रोफ़ाइल का निर्धारण करने के लिए लागू कर रहे हैं। एचटीएस के लिए चयनित assays की मजबूती और उपयुक्तता का प्रदर्शन किया जाता है। अंत में, परख अनुकूलन के लिए प्रमुख प्रयोगों परख समस्या निवारण के लिए सिफारिशों के साथ, चर्चा कर रहे हैं.
Protocol
Representative Results
Discussion
इस तरह के पश्चिमी blotting और एलिसा आधारित तरीकों के रूप में phosphoprotein विश्लेषण के लिए पारंपरिक तरीकों की तुलना में, एक थंडर TR-FRET सेलुलर परख के लिए वर्कफ़्लो सरल और तेज है, एक कम मात्रा के नमूने (15 μL) का उपयोग करता है, ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
कोई नहीं।
Materials
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) + Total STAT4 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4PT-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
Riferimenti
- Villarino, A., Kanno, Y., O’Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O’Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).

