인간 세포에서 내인성 인산화 STAT 단백질의 측정을 위한 시간 분해된 Förster 공명 에너지 전달 분석
Summary
시간-분해된 Förster 공명 에너지 전달 세포 기반 분석 프로토콜은 384-웰 포맷의 세포 용해물에서 내인성 인산화 신호 변환기 및 전사 활성화제(STAT) 1/3/4/5/6 단백질의 단순하고, 특이적이며, 민감하고, 강력한 정량화를 위해 기술된다.
Abstract
야누스 키나제 (JAK) / 신호 변환기 및 전사 활성화제 (STAT) 신호 전달 경로는 사이토 카인 및 성장 인자에 대한 세포 반응을 매개하는 데 중요한 역할을합니다. STAT 단백질은 주로 JAKs에 의해 매개되는 티로신 인산화에 의해 활성화된다. STAT 신호전달 경로의 비정상적인 활성화는 많은 인간 질환, 특히 암 및 면역 관련 병태에 연루되어 있다. 따라서, 천연 세포 신호전달 환경 내에서 STAT 단백질 인산화를 모니터링하는 능력은 학술 및 약물 발견 연구 모두에 중요하다. 인산화된 STAT 단백질을 정량화하는 데 사용할 수 있는 전통적인 분석 형식에는 웨스턴 블롯팅 및 효소 결합 면역흡착 분석법(ELISA)이 포함됩니다. 이러한 이질적인 방법은 노동 집약적이고 처리량이 낮으며 웨스턴 블롯팅의 경우 종종 신뢰할 수 없습니다 (특이적). 균질 (세척 없음) 방법을 사용할 수 있지만 비싸지 만 여전히 비쌉니다.
여기서, 상세한 프로토콜은 신규한 천둥 시간 분해된 뫼르스터 공명 에너지 전달(TR-FRET) 플랫폼을 사용하여 부착성 또는 현탁 세포로부터의 세포 용해물에서 인산화된 STAT1(Y701), STAT3(Y705), STAT4(Y693), STAT5(Y694/Y699), 및 STAT6(Y641)의 내인성 수준의 384-웰 포맷으로 민감하고, 견고하며, 비용 효율적인 측정을 위해 제공된다. 세포 분석의 워크플로우는 간단하고 빠르며 고처리량 스크리닝(HTS)을 위해 설계되었습니다. 분석 프로토콜은 유연하고, 저용량 샘플(15μL)을 사용하며, 단 하나의 시약 첨가 단계만 필요로 하며, 저처리량 및 고처리량 응용 분야에 적합할 수 있습니다. 각각의 포스포-STAT 샌드위치 면역검정은 공지된 작용제 및 억제제와 함께 최적화된 조건 하에서 검증되고 예상되는 약리학 및 Z’-인자 값을 생성한다. TR-FRET 분석은 비율계량이며 세척 단계가 필요하지 않으므로 기존 접근 방식보다 훨씬 더 나은 재현성을 제공합니다. 함께, 이 분석 제품군은 세포 처리 후 특정 인산화된 STAT 단백질의 보다 포괄적인 분석과 JAK/STAT 신호전달 경로의 특이적이고 선택적인 조절제의 스크리닝 및 특성화를 위한 새로운 비용 효율적인 도구를 제공합니다.
Introduction
JAK/STAT 신호전달 경로는 다양한 사이토카인, 인터페론, 성장 인자 및 관련 분자1,2에 대한 세포 반응을 매개하는 데 중요한 역할을 합니다. 특정 세포-표면 수용체에 대한 이들 리간드의 결합은 JAKs의 활성화를 초래하고, 이는 차례로 특정 티로신 잔기의 인산화에 의해 STAT 단백질을 활성화시킨다. STAT 인산화는 그들의 이량체화 및 핵 내로의 전좌를 초래하며, 여기서 이들은 조절된 표적 유전자의 전사에 그들의 효과를 발휘한다. STAT 제품군은 STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b 및 STAT6의 일곱 멤버로 구성됩니다. 구성원은 증식, 분화, 아폽토시스, 혈관 신생 및 면역 체계 조절을 포함한 생리 세포 과정의 조절에 복잡하고 필수적인 역할을합니다. STAT 신호전달 경로의 비정상적 활성화는 많은 인간 질환, 특히 암 및 면역 관련 병태3,4에 연루되어 있다. 따라서, 천연 세포 신호전달 환경 내에서 STAT 단백질 인산화를 평가하는 능력은 학술 및 약물 발견 연구 모두에 중요하다.
현재까지, STATs를 포함하는 세포내 인산화된 단백질 수준을 측정하기 위해 사용된 통상적인 방법은 항체-기반 웨스턴 블롯팅, ELISA, 및 포스포플로우 세포측정법을 포함한다. 이러한 이질적인 방법은 노동 집약적이고, 시간이 많이 걸리고, 오류가 발생하기 쉽고, 처리량이 낮으며, 웨스턴 블롯팅의 경우 종종 신뢰할 수 없는(예를 들어, 특이성 문제) 이다5. 대조적으로, 동종 검정은 더 적은 실험 단계를 필요로 하고, 더 작은 샘플 부피를 사용하며, HTS에 순응할 수 있다. 세포 용해물에서 STAT의 JAK 의존성 인산화를 정량적으로 모니터링하는 데 사용할 수 있는 상업적으로 이용 가능한 다섯 개의 동종 세포 기반 면역분석 플랫폼이 있습니다: SureFire, HTRF, LANCE, LanthaScreen 및 Lumit. 이러한 각 플랫폼에는 장점과 단점이 있습니다.
SureFire는 발광 산소 채널링 기술을 기반으로하며, 공여체 및 수용체 비드를 사용하여 한 쌍의 항체를 특이적으로 포착하며, 그 중 하나는 비오티닐화됩니다. 인산화된 단백질의 존재 하에서, 두 항체는 공여체 및 수용체 비드를 가까운 근접성으로 가져와 화학발광 신호의 생성을 가능하게 한다6. 다재다능하고 민감하지만, 이 기술은 비용이 많이 들고, 배양 배지의 비오틴에 의해 영향을 받으며, 주변 온도와 빛에 매우 민감하며, 검출을 위해 특별한 판독기가 필요합니다. HTRF 및 LANX는 모두 장기 수명 발광 란타나이드 이온 착물 (유로퓸 또는 테르븀 킬레이트, 또는 유로퓸 크립테이트)을 공여체 분자로 사용하고 수용체 분자로서 원간 적색 형광단을 사용하는 TR-FRET 기술을 기반으로합니다7. 공여체 또는 수용체 분자로 표지된 두 단백질 특이적 항체가 근접하게 되면 FRET가 발생하여 수용체 형광이 증가하고 공여체 형광이 감소합니다. 이러한 수명이 긴 형광 신호는 시간 분해능 및 비율계량 방식으로 측정하여 분석 간섭을 줄이고 데이터 품질을 높일 수 있습니다. TR-FRET의 다른 장점은 빛에 민감하지 않고 반복적 인 판독을 허용하며 긴 신호 안정성을 나타낸다는 것입니다. TR-FRET는 다목적성, 감도 및 높은 견고성으로 인해 HTS에서 널리 구현되지만 모든 상용 TR-FRET 기반 분석 플랫폼은 비용이 많이 들기 때문에 학술 및 소규모 산업 실험실에서의 광범위한 채택을 배제합니다. LanthaScreen 분석은 또한 TR-FRET 기반-판독을 사용하지만, 테르븀 표지된 포스포-특이적 STAT1 항체8과 결합된 녹색 형광 단백질(GFP)-STAT1 융합 단백질을 안정적으로 발현하는 조작된 U2OS 세포주에 의존한다. 신호전달 단백질의 선택의 측면에서 제한될 뿐만 아니라, 이 방법은 고가의 형질감염된 세포주를 구입하여 그 적용가능성을 감소시키고 실험 아티팩트의 가능성을 증가시켜야 한다. 루미트는 NanoLuc Luciferase9의 작고 큰 NanoBit 서브유닛으로 화학적으로 표지된 이차 항체(항마우스 및 항토끼)를 이용하는 일반적인 생체발광 면역분석 플랫폼이다. 표적 단백질에 대한 두 개의 일차 항체의 결합은 이차 항체를 근접하게 가져와 발광 신호를 생성하는 활성 효소를 형성한다. 발광은 일반적으로 민감하고 강력한 판독이지만, 두 가지 다른 종에서 제기 된 일차 항체에 대한 요구 사항은 분석 설계에 대한 선택을 제한합니다. 또한, 복잡한 샘플 매트릭스에서 이차 항체의 사용은 분석 간섭을 일으키는 경향이 있을 수 있다.
따라서, HTS와 상용성인 방식으로 개별 인산화 및 총 STAT 단백질을 측정하기 위한 안정적이고 신속하면서도 저렴한 세포 기반 분석 플랫폼에 대한 필요성이 여전히 존재한다. 이러한 요구를 해결하기 위해 새로운 고처리량 세포 기반 면역 분석 플랫폼은 향상된 TR-FRET 기술 (THUNDER)을 기반으로 개발되었으며 세포 용해물에서 내인성으로 발현 된 세포 내 단백질 (인산화 또는 전체)의 간단하고 민감하며 견고하며 비용 효율적인 측정을 가능하게하도록 설계되었습니다. 이 기술의 장점은 탁월한 스펙트럼 호환성과 TR-FRET 신호, 엄격하게 검증된 항체 및 최적화된 용해 버퍼를 나타내는 공여체/수용체 FRET 쌍의 조합에서 비롯됩니다. 이러한 분석은 샌드위치 면역 분석법으로 포맷되며 간단한 세 단계 워크플로우를 사용합니다(그림 1). 세포는 먼저 단백질 인산화를 조절하기 위해 처리되고, 이어서 키트에 제공된 특이적 용해 완충액으로 용해된다. 세포 용해물 내의 표적 인산화 또는 총 STAT 단백질은 단일 시약 첨가 및 인큐베이션 단계에서 표적 단백질 상의 별개의 에피토프를 인식하는 형광단 표지된 항체 쌍과 함께 검출된다(도 2). 하나의 항체는 유로퓸 킬레이트 공여체 (Eu-Ab1)로 표지되고, 두 번째 항체는 원거리 적색 수용체 형광단 (FR-Ab2)으로 표지된다. 표지 된 두 항체는 용액 중 단백질에 결합하여 두 라벨을 가까운 거리로 가져옵니다. 320 또는 340 nm에서 공여체 유로퓸 킬레이트의 여기는 수용체에 FRET를 트리거하고, 이는 세포 용해물 내의 표적 단백질 (인산화 또는 전체)의 농도에 비례하여 665 nm에서 수명이 긴 TR-FRET 신호를 방출한다.
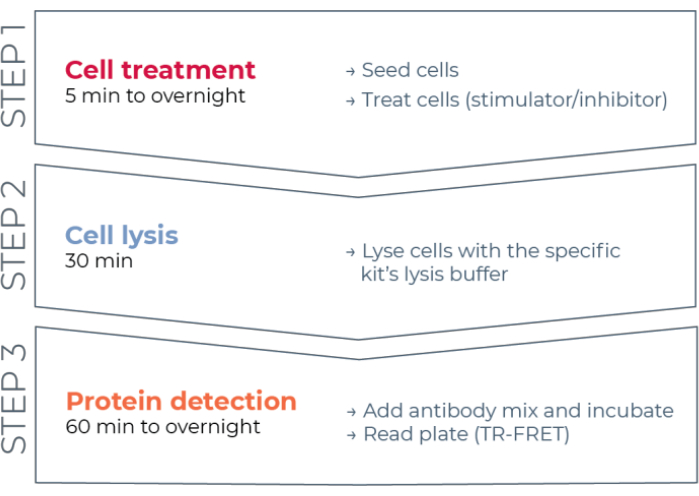
그림 1: TR-FRET 분석 워크플로우. 워크플로우는 세포 치료, 세포 용해 및 TR-FRET를 사용한 단백질 검출의 세 단계로 구성됩니다. 두 플레이트 분석 프로토콜에서, 용해물은 백색 384-웰 검출 플레이트로 이송되는 반면, 원플레이트 프로토콜에서, 모든 단계는 동일한 백색 384-웰 검출 플레이트(올인원-웰 프로토콜)에서 수행된다. 사용된 분석 프로토콜에 관계없이, 단백질 검출은 동일한 총 부피 (웰 당 20 μL)에서 수행된다. 약어: TR-FRET = 시간 분해된 Förster 공명 에너지 전달. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
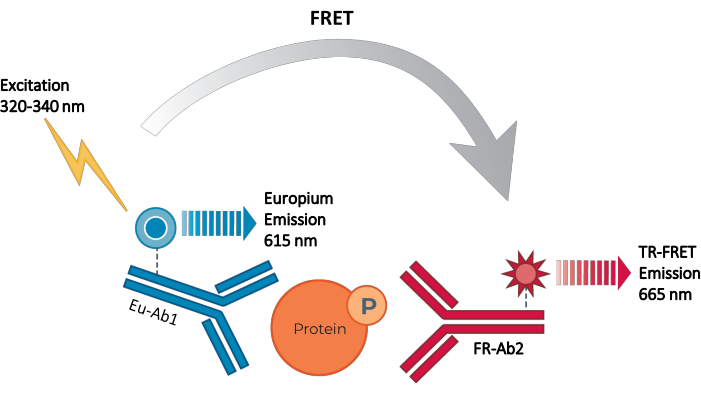
도 2: TR-FRET 샌드위치 면역분석 원리. 하나의 항체는 유로퓸 킬레이트 공여체 (Eu-Ab1)로 표지되고 두 번째 항체는 원적색 작은 형광단 수용체 (FR-Ab2)로 표지된다. 두 개의 표지된 항체는 세포 용해물에서 표적 단백질 (인산화 또는 전체) 상의 별개의 에피토프에 특이적으로 결합하여, 두 형광단을 근접하게 만든다. 320 또는 340 nm에서 공여체 유로퓸 킬레이트의 여기는 공여체로부터 수용체 분자로의 FRET를 촉발시키고, 이는 차례로 665 nm에서 신호를 방출한다. 이 신호는 세포 용해물 내의 단백질의 농도에 비례한다. 특정 표적 단백질의 부재 하에서, 공여체 및 수용체 형광단은 FRET가 발생하기에 너무 멀리 떨어져 있다. 약어: FRET = Förster 공명 에너지 전달; TR-FRET = 시간 분해능 FRET; Ab = 항체; FR = 원-적색; Eu – 유로퓸 킬레이트; P = 인산화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
여기서, 상세한 프로토콜은 384-웰 포맷으로, 인산화된 STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699), 및 STAT6 (Y641)의 세포내 수준을 측정하기 위해, 총 STAT1, STAT3, STAT5 및 STAT6과 함께, 썬더 TR-FRET 플랫폼을 사용하는 부착성 또는 현탁액으로부터의 세포 용해물에서 제공된다. 이들 프로토콜은 세포 치료, 용해 및 TR-FRET-기반 표적 단백질 검출을 위한 단계를 두 플레이트 전달 프로토콜 또는 원플레이트 올인원-웰 프로토콜 중 하나를 사용하여 정의한다. 이러한 세포 기반 분석은 JAK/STAT 경로의 알려진 활성화제 및 억제제의 약리학적 프로파일을 결정하기 위해 적용됩니다. HTS에 대한 선택된 분석의 견고성 및 적합성이 입증된다. 마지막으로, 분석 최적화를 위한 주요 실험과 분석 문제 해결을 위한 권장 사항에 대해 논의합니다.
Protocol
Representative Results
Discussion
웨스턴 블롯팅 및 ELISA 기반 방법과 같은 포스포단백질 분석을 위한 기존의 방법과 비교할 때, THUNDER TR-FRET 세포 분석을 위한 워크플로우는 간단하고 빠르며, 저용량 샘플(15μL)을 사용하며, 384-웰 포맷의 HTS용으로 설계되었으며, 자동화에 매우 적합합니다. 분석 프로토콜은 유연하며 중간 및 고처리량 응용 분야 모두에 쉽게 적응할 수 있습니다. 분석은 두 개의 플레이트 전송 프로토콜 또는 one-384-w…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
없음.
Materials
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) + Total STAT4 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4PT-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
Riferimenti
- Villarino, A., Kanno, Y., O’Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O’Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).

