Kontinuierlicher fluoreszenzbasierter Endonuklease-gekoppelter DNA-Methylierungsassay zum Screening auf DNA-Methyltransferase-Inhibitoren
Summary
DNA-Methyltransferasen sind potenzielle Ziele für Krebsmedikamente. Hier wird ein Protokoll vorgestellt, um kleine Moleküle auf DNA-Methyltransferase-Hemmung zu untersuchen. Dieser Assay verwendet eine Endonuklease, um die DNA-Methylierung an die Fluoreszenzerzeugung zu koppeln und ermöglicht die Überwachung der Enzymaktivität in Echtzeit.
Abstract
DNA-Methylierung, eine Form der epigenetischen Genregulation, ist wichtig für die normale Zellfunktion. In Zellen etablieren und erhalten Proteine, die DNA-Methyltransferasen (DNMTs) genannt werden, das DNA-Methylierungsmuster. Veränderungen des normalen DNA-Methylierungsmusters sind mit der Entwicklung und Progression von Krebs verbunden, was DNMTs zu potenziellen Zielen für Krebsmedikamente macht. Daher ist die Identifizierung und Charakterisierung neuartiger niedermolekularer Inhibitoren dieser Enzyme von großer Bedeutung. Dieses Papier stellt ein Protokoll vor, das verwendet werden kann, um nach DNA-Methyltransferase-Inhibitoren zu suchen. Der Test der kontinuierlichen gekoppelten Kinetik ermöglicht es, die Anfangsgeschwindigkeiten der DNA-Methylierung in Gegenwart und Abwesenheit potenzieller niedermolekularer Inhibitoren zu bestimmen. Der Assay verwendet die methylsensitive Endonuklease Gla I, um die Methylierung eines hemimethylierten DNA-Substrats an die Fluoreszenzerzeugung zu koppeln.
Dieser kontinuierliche Assay ermöglicht die Überwachung der Enzymaktivität in Echtzeit. Die Durchführung des Assays in kleinen Volumina in Mikrotiterplatten reduziert die Kosten für Reagenzien. Mit diesem Assay wurde ein kleines Beispiel-Screening für Inhibitoren von DNMT1, dem am häufigsten vorkommenden DNMT-Isoenzym beim Menschen, durchgeführt. Das hochsubstituierte Anthrachinon-Naturprodukt Milchsäure A ist ein potenter, DNA-kompetitiver Inhibitor von DNMT1. Hier untersuchen wir drei potenzielle niedermolekulare Inhibitoren – Anthrachinone oder Anthrachinon-ähnliche Moleküle mit ein bis drei Substituenten – in zwei Konzentrationen, um das Assay-Protokoll zu beschreiben. Anfangsgeschwindigkeiten werden verwendet, um die prozentuale Aktivität zu berechnen, die in Gegenwart jedes Moleküls beobachtet wird. Eine der drei untersuchten Verbindungen weist eine konzentrationsabhängige Hemmung der DNMT1-Aktivität auf, was darauf hindeutet, dass es sich um einen potenziellen Inhibitor von DNMT1 handelt.
Introduction
DNA-Methylierung ist eine wichtige epigenetische Markierung, die die Genexpression und die Chromatinstruktur reguliert. Die Methylierung erfolgt überwiegend in CpG-Dinukleotiden – Cytosin gefolgt von Guanosin; Die Methylgruppe wird zur 5-Position von Cytosin hinzugefügt. Korrekte DNA-Methylierungsmuster und damit die richtige Genexpression sind für eine angemessene zelluläre Entwicklung und Funktion erforderlich. Viele Krankheitszustände wurden mit Veränderungen des normalen Methylierungsmusters 1,2,3 in Verbindung gebracht. Zum Beispiel gibt es einen Zusammenhang zwischen Krebsentstehung und -progression und Veränderungen des DNA-Methylierungsmusters. Typischerweise weisen Krebszellen insgesamt niedrigere Methylcytosinspiegel auf, was zur Instabilität des Genoms beiträgt. Gleichzeitig konzentriert sich das im Erbgut vorhandene Methylcytosin in den Promotorregionen von Tumorsuppressorgenen, was zu einer Gen-Silencierung dieser wichtigen Proteine führt. Insbesondere epigenetische Veränderungen sind dynamisch und reversibel, im Gegensatz zu den DNA-Mutationen, die mit der Tumorgenese assoziiert sind. Dies hat die Proteine, die an der epigenetischen Genregulation beteiligt sind, zu interessantenWirkstoffzielen 2,4 gemacht.
DNA-Methyltransferasen (DNMTs) sind die Proteine, die für die Erzeugung und Aufrechterhaltung von DNA-Methylierungsmustern verantwortlich sind. Drei katalytisch aktive Isoenzyme, DNMT1, DNMT3a und DNMT3b, existieren beim Menschen. Während der Entwicklung und Differenzierung etablieren die de novo Methyltransferasen DNMT3a und DNMT3b Methylierungsmuster. Beide Enzyme können das katalytisch inaktive DNMT3L-Protein zu Komplexen binden, die eine erhöhte Aktivitätaufweisen 1,5. Nach der Zellteilung enthalten Tochterzellen hemimethylierte DNA – DNA, die Methylcytosin in nur einem Strang des Duplex enthält -, weil die neu synthetisierte DNA frei von Methylierungsmarkierungen ist. Die Hauptfunktion von DNMT1 besteht darin, diese hemimethylierte DNA zu methylieren, wodurch das vollständige Methylierungsmuster 1,5 wiederhergestellt wird.
Zusammenhänge zwischen DNMT-Aktivität und Krebs sind gut etabliert. Die Überexpression von DNMT1, entweder durch transkriptionelle oder posttranslationale Mechanismen, ist eine Folge mehrerer gemeinsamer onkogener Signalwege 6,7,8,9. Genetische Ansätze zur Senkung der DNMT1-Aktivität unter Verwendung hypomorpher Allele führen zu einer verminderten Tumorbildung bei Apc(Min)Mäusen10. Antisense-Oligonukleotide, die DNMT1 niederschlagen, hemmen Neoplasien in Zellkultur- undMaustumormodellen 11,12. Daher scheint die Hemmung der DNMT1-Aktivität ein vielversprechender Krebstherapieansatz zu sein. Die Rollen, die die DNMT3-Isoenzyme spielen, sind jedoch nicht so einfach. DNMT3a-Mutationen finden sich bei akuter myeloischer Leukämie13 und myelodysplastischem Syndrom14. Es wurde gezeigt, dass mindestens eine der identifizierten Mutationen die DNA-Methylierungsaktivität des Enzyms15 verringert. DNMT3b ist jedoch bei Brustkrebs16 und Darmkrebs17 überexprimiert. Da die verschiedenen DNMT-Isoenzyme unterschiedliche Rollen bei der Karzinogenese spielen, wird die Identifizierung isoenzymspezifischer Inhibitoren entscheidend sein. Diese Verbindungen werden nicht nur für die Entwicklung von Therapeutika nützlich sein, sondern isoenzymspezifische Inhibitoren wären auch ein unschätzbares Werkzeug, um die Rolle jedes DNMT-Isoenzyms in der Krebsätiologie zu analysieren.
Mehrere DNMT-Inhibitoren wurden in der Literatur beschrieben. Bekannte DNMT-Inhibitoren können in zwei Klassen unterteilt werden: Nukleosid und Nicht-Nukleosid. Nukleosidinhibitoren sind typischerweise Cytidinanaloga. Diese Verbindungen werden in die DNA eingebaut und fangen DNMTs kovalent ein. 5-Azacytidin und 5-Aza-2′-Desoxycytidin sind für die Behandlung des myelodysplastischen Syndroms und der akuten myeloischen Leukämie zugelassen 4,18. Die hohe Toxizität, geringe Bioverfügbarkeit und chemische Instabilität dieser Verbindungen stellen Probleme dar. Laufende Arbeiten untersuchen die Wirksamkeit der nächsten Generation von Nukleosidinhibitoren; SGI-110, abgeleitet von 5-Aza-2′-Desoxycytidin, ist ein Beispiel19,20. Nukleosid-Inhibitoren sind nicht isoenzymspezifisch und inaktivieren jedes auftretende DNMT-Isoenzym. Daher führt die Behandlung mit einem nukleosiddemethylierenden Mittel zur Erschöpfung aller DNMT-Isoenzyme 4,18. Nicht-Nukleosid-Inhibitoren müssen nicht in die DNA eingebaut werden, um ihre hemmende Wirkung auszuüben. Stattdessen binden diese Moleküle direkt an DNMTs, was die Möglichkeit einer isoenzymspezifischen Hemmung einführt. Bisher wurden mehrere Nicht-Nukleosid-Inhibitoren entdeckt, darunter SGI-1027 21, Hydralazin-22, Procainamid23, RG108 und Derivate 24 sowie die Naturstoffe (−)-Epigallocateching-3-Gallat (EGCG)25 und Milchsäure A 26,27. Die meisten der bisher entdeckten Nicht-Nukleosid-Inhibitoren sind nicht isoenzymselektiv oder zeigen schwache Präferenzen für ein DNMT-Isoenzym. Darüber hinaus muss die Wirksamkeit dieser Moleküle verbessert werden, insbesondere in Zellen 4,18. Daher besteht die Notwendigkeit, potentere, isoenzymselektive DNMT-Inhibitoren zu entdecken oder zu entwickeln.
Eine Hürde bei der Entdeckung neuer niedermolekularer Inhibitoren von DNMTs sind die aufwendigen Assays, die traditionell zur Untersuchung der DNMT-Aktivität verwendetwerden 28. Assays sind in der Regel diskontinuierlich mit mehreren Schritten. Die enzymatische Aktivität von DNMTs wird immer noch routinemäßig mit radioaktivem S-Adenosylmethionin (SAM) 29,30,31,32,33,34 untersucht. Nicht-radioaktive Assays für die DNA-Methylierung wurden ebenfalls entwickelt. Zum Beispiel wurden Assays beschrieben, die methylsensitive Restriktionsendonukleasen und Elektrophorese zur Trennung der Verdauungsprodukte verwenden35,36. Diese Arten von diskontinuierlichen, mehrstufigen Assays sind für die Wirkstoffforschung nicht ohne weiteres zugänglich. Seit Mitte der 2000er Jahre wurden mehrere DNA-Methylierungsassays mit höherem Durchsatz entwickelt28. Ein Szintillations-Proximity-Assay wurde verwendet, um nach DNMT1-Inhibitoren zu suchen37. Ein weiterer Assay unter Verwendung einer methylsensitiven Restriktionsendonuklease wurde verwendet, um nach DNMT3a-Inhibitoren25,38 zu suchen. Während beide Assays einen höheren Durchsatz als herkömmliche DNA-Methylierungsassays ermöglichten, erfordern die Assays mehrere Schritte und erlauben nicht die Beobachtung der Methylierungsaktivität in Echtzeit. In jüngerer Zeit wurde ein kontinuierlicher Kinetik beschrieben, der die Bildung von S-Adenosylhomocystein (SAH), einem Produkt der Methylierungsreaktion, an die spektroskopische Veränderung bei 340 nm koppelt, die mit der NADPH-Oxidation39 assoziiert ist. Dieser Assay verwendet drei Kopplungsenzyme, um ein spektroskopisches Signal zu erzeugen.
Wir entwickelten einen fluoreszenzbasierten Endonuklease-gekoppelten DNA-Methylierungsassay, der ein einzelnes kommerziell verfügbares Kopplungsenzym verwendet und Daten in Echtzeit generieren kann (Abbildung 1). Als Substrat wird ein Haarnadel-Oligonukleotid verwendet, das drei Methylcytosine enthält. Die Substrat-DNA enthält einen Fluorophor am 5′-Ende und einen Quencher am 3′-Ende. Die Methylierung der hemimethylierten CpG-Stelle erzeugt die Spaltstelle für die Endonuklease Gla I – vollständig methyliertes GCGC. Die Gla-I-Spaltung des Produktoligonukleotids setzt den Fluorophor aus dem Quencher frei und erzeugt Fluoreszenz in Echtzeit. Der Assay kann verwendet werden, um die Aktivität jeder Isoform von DNMT zu untersuchen; jedoch wird eine höhere Aktivität mit DNMT1 beobachtet, da dieses Isoenzym bevorzugt hemimethylierte DNA 1,5 methyliert. Eine noch robustere Aktivität wird beobachtet, wenn die autoinhibitorische RFTS-Domäne (Replication Foci Targeting Sequence) aus DNMT1 entfernt wird. Diese Domäne, die sich in der N-terminalen regulatorischen Region befindet, bindet an die katalytische Stelle und verhindert die DNA-Bindung. Die Entfernung der ersten ~600 Aminosäuren führt zu einem verkürzten Enzym, das signifikant aktiver ist als das Enzym in voller Länge (~640-facher Anstieg in kKatze / Km)40. Diese aktivierte Form des Enzyms, die als RFTS-fehlendes DNMT1 (Aminosäuren 621–1616) bezeichnet wird, ermöglicht aufgrund ihrer erhöhten katalytischen Kraft die leichtere Identifizierung von Inhibitoren. Dieses Papier stellt ein Protokoll vor, um RFTS-fehlendes DNMT1 in Assays zu verwenden, um nach potenziellen niedermolekularen Inhibitoren zu suchen. Mit dem Endonuklease-gekoppelten kontinuierlichen Assay wird die Anfangsgeschwindigkeit in Gegenwart und Abwesenheit einiger kleiner Moleküle bestimmt. Jeder potenzielle Inhibitor wird bei zwei Konzentrationen untersucht, um nach konzentrationsabhängiger DNMT1-Hemmung zu suchen. Die prozentuale Aktivität, die in Gegenwart der kleinen Moleküle beobachtet wurde, wurde jeweils berechnet.
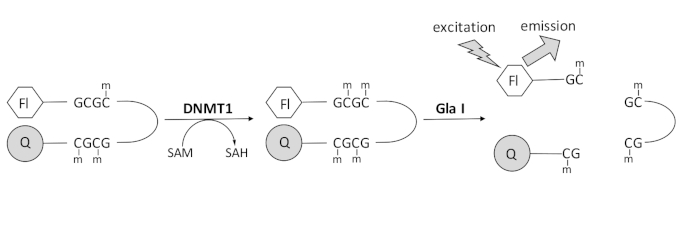
Abbildung 1: DNA-Methylierungstest. Als Substrat wird eine hemimethylierte Haarnadel-DNA mit einem Fluorophor am 5′-Ende und einem Quencher am 3′-Ende verwendet. DNMT1 katalysiert den Transfer der Methylgruppe von S-Adenosylmethionin zur nicht methylierten CpG-Stelle und erzeugt S-Adenosylhomocystein und vollständig methylierte DNA. Das DNA-Produkt enthält die Spaltstelle für die Endonuklease Gla I, die vollständig methylierte GCGC-Stellen spaltet. Die Spaltung der Produkt-DNA setzt den 5′-Fluorophor aus dem 3′-Quencher frei und erzeugt Fluoreszenz. Abkürzungen: Fl = Fluorophor; Q =Quencher; DNMT1 = DNA-Methyltransferase 1; SAM = S-Adenosylmethionin; SAH = S-Adenosylhomocystein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Um Inhibitoren von DNA-Methyltransferasen zu identifizieren und zu charakterisieren, muss die Aktivität des Enzyms gemessen werden. Es gibt mehrere Methoden zur Untersuchung der DNA-Methyltransferase-Aktivität. Die Aktivität wird üblicherweise mit Radioaktivität überwacht; Der Transfer der markierten Methylgruppe von SAM kann quantifiziert werden 29,30,31,32,33,34.<sup class="x…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken der Bucknell University und dem Department of Chemistry für ihre Unterstützung dieser Arbeit.
Materials
| 96-well Half Area Black Flat Bottom Polystyrene Not Treated Microplate | Corning | 3694 | |
| 96-Well Polystyrene Conical Bottom Plates | ThermoFisher | 249570 | |
| Bovine Serum Albumin | NEB | B9000S | |
| compound 1 | ChemBridge | 5812086 | screening compound; resuspended in DMSO to 10 mM |
| compound 2 | ChemBridge | 6722175 | screening compound; resuspended in DMSO to 10 mM |
| compound 3 | ChemBridge | 5249376 | screening compound; resuspended in DMSO to 10 mM |
| Dithiothreitol | Sigma | D0632 | |
| Gla I | SibEnzyme | E494 | methyl-sensitive endonuclease |
| Glycerol | RPI | G22025 | |
| Magnesium Chloride | Sigma | M0250 | |
| Oligonucleotide (5'-FAM-CCTATGCGmCATCAGTTTTCTGATGmCGmCATAGG-3'-Iowa Black Quencher) | IDT | custom synthesized | internally quenched hairpin DNA (substrate) |
| Potassium Glutamate | Sigma | G1501 | |
| S-adenosylmethionine | Sigma | A4377 | methyl-donating co-factor (substrate) |
| Tris Base | RPI | T60040 |
Riferimenti
- Jurkowska, R. Z., Jurkowski, T. P., Jeltsch, A. Structure and function of mammalian DNA methyltransferases. Chembiochem. 12 (2), 206-222 (2011).
- Hamidi, T., Singh, A. K., Chen, T. Genetic alterations of DNA methylation machinery in human diseases. Epigenomics. 7 (2), 247-265 (2015).
- Norvil, A. B., Saha, D., Dar, M. S., Gowher, H. Effect of disease-associated germline mutations on structure function relationship of DNA methyltransferases. Genes. 10 (5), 369 (2019).
- Foulks, J. M., et al. Epigenetic drug discovery: targeting DNA methyltransferases. Journal of Biomolecular Screening. 17 (1), 2-17 (2012).
- Goll, M. G., Bestor, T. H. Eukaryotic cytosine methyltransferases. Annual Review of Biochemistry. 74, 481-514 (2005).
- Bigey, P., Ramchandani, S., Theberge, J., Araujo, F. D., Szyf, M. Transcriptional regulation of the human DNA Methyltransferase (dnmt1) gene. Gene. 242 (1-2), 407-418 (2000).
- Detich, N., Ramchandani, S., Szyf, M. A conserved 3′-untranslated element mediates growth regulation of DNA methyltransferase 1 and inhibits its transforming activity. Journal of Biological Chemistry. 276 (27), 24881-24890 (2001).
- MacLeod, A. R., Rouleau, J., Szyf, M. Regulation of DNA methylation by the Ras signaling pathway. Journal of Biological Chemistry. 270 (19), 11327-11337 (1995).
- Slack, A., Cervoni, N., Pinard, M., Szyf, M. DNA methyltransferase is a downstream effector of cellular transformation triggered by simian virus 40 large T antigen. Journal of Biological Chemistry. 274 (15), 10105-10112 (1999).
- Eads, C. A., Nickel, A. E., Laird, P. W. Complete genetic suppression of polyp formation and reduction of CpG-island hypermethylation in Apc(Min/+) Dnmt1-hypomorphic mice. Ricerca sul cancro. 62, 1296-1299 (2002).
- MacLeod, A. R., Szyf, M. Expression of antisense to DNA methyltransferase mRNA induces DNA demethylation and inhibits tumorigenesis. Journal of Biological Chemistry. 270 (14), 8037-8043 (1995).
- Ramchandani, S., MacLeod, A. R., Pinard, M., von Hofe, E., Szyf, M. Inhibition of tumorigenesis by a cytosine-DNA, methyltransferase, antisense oligodeoxynucleotide. Proceedings of the National Academy Sciences of the United States of America. 94 (2), 684-689 (1997).
- Ley, T. J., et al. DNMT3A mutations in acute myeloid leukemia. New England Journal of Medicine. 363, 2424-2433 (2010).
- Walter, M. J., et al. Recurrent DNMT3A mutations in patients with myelodysplastic syndromes. Leukemia. 25 (7), 1153-1158 (2011).
- Russler-Germain, D. A., et al. The R882H DNMT3A mutation associated with AML dominantly inhibits wild-type DNMT3A by blocking its ability to form active tetramers. Cancer Cell. 25 (4), 442-454 (2014).
- Roll, J. D., Rivenbark, A. G., Jones, W. D., Coleman, W. B. DNMT3b overexpression contributes to a hypermethylator phenotype in human breast cancer cell lines. Molecular Cancer. 7, 15 (2008).
- Nosho, K., et al. DNMT3B expression might contribute to CpG island methylator phenotype in colorectal cancer. Clinical Cancer Research. 15 (11), 3663-3671 (2009).
- Erdmann, A., Halby, L., Fahy, J., Arimondo, P. B. Targeting DNA methylation with small molecules: what’s next. Journal of Medicinal Chemistry. 58 (6), 2569-2583 (2015).
- Chuang, J. C., et al. S110, a 5-Aza-2′-deoxycytidine-containing dinucleotide, is an effective DNA methylation inhibitor in vivo and can reduce tumor growth. Molecular Cancer Therapeutics. 9 (5), 1443-1450 (2010).
- Issa, J. J., et al. Safety and tolerability of guadecitabine (SGI-110) in patients with myelodysplastic syndrome and acute myeloid leukaemia: a multicentre, randomised, dose-escalation phase 1 study. Lancet Oncology. 16 (9), 1099-1110 (2015).
- Datta, J., et al. A new class of quinoline-based DNA hypomethylating agents reactivates tumor suppressor genes by blocking DNA methyltransferase 1 activity and inducing its degradation. Ricerca sul cancro. 69 (10), 4277-4285 (2009).
- Zambrano, P., et al. A phase I study of hydralazine to demethylate and reactivate the expression of tumor suppressor genes. BMC Cancer. 5, 44 (2005).
- Lee, B. H., Yegnasubramanian, S., Lin, X., Nelson, W. G. Procainamide is a specific inhibitor of DNA methyltransferase 1. Journal of Biological Chemistry. 280 (49), 40749-40756 (2005).
- Asgatay, S., et al. Synthesis and evaluation of analogues of N-phthaloyl-l-tryptophan (RG108) as inhibitors of DNA methyltransferase 1. Journal of Medicinal Chemstry. 57 (2), 421-434 (2014).
- Ceccaldi, A., et al. C5-DNA methyltransferase inhibitors: from screening to effects on zebrafish embryo development. Chembiochem. 12 (9), 1337-1345 (2011).
- Fagan, R. L., Wu, M., Chédin, F., Brenner, C. An ultrasensitive high throughput screen for DNA methyltransferase 1-targeted molecular probes. PLoS One. 8 (11), 78752 (2013).
- Fagan, R. L., Cryderman, D. E., Kopelovich, L., Wallrath, L. L., Brenner, C. Laccaic acid A is a direct, DNA-competitive inhibitor of DNA methyltransferase 1. Journal of Biological Chemistry. 288 (33), 23858-23867 (2013).
- Eglen, R. M., Reisine, T. Screening for compounds that modulate epigenetic regulation of the transcriptome: an overview. Journal of Biomolecular Screening. 16 (10), 1137-1152 (2011).
- Holz-Schietinger, C., Matje, D. M., Reich, N. O. Mutations in DNA methyltransferase (DNMT3A) observed in acute myeloid leukemia patients disrupt processive methylation. Journal of Biological Chemistry. 287 (37), 30941-30951 (2012).
- Norvil, A. B., et al. Dnmt3b methylates DNA by a noncooperative mechanism, and its activity is unaffected by manipulations at the predicted dimer interface. Biochimica. 57 (29), 4312-4324 (2018).
- Bashtrykov, P., Ragozin, S., Jeltsch, A. Mechanistic details of the DNA recognition by the Dnmt1 DNA methyltransferase. FEBS Letters. 586 (13), 1821-1823 (2012).
- Bashtrykov, P., et al. Targeted mutagenesis results in an activation of DNA methyltransferase 1 and confirms an autoinhibitory role of its RFTS domain. Chembiochem. 15 (5), 743-748 (2014).
- Berkyurek, A. C., et al. The DNA methyltransferase Dnmt1 directly interacts with the SET and RING finger-associated (SRA) domain of the multifunctional protein Uhrf1 to facilitate accession of the catalytic center to hemi-methylated DNA. Journal of Biological Chemistry. 289 (1), 379-386 (2014).
- Kanada, K., Takeshita, K., Suetake, I., Tajima, S., Nakagawa, A. Conserved threonine 1505 in the catalytic domain stabilizes mouse DNA methyltransferase 1. Journal of Biochemistry. 162 (4), 271-278 (2017).
- Bashtrykov, P., et al. Specificity of Dnmt1 for methylation of hemimethylated CpG sites resides in its catalytic domain. Chemistry & Biology. 19 (5), 572-578 (2012).
- Dolen, E. K., McGinnis, J. H., Tavory, R. N., Weiss, J. A., Switzer, R. L. Disease-associated mutations G589A and V590F relieve replication focus targeting sequence-mediated autoinhibition of DNA methyltransferase 1. Biochimica. 58 (51), 5151-5159 (2019).
- Kilgore, J. A., et al. Identification of DNMT1 selective antagonists using a novel scintillation proximity assay. Journal of Biological Chemistry. 288 (27), 19673-19684 (2013).
- Ceccaldi, A., et al. Identification of novel inhibitors of DNA methylation by screening of a chemical library. ACS Chemical Biology. 8 (3), 543-548 (2013).
- Duchin, S., Vershinin, Z., Levy, D., Aharoni, A. A continuous kinetic assay for protein and DNA methyltransferase enzymatic activities. Epigenetics & Chromatin. 8, 56 (2015).
- Syeda, F., et al. The replication focus targeting sequence (RFTS) domain is a DNA-competitive inhibitor of Dnmt1. Journal of Biological Chemistry. 286 (17), 15344-15351 (2011).
- Switzer, R. L., Medrano, J., Reedel, D. A., Weiss, J. Substituted anthraquinones represent a potential scaffold for DNA methyltransferase 1-specific inhibitors. PLoS One. 14 (7), 0219830 (2019).

