골격근의 지질 액적 함량의 섬유 유형 및 세포내 특이적 분석
Summary
증가하는 증거는 골격근 내부의 지질의 과도한 침투가 지방 독성과 당뇨병을 초래한다는 것을 나타냅니다. 여기에서, 우리는 조직 처리, Bodipy로 염색, 이미지 획득 및 분석을 포함하는 완전한 프로토콜을 제시하여 섬유 유형 특이적 방식으로 지질 방울의 크기, 밀도 및 세포 내 분포를 정량화한다.
Abstract
근막증으로 알려진 골격근 지질 침투는 비만과 노화에 따라 증가합니다. 근막증은 또한 최근에 심혈관 질환 및 암과 같은 여러 다른 장애에 대한 부정적인 예후 인자로 발견되었습니다. 과도한 지질 침투는 근육 질량과 힘을 감소시킵니다. 또한 총 교내 세포 지질 함량, 지질 액적 (LD) 형태 및 아세포 분포에 따라 지방 독성 및 인슐린 저항성을 초래합니다. 섬유 유형 (산화 대 글리콜 성)도 중요한데, 산화 섬유는 지질을 활용할 수있는 능력이 더 크기 때문입니다. 병태생리학에 중요한 영향을 미치기 때문에 LD 역학과 섬유 유형별 기능에 대한 심층적 인 연구가 보장됩니다.
본원에서, 섬유유형별 방식으로 교내 지질 함량의 정량화 및 LD 형태학 및 아세포 분포의 분석을 위한 완전한 프로토콜이 제시된다. 이를 위해, 직렬 근육 동결절편을 형광 염료 보디피 및 미오신 중쇄 이소형에 대한 항체로 염색하였다. 이 프로토콜은 서로 다른 근육을 동시에 처리하여 시간을 절약하고 가능한 아티팩트를 피할 수 있으며 피지에서 생성 된 개인화 된 매크로 덕분에 LD 분석의 자동화도 가능합니다.
Introduction
근막증으로 알려진 골격근 지질 침투는 비만과 노화에 따라 증가합니다. 근막증은 근육량과 강도 및 인슐린 민감성과 부정적인 상관 관계가 있습니다1. 더욱이, 최근의 연구들은 근막증의 정도가 심혈관 질환2, 비알콜성 지방간 질환3 또는 암4과 같은 다른 병태에 대한 예후 인자로서 사용될 수 있음을 나타낸다. 지질은 근세포 외 지질로서 또는 섬유 내에서, 근세포 내 지질(IMCLs)로서 근섬유 사이의 골격근에 축적될 수 있다. IMCL은 주로 신체 운동 5,6 동안 대사 연료로 사용되는 지질 방울 (LDs)의 트리글리 세라이드로 저장됩니다. 그러나 지질 공급이 수요를 초과하거나 미토콘드리아가 기능 장애가되면 IMCL은 대사 적으로 건강에 좋지 않은 비만인 개인 및 제 2 형 당뇨병 환자7에서 볼 수 있듯이 근육 인슐린 저항성에 연루됩니다. 흥미롭게도, 지구력 운동 선수는 높은 인슐린 민감성을 유지하면서 제 2 형 당뇨병을 앓고있는 비만 환자에서 발견되는 것과 비슷한 수준의 IMCL을 가지고 있습니다. 이 현상은 “운동 선수의 역설”8,9로 묘사되며, 크기, 밀도, 국소화, 역학 및 지질 종 구성과 관련된 근육 LDs에 대한보다 미묘한 평가에 의해 설명됩니다.
첫째, LD 크기는 인슐린 민감성 및 체력10,11과 반비례하여 상관관계가 있다. 실제로, 더 작은 LD는 리파아제 작용에 대해 상대적으로 더 큰 표면적을 나타내므로, 잠재적으로 지질(12)을 동원할 수 있는 더 큰 능력을 갖는다. 둘째, LD 밀도 (수 / 표면)는 인슐린 작용 8,10에서 논란의 여지가있는 역할을합니다. 그러나 운동 선수에서 증가한 것으로 보입니다. 셋째, LDs의 세포하 국소화는 중요한데, 이는 표면 막(아사르콜렘말 또는 주변부) 바로 아래에 위치한 LD가 중심 것들보다 인슐린 감수성에 더 해로운 영향을 미치기 때문이다(8,9,13). 후자는 호흡 활동이 더 크고 수축14에 필요한 높은 에너지 수요를 충족시키기 위해보다 전문화 된 중앙 미토콘드리아에 연료를 제공합니다. 대조적으로, 말초 LD는 막 관련 공정에 관여하는 아사르콜렘말 미토콘드리아를 공급한다8. 마지막으로, 트리글리세라이드 이외에도 근육 내의 특정 복합 지질은 다른 지질보다 더 해로울 수 있습니다. 예를 들어, 디아실글리세롤, 장쇄 아실-CoA, 및 세라마이드는 트리글리세리드 턴오버 속도가 낮을 때 근육에 축적되어 인슐린 신호전달 9,15를 손상시킬 수 있다. “운동 선수의 역설”로 돌아가서, 지구력 운동 선수는 유형 I (산화성) 섬유에서 높은 회전율을 가진 더 작은 중앙 LD의 수가 많은 반면, 비만 및 당뇨병 환자는 유형 II (글리콜 성) 섬유 8,15,16에서 낮은 회전율을 가진 더 큰 말초 LD를 가지고 있습니다. 에너지 저장 및 방출에서의 그들의 역할 외에도, 유도 지방산 (FA) 및 코트 단백질 (페리리핀 5)을 통한 LDs는 또한 FA 산화 및 미토콘드리아 생물 발생의 전사 조절에 관여하는 중요한 선수로서 기능 할 수 있습니다8. 생리학 및 병태생리학에 중요한 영향을 미치기 때문에 LD의 역학과 기능에 대한 심층적 인 연구가 보장됩니다.
IMCL을 연구하는 몇 가지 기술이 있지만, LD 크기, 밀도 및 분포를 섬유 특정 방식으로 정확하게 정량화하는 데 모두 적합한 것은 아닙니다. 예를 들어, 자기 공명 분광법에 의한 IMCL의 평가는 비침습적이지만 섬유 내의 LD의 크기와 정확한 위치를 연구하기에 충분하지 않은 수준의 분해능을 제공하며 섬유 유형 특이17,18이 아닙니다. 마찬가지로, 전체 근육 균질물(19)에 대해 수행된 생화학적 기술은 지질의 위치 및 크기를 평가할 수 없다. 결과적으로, LD 형태학 및 위치를 분석하는 가장 적절한 방법은 정량적 투과 전자 현미경(13)이지만, 이 기술은 비용이 많이 들고 시간이 많이 소요된다. 따라서 Oil Red O (ORO) 20,21, monodansylpentane (MDH) 22 또는 Bodipy 23,24,25와 같은 염료를 사용한 제제에 대한 공초점 형광 이미징이 이러한 연구에 가장 적합한 도구로 부상했습니다.
여기에서, 조직 샘플링 및 처리, 보디피 염색, 및 공초점 이미지 획득 및 분석을 포함하는 완전한 프로토콜이 설명되어 마우스 근육 동결절편에서 LD 크기, 수 및 국소화를 정량화한다. IMCL은 산화 섬유와 글리콜 섬유간에 고르게 분포되어 있지 않으며 각 섬유 유형은 LD 역학을 다르게 조절하기 때문에 IMCL에 대한 연구는 섬유 유형 별 16,25,26,27이어야합니다. 따라서, 이 프로토콜은 각 섬유에 의해 발현되는 미오신 중쇄(MyHC) 이소형(들)을 확인하기 위해 직렬 절편에 면역형광을 사용한다. 이 프로토콜의 또 다른 장점은 동결 전에 나란히 놓인 글리콜 (신근 디지토럼 롱구스, EDL)과 산화 (단독) 근육을 동시에 처리하는 것입니다 (그림 1). 이 동시 처리는 시간을 절약 할뿐만 아니라 샘플의 개별 처리로 인한 변동성을 방지합니다.
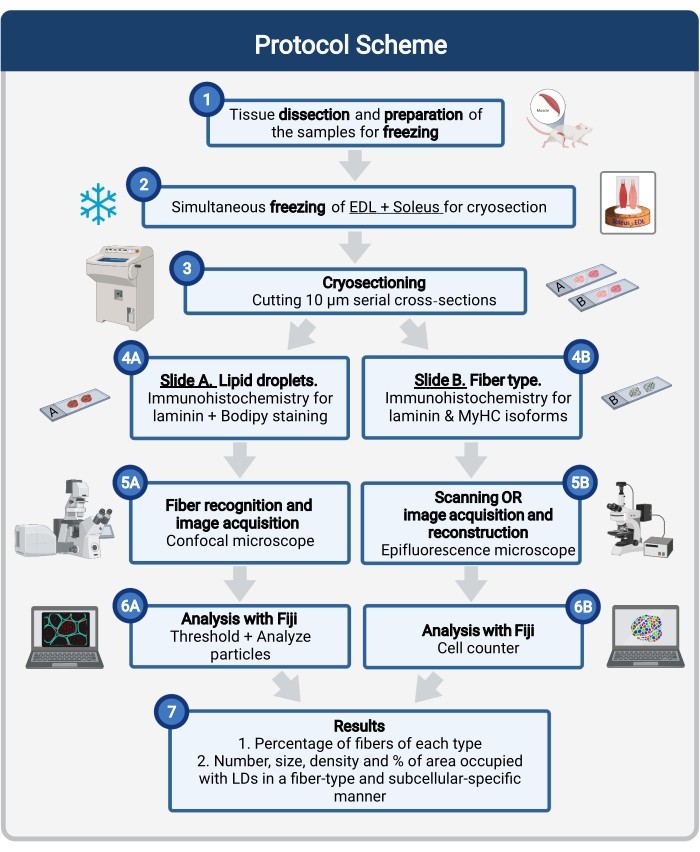
그림 1: 절차의 개략적인 개요. 근육 해부 (1) 후, 유사한 크기의 선택된 근육이 준비되고 함께 얼어 붙습니다 (2). 10 μm의 직렬 횡단 절편은 냉동 장치를 사용하여 얻어지며 접착 슬라이드(3)에 직접 장착된다. 두 개의 연속 슬라이드에서, 첫 번째 (4A)는 라미닌에 대해 면역 표지되고 LD를 인식하기 위해 Bodipy로 염색되고 두 번째 (4B)는 근육 섬유 유형의 인식을 위해 MyHC에 대한 항체로 면역염색됩니다. 이미지는 Bodipy (5A)의 공초점 현미경과 근육 섬유 유형 (5B)에 대한 epifluorescence 현미경을 사용하여 획득됩니다. 이미지는 피지에서 역치 및 정량화 입자(6A)를 적용하여 LDs(7) 또는 카운팅 셀(6B)에 의해 점유된 전체 면적의 수, 평균 크기, 밀도 및 백분율을 구하여 섹션(7)에서 각 유형의 섬유의 백분율을 구함으로써 분석된다. 약어: LDs = 지질 방울; EDL = 신근 디지토럼 경도; MyHCs = 미오신 중쇄 이소형. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
여기에 자세히 설명된 프로토콜은 Bodipy로 태그가 지정된 LD를 섬유형 및 아세포별 기준으로 정량화하는 효율적인 방법을 설명합니다. 최근 몇 년 동안, ORO 또는 수단 블랙 B와 같은 고전적 지질 염료는 중성 지질 (예를 들어, Bodipy)에 결합하는 세포 투과성, 친유성, 형광 염료의 새로운 어레이로 치환되었다. 다른 컨쥬게이트로서 이용 가능한 Bodipy는 LDs를 태깅하여 다른 고정 조직 및 세포<s…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 작품은 Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20)와 Société Francophone du Diabète (SFD-Roche Diabetes Care).C.M.S.의 보조금으로 지원되었습니다. M.A.D.-L.d.C.는 Wallonie-Bruxelles International Excellence Program으로부터 펠로우십을 받았습니다.
저자는이 프로토콜 개발에 기여한 Alice Monnier와 이미지 수집 프로세스에 대한 전문 지식과 기술적 도움을 주신 Caroline Bouzin에게 감사드립니다. 우리는 또한 냉동 및 현미경 (2IP-IREC 이미징 플랫폼, 실험 및 임상 연구 연구소, Université Catholique de Louvain, 1200 브뤼셀, 벨기에)에 액세스 할 수있는 2IP-IREC 이미징 플랫폼에 감사드립니다. 마지막으로, 저자는 원고에 대한 건설적인 비판에 대해 Nicolas Dubuisson, Romain Versele 및 Michel Abou-Samra에게 감사하고 싶습니다. 이 기사의 인물 중 일부는 BioRender.com 로 작성되었습니다.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
Riferimenti
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

