細胞レベルで真菌 - 微生物相互作用をプロービングするためのマイクロ流体ツール
Summary
土壌の不透明度のために、その構成微生物間の相互作用は、細胞分解能で容易に視覚化することができない。ここでは、真菌と微生物の相互作用を調査するための新しい機会を提供する2つのマイクロ流体ツールを紹介します。これらのデバイスは汎用性と使いやすさを備えており、細胞レベルでの高時空間制御と高解像度イメージングを可能にします。
Abstract
糸状菌類は土壌の成功した住人であり、有機物や無機物の分解、栄養レベルの調節など、土壌生態系において大きな役割を果たしています。彼らはまた、細菌や他の真菌のような様々な他の微生物と相互作用する機会を数多く見つけます。しかし、細胞レベルで真菌の相互作用を研究することは、土壌のブラックボックスのような性質のために困難な場合があります。真菌相互作用の研究のために新しいマイクロ流体ツールが開発されています。細菌 – 真菌および真菌 – 真菌相互作用を研究するために設計された2つのプラットフォームが強調表示されています。これらのマイクロチャネル内では、真菌 – 微生物相互作用は、制御された物理化学的環境において、以前よりも高い時間的および空間的分解能で監視することができる。これらのツールの適用は、菌糸への細菌極性付着の観察や、特徴のない真菌 – 真菌拮抗作用の暴露など、多数の新しい生物学的洞察をもたらしてきた。これらの方法論の主な特徴は、非専門家によるこのツールの使いやすさであり、微生物学ラボで使用するための高度に翻訳可能な技術を生み出していることです。
Introduction
土壌は、炭素とリンのサイクルに不可欠な微生物を豊富に含む非常に多様な環境です1,2。糸状菌は、有機物および無機物の分解剤として多数の生態系の主要な構成要素であり、共生関係の形成を通じて植物の栄養を高めることができる3,4。土壌内では、真菌は、他の真菌5、細菌6、ウイルス7および線虫8などの多数の微生物と動的に相互作用する。これらの相互作用は、土壌と植物の健康に重大な影響を及ぼします。しかし、相互作用する微生物を高解像度でイメージングできる適切な実験システムがないため、多くは未定義のままです。
細菌-真菌相互作用(BFI)および真菌-真菌相互作用(FFI)に関する研究は、医学における抗菌剤および農業における生物学的防除剤を含む幅広い分野で貴重な用途を有する。例えば、真菌コプリノプシス・シネレアはペプチドコプシンを産生し、これはヒト病原体リステリア・モノサイトゲネス9に対して抗菌活性を示すことが示されている。同様に、真菌由来化合物であるグリセオフルビンは、ヒト真菌感染症の治療薬として広く使用されており、植物病原性真菌Alternaria solani10,11の増殖をさらに阻害することができる。土壌に生息する細菌バチルス・サチルスのいくつかの菌株もまた、真菌性植物病原菌リゾクトニア・ソラニ12、13の有効な生物防除剤であることが実証されている。それにもかかわらず、従来の方法論に関連する制限のために、BFIおよびFFIは単一細胞レベルではあまり理解されていない。
従来の研究では、通常、2種以上の種が対立する寒天プレートを使用して、マクロスケールでBFIおよびFFIを探索します。それらの相互作用は、対峙する種の増殖速度および代謝産物産生を測定することによって評価される14,15,16;しかし、この方法論はコロニーレベルにのみ解決されています。細胞レベルでの相互作用を研究するために、細菌および真菌接種剤を、寒天でコーティングしたガラス顕微鏡スライド上で培養し、次いで顕微鏡17下で画像化することができる。それにもかかわらず、閉じ込められていないため、顕微鏡スライドを使用して単一の菌糸をたどることは困難であり、タイムラプス画像を得るのが難しくなることを意味する。さらに、真菌菌糸体の定義された領域内に他の微生物を空間的に閉じ込めたり、摂動し得る定義された化学的環境を作り出す機会は、例えば、そのようなセットアップでは不可能である。土壌の「ブラックボックス」の性質はまた、単一細胞レベルでの真菌 – 微生物相互作用の研究の複雑さを増す18。土壌マイクロバイオームの信じられないほどの多様性から離れて相互作用する種を観察することによって、個々のメンバーが相互作用する正確な方法を評価することができます。したがって、BFIおよびFFIの高解像度、単一細胞イメージングを可能にする汎用性の高いプラットフォームが引き続き必要とされています。
マイクロ流体技術、いわゆるラボオンチップシステムは、単一細胞レベルでのBFIおよびFFIの研究に理想的なプラットフォームを提供します。マイクロ流体学の分野は、化学分析やマイクロエレクトロニクスのために開発された技術に由来し、生物科学19によって採用されています。マイクロ流体技術は、マイクロメートルスケールで少なくとも1つの次元を有する、小型化されたチャネルのオーダーメイドネットワーク内で少量の流体を調節し、生物学的研究におけるそれらの使用は20拡大している。特に、糸状菌21、22、23、24、25、26、27、28、29、30の生育を調べるためにマイクロ流体デバイスが開発されている。この技術を使用する利点の1つは、菌糸の閉じ込めおよびマイクロチャネル内の栄養素の分布が、従来の寒天法31よりも土壌環境の構造によく似ていることである。最近、マイクロ流体プラットフォームは、ヒト好中球と真菌病原体32、細菌と植物の根33、ならびに真菌と線虫34、35との間の相互作用を調査するために使用されている。
微生物相互作用を研究するためにマイクロ流体学を使用することの多くの利点の1つは、マイクロ流路環境の特定の制御を含む。例えば、層流レジームを利用して、定義された濃度勾配を生成することができ、これは、細菌の走化性36を調べる際に特に有用である。別の利点は、マイクロ流体装置の製造に一般的に使用される安価で生体適合性のエラストマーポリマーであるポリ(ジメチルシロキサン)(PDMS)の透明な性質が、明視野および蛍光顕微鏡を用いた単一細胞の高解像度イメージングを容易にすることである37。同様に、マイクロチャネル内に微生物が閉じ込められるということは、単一細胞を追跡するタイムラプス実験を実施できることを意味し、個々の細胞応答を記録し、定量化することができる37。最後に、マイクロ流体デバイスは、ユーザーフレンドリーであるように設計することができるので、非専門家38によって容易に使用することができる。
土壌に生息する微生物間の相互作用に関する知識を深めることは、生物多様性を維持し、気候変動が陸域環境に与える影響を緩和する持続可能な生態系管理慣行を改善するために重要である39。したがって、新しいマイクロ流体ツールの開発は、真菌とその相互作用の細胞レベルでの理解を広げるための基本です。ここでのプロトコルは、図1に示すように、BFIs40およびFFI41の研究のために製造された2つのマイクロ流体デバイスに焦点を当てます。
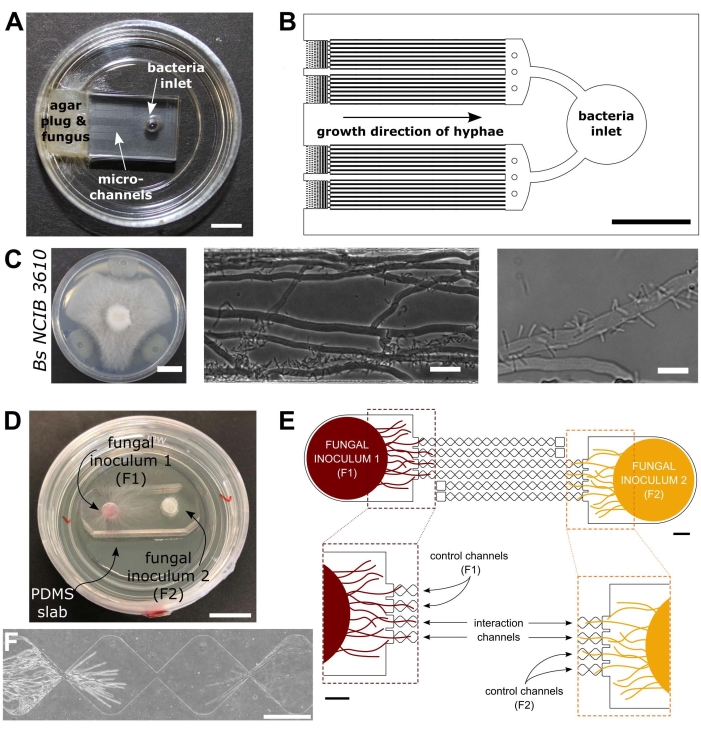
図1:細菌 – 真菌相互作用(BFI)および真菌 – 真菌相互作用(FFI)デバイスの視覚的および概略図。菌糸プラグは、マイクロチャネルの一端への入り口に配置され、装置への菌糸の成長を可能にする。細菌入口は反対側の端にある。(B)BFI装置の概略概要、相互作用マイクロチャネルを通る細菌入口の位置決めおよび菌糸増殖の方向を描写する。チャンネルは深さ10μm、幅100μm、長さ7mmで、合計28の観測チャンネルがあります。(c)コプリノプシス・シネレアと枯草菌NCIB 3610との間の寒天プレート上での対決アッセイ、スケールバー=20mm(左)。マイクロ流路内(中央および右)内のC.シネレアと枯草菌NCIB 3610との間の相互作用、すなわち真菌菌糸への細菌の極性付着を示す顕微鏡観察画像。スケールバー = 25 μm (中央) と 10 μm (右)。(d)FFI装置をガラス底のシャーレに貼り合わせ、菌糸栓を二重接種した画像。スケールバー = 1 cm. (E) FFIデバイスの概略概要。2つの真菌接種プラグが装置の両端の入口に導入され、マイクロチャネルの菌糸探索を可能にする。制御チャネルは、1つの真菌入口にのみ接続され、デッドエンドチャネルを有し、試験真菌間の相互作用を防止する。相互作用チャネルは、両方の真菌入口を接続し、マイクロチャネル内の試験対象間の菌糸相互作用を可能にする。各相互作用チャネルは、18個のダイヤモンド状のセクションで構成され、全長8.8mm(ダイヤモンドあたり490 x 430 μm)、深さ10 μm、各ダイヤモンド間の接続領域は20 μmです。チャネルタイプは複製され、スケールバー = 1 mm. (F) 相互接続された相互作用チャネルの両端から成長する、接近する2つの菌糸前部間の相互作用ゾーン。位相差顕微鏡観察像は、スケールバー=250μmである。この図のパネルは、Stanley et al., 2014 (A-C)40 および Gimeno et al., 2021 (D-F)41 から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
この記事では、チャネルマイクロフルイディクスを用いた真菌-微生物相互作用の研究のためのプロトコルを提示する。著者らは、これらの装置の汎用性を実証し、研究者の興味に合うように適応させることを目指している。手本となるBFIおよびFFIデバイスを使用して、真菌 – 微生物相互作用を以前にアクセス可能であったよりも詳細に研究することができる。土壌の背景の複雑さと不均一性…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
我々は、インペリアル・カレッジ・ロンドンの生物工学科及びレバーハルム・トラスト(研究助成金参照:RPG-2020-352)からの財政的支援を認める。
Materials
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
Riferimenti
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).

