Mikrotensiometer til konfokal mikroskopi Visualisering af dynamiske grænseflader
Summary
Dette manuskript beskriver design og drift af et mikrotensiometer / konfokalt mikroskop til at foretage samtidige målinger af grænsefladespænding og overfladedilatationel reologi, mens man visualiserer grænseflademorfologien. Dette giver realtidskonstruktion af struktur-ejendomsforhold af grænseflader, der er vigtige inden for teknologi og fysiologi.
Abstract
Adsorption af overfladeaktive molekyler til væske-væske-grænseflader er allestedsnærværende. Karakterisering af disse grænseflader kræver måling af overfladeaktive stoffers adsorptionshastigheder, evaluering af ligevægtsoverfladespændinger som funktion af koncentrationen af overfladeaktive stoffer i bulk og relaterer, hvordan overfladespændingen ændres med ændringer i grænsefladeområdet efter ligevægt. Samtidig visualisering af grænsefladen ved hjælp af fluorescensbilleddannelse med et højhastighedskonfokalmikroskop muliggør direkte evaluering af struktur-funktionsforhold. I kapillærtrykmikrotensiometeret (CPM) fastgøres en halvkugleformet luftboble i slutningen af kapillæren i et 1 ml volumen væskereservoir. Kapillærtrykket over boblegrænsefladen styres via en kommerciel mikrofluidisk flowregulator, der giver mulighed for modelbaseret tryk- eller boblekrumningskontrol eller bobleområdekontrol baseret på Laplace-ligningen. Sammenlignet med tidligere teknikker som Langmuir-trug og vedhængsdråbe forbedres måle- og kontrolpræcisionen og responstiden kraftigt; kapillærtrykvariationer kan påføres og kontrolleres i millisekunder. Boblegrænsefladens dynamiske respons visualiseres via en anden optisk linse, når boblen udvider sig og trækker sig sammen. Boblekonturen passer til en cirkulær profil for at bestemme boblekrumningsradius, R, samt eventuelle afvigelser fra cirkularitet, der ville ugyldiggøre resultaterne. Laplace-ligningen bruges til at bestemme grænsefladens dynamiske overfladespænding. Efter ækvilibrering kan små trykoscillationer pålægges af den computerstyrede mikrofluidpumpe for at svinge bobleradiusen (frekvenser på 0,001-100 cyklusser / min) for at bestemme dilatationsmodulet Systemets overordnede dimensioner er tilstrækkeligt små til, at mikrotensiometeret passer under linsen i et højhastighedskonfokalmikroskop, der gør det muligt at spore fluorescerende mærkede kemiske arter kvantitativt med submikron lateral opløsning.
Introduction
Luft-vand-grænseflader, der er dækket af overfladeaktive film, er allestedsnærværende i det daglige liv. Injektioner med overfladeaktivt vand bruges til at forbedre olieindvindingen fra udtømte felter og bruges som hydrauliske fraktureringsløsninger til skifergas og olie. Gas-flydende skum og flydende-flydende emulsioner er fælles for mange industrielle og videnskabelige processer som smøremidler og rengøringsmidler og er almindelige i fødevarer. Overfladeaktive stoffer og proteiner ved grænseflader stabiliserer antistofkonformationer under emballering, opbevaring og administration 1,2,3,4,5, tårefilmstabilitet i øjet 6,7,8 og lungemekanik 9,10,11,12,13,14 15.
Undersøgelsen af overfladeaktive stoffer eller overfladeaktive stoffer, der adsorberer til grænseflader og deres egenskaber, har en lang historie med mange forskellige eksperimentelle teknikker 16,17,18,19,20,21,22,23,24,25,26,27 . En nylig udvikling er kapillærtrykmikrotensiometeret (CPM), som gør det muligt at undersøge grænsefladeegenskaber på stærkt buede grænseflader i meget mindre længdeskalaer, mens der anvendes betydeligt færre materialer end andre almindelige metoder 9,23,24,25. Konfokal fluorescensmikroskopi (CFM) kan bruges til at studere morfologien af lipider og proteiner ved luft-vand-grænsefladerne i CPM22 eller på Langmuir-trugene 20,26,27,28,29. Her er en CPM og CFM blevet kombineret for at forbinde morfologiske fænomener med dynamiske og ligevægts-grænsefladeegenskaber for at udvikle struktur-funktionsforhold for biologiske og teknologiske grænseflader.
Der er adskillige parametre af betydning i grænsefladeoverfladeaktive stoffer, der er tilgængelige for CPM-CFM. I CPM er en luftboble på 30-200 μm diameter fastgjort til spidsen af et glaskapillærrør. I tidligere versioner af CPM blev kapillærtrykforskellen mellem indersiden og ydersiden af boblen styret via en vandsøjle og oscillerende sprøjtepumpe 9,30 ; den nye version, der er beskrevet her, erstatter disse med en computerstyret mikrofluidisk pumpe med højere præcision. Overfladespændingen (γ) bestemmes via Laplace-ligningen, ΔP = 2γ / R, fra trykfaldet over grænsefladen indstillet af pumpen, ΔP, og optisk analyse af boblens krumningsradius, R. Grænsefladens dynamiske overfladespænding kan bestemmes med en tidsopløsning på 10 ms efter dannelsen af en ny boble i kontakt med en bulkvæske indeholdende et opløseligt overfladeaktivt stof. Det overfladeaktive stofs adsorptionsdynamik kan beskrives ved den klassiske Ward-Tordai-ligning10,31 for at bestemme det overfladeaktive stofs væsentlige egenskaber, herunder diffusivitet, overfladedækning og forholdet mellem bulkkoncentration og ligevægtsoverfladespænding. Når en ligevægtsoverfladespænding er opnået, kan grænsefladeområdet oscilleres for at måle dilatationsmodulet, 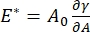 ved at registrere ændringerne i overfladespændingen, induceret af små ændringer i boblens overfladeareal, A32. For mere komplekse grænseflader, der udvikler deres egne indre strukturer såsom sammenfiltrede polymerer eller proteiner, erstattes overfladespændingen, , af en mere generel overfladespænding 4,33,
ved at registrere ændringerne i overfladespændingen, induceret af små ændringer i boblens overfladeareal, A32. For mere komplekse grænseflader, der udvikler deres egne indre strukturer såsom sammenfiltrede polymerer eller proteiner, erstattes overfladespændingen, , af en mere generel overfladespænding 4,33, 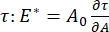 .
.
Lungestabilitet under vejrtrækning kan være direkte bundet til at opretholde både en lav overfladespænding og et højt dilatationsmodul ved den alveolære luft-væske-grænseflade 9,10. Alle indre lungeoverflader er foret med en kontinuerlig, mikrontyk film af epitelforingsvæske for at opretholde vævshydrering34. Denne epitelforingsvæske er primært vand med salte og forskellige andre proteiner, enzymer, sukkerarter og lungeoverfladeaktive stoffer. Som det er tilfældet for enhver buet væske-damp-grænseflade, induceres et kapillærtryk med trykket højere på indersiden af alveolus (eller boblen). Men hvis overfladespændingen var konstant overalt i lungerne, viser Laplace-ligningen, ΔP = 2γ / R, at mindre alveoler ville have et højere indre tryk i forhold til større alveoler, hvilket tvinger gasindholdet i de mindre alveoler til at strømme til større alveoler med lavere tryk. Dette er kendt som “Laplace Instability”9,35. Nettoresultatet er, at de mindste alveoler ville kollapse og blive fyldt med væske og blive vanskelige at puste op igen, hvilket fik en del af lungen til at kollapse, og andre dele ville overoppustes, som begge er typiske symptomer på akut respiratorisk nødsyndrom (ARDS). I en korrekt fungerende lunge ændres overfladespændingen imidlertid dynamisk, da luft-epitelvæskegrænsefladen i alveolus-grænsefladeområdet udvides og trækker sig sammen under vejrtrækning. Hvis 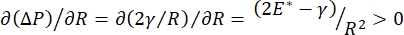 , eller
, eller 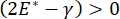 , falder Laplace-trykket med faldende radius og stiger med stigende radius for at eliminere Laplace-ustabiliteten og derved stabilisere lungen9. Derfor,
, falder Laplace-trykket med faldende radius og stiger med stigende radius for at eliminere Laplace-ustabiliteten og derved stabilisere lungen9. Derfor, 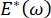 , og hvordan det afhænger af frekvens, monolagsmorfologi og sammensætning, og alveolær væskesammensætning kan være afgørende for lungestabilitet. CPM-CFM har også givet de første demonstrationer af virkningerne af grænsefladekrumning på overfladeaktiv adsorption25, monolagsmorfologi22 og dilatationsmodul9. Det lille volumen (~ 1 ml) af reservoiret i CPM muliggør hurtig introduktion, fjernelse eller udveksling af væskefasen og minimerer den krævede mængde dyre proteiner eller overfladeaktive stoffer10.
, og hvordan det afhænger af frekvens, monolagsmorfologi og sammensætning, og alveolær væskesammensætning kan være afgørende for lungestabilitet. CPM-CFM har også givet de første demonstrationer af virkningerne af grænsefladekrumning på overfladeaktiv adsorption25, monolagsmorfologi22 og dilatationsmodul9. Det lille volumen (~ 1 ml) af reservoiret i CPM muliggør hurtig introduktion, fjernelse eller udveksling af væskefasen og minimerer den krævede mængde dyre proteiner eller overfladeaktive stoffer10.
Kontrast i et CPM-CFM-billede skyldes fordelingen af små fraktioner af fluorescerende mærkede lipider eller proteiner ved grænsefladen16,27. Todimensionale overfladeaktive monolag udviser ofte lateral faseadskillelse som en funktion af overfladespænding eller overfladetryk, 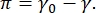 π er forskellen mellem overfladespændingen af en ren væske-væske-grænseflade, γ0, og en overfladeaktivt stofdækket grænseflade, γ. π kan betragtes som 2-D “trykket” forårsaget af interaktionerne mellem overfladeaktive molekyler ved grænsefladen, der virker til at sænke den rene væskeoverfladespænding. Ved lavt overfladetryk er lipidmonolag i en væskelignende uorganiseret tilstand; dette er kendt som den væskeudvidede (LE) fase. Når overfladetrykket stiger, og arealet pr. lipidmolekyle falder, orienterer lipiderne sig med hinanden og kan gennemgå en første ordensfaseovergang til den langtrækkende bestilte væske kondenserede (LC) fase 16,20,27. LE- og LC-faserne kan eksistere sammen ved forskellige overfladetryk og kan visualiseres, da fluorescerende mærkede lipider udelukkes fra LC-fasen og adskilles til LE-fasen. LE-fasen er således lys, og LC-fasen er mørk, når den er afbildet med CFM16.
π er forskellen mellem overfladespændingen af en ren væske-væske-grænseflade, γ0, og en overfladeaktivt stofdækket grænseflade, γ. π kan betragtes som 2-D “trykket” forårsaget af interaktionerne mellem overfladeaktive molekyler ved grænsefladen, der virker til at sænke den rene væskeoverfladespænding. Ved lavt overfladetryk er lipidmonolag i en væskelignende uorganiseret tilstand; dette er kendt som den væskeudvidede (LE) fase. Når overfladetrykket stiger, og arealet pr. lipidmolekyle falder, orienterer lipiderne sig med hinanden og kan gennemgå en første ordensfaseovergang til den langtrækkende bestilte væske kondenserede (LC) fase 16,20,27. LE- og LC-faserne kan eksistere sammen ved forskellige overfladetryk og kan visualiseres, da fluorescerende mærkede lipider udelukkes fra LC-fasen og adskilles til LE-fasen. LE-fasen er således lys, og LC-fasen er mørk, når den er afbildet med CFM16.
Målet med dette manuskript er at beskrive de trin, der er nødvendige for at opbygge og betjene det kombinerede konfokale mikroskop mikrotensiometer. Dette vil gøre det muligt for læseren at udføre adsorptionsundersøgelser, måle overfladespænding, reologisk adfærd og undersøge grænseflademorfologi samtidigt på en mikronskala luft / vand eller olie / vand-grænseflade. Dette inkluderer en diskussion af, hvordan man trækker, skærer og hydrofoberer de krævede kapillærer, instruktioner til brug af tryk-, krumnings- og overfladearealkontroltilstande og grænsefladeoverførsel af uopløseligt overfladeaktivt middel til mikrotensiometerets buede grænseflade.
Protocol
Representative Results
Discussion
Den kombinerede CPM /CFM er et kraftfuldt værktøj til undersøgelse af grænsefladedynamik, ligevægte og morfologi. Denne protokol beskriver de trin, der er nødvendige for at indhente data med CPM/CFM.
Figur 2 viser celledesignet med kanaler til kapillær, opløsningsmiddel og varmeveksling angivet. Indløbet til opløsningsmiddeludveksling skal være i bunden af cellen, mens udløbet skal være øverst, så cellen ikke løber over under udvekslingen. I praksi…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Alle de konfokale mikroskopibilleder blev opnået ved hjælp af Nikon A1RHD Multiphoton opretstående konfokalmikroskop. Vi anerkender vejledning og hjælp fra supportpersonalet, især Guillermo Marques, ved University Imaging Center ved University of Minnesota. Dette arbejde blev støttet af NIH Grant HL51177. SI blev støttet af en Ruth L. Kirschstein NRSA Institutional Research Training Grant F32 HL151128.
Materials
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ – cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL – 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Riferimenti
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44 (2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al., Ramachadran, A., et al. . Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. , (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., Nag, K., et al. . Surfactant Progress. , (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604 (2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. . Physical Chemistry of Surfaces, Sixth ed. , 784 (1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14 (2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115 (2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).

