Farelerde Kraniyal Pencere Cerrahisi için Robotla Delinmiş Kraniotomiden Kaynaklanan Termal Hasarın Değerlendirilmesi
Summary
Kraniyal pencereler, transgenik farelerde intravital görüntülemeye izin vermek için her yerde uygulanan bir cerrahi teknik haline gelmiştir. Bu protokol, kafatası pencerelerinin yarı otomatik kemik delmesini gerçekleştiren ve cerrahtan cerraha değişkenliği azaltmaya ve termal kan-beyin bariyeri hasarını kısmen azaltmaya yardımcı olabilecek cerrahi bir robotun kullanımını açıklamaktadır.
Abstract
Kraniyal pencere cerrahisi, multifoton veya diğer intravital görüntüleme teknikleri kullanılarak canlı farelerde beyin dokusunun görüntülenmesini sağlar. Bununla birlikte, elle herhangi bir kraniyotomi yapılırken, genellikle beyin dokusunda termal hasar vardır, bu da doğal olarak ameliyattan ameliyata değişkendir ve bireysel cerrah tekniğine bağlı olabilir. Cerrahi bir robotun uygulanması, ameliyatı standartlaştırabilir ve ameliyatla ilişkili termal hasarda bir azalmaya yol açabilir. Bu çalışmada, termal hasarı değerlendirmek için üç robotik sondaj yöntemi test edilmiştir: yatay, noktadan noktaya ve darbeli noktadan noktaya. Yatay delme, sürekli bir delme şeması kullanırken, noktadan noktaya kafatası penceresini çevreleyen birkaç delik açar. Darbeli noktadan noktaya, sondaj arasında soğutmaya izin vermek için “2 s açık, 2 s kapalı” bir sondaj şeması ekler. İntravenöz olarak enjekte edilen Evans Blue (EB) boyasının floresan görüntülemesi, beyin dokusuna verilen hasarı ölçerken, sondaj sahasının altına yerleştirilen bir termokupl termal hasarı ölçer. Termokupl sonuçları, yatay (16.66 °C ±± 2.08 °C) ve noktadan noktaya (18.69 °C ± 1.75 °C) gruplara kıyasla darbeli noktadan noktaya (6.90 °C 1.35 °C) grupta sıcaklık değişiminde önemli bir düşüş olduğunu göstermektedir. Benzer şekilde, darbeli noktadan noktaya grup, yatay yönteme kıyasla kranial pencere delme işleminden sonra önemli ölçüde daha az EB varlığı gösterdi ve bu da beyindeki kan damarlarına daha az zarar verdiğini gösterdi. Bu nedenle, darbeli bir noktadan noktaya delme yöntemi, termal hasarı azaltmak için en uygun şema gibi görünmektedir. Robotik matkap, eğitimi, değişkenliği en aza indirmeye ve termal hasarı azaltmaya yardımcı olan kullanışlı bir araçtır. Araştırma laboratuvarlarında çoklu foton görüntülemenin kullanımının artmasıyla, sonuçların titizliğini ve tekrarlanabilirliğini artırmak önemlidir. Burada ele alınan yöntemler, alanı daha da ilerletmek için bu cerrahi robotların nasıl daha iyi kullanılacağı konusunda başkalarını bilgilendirmeye yardımcı olacaktır.
Introduction
Kraniyal pencereler, canlı hayvanlarda korteksin doğrudan görselleştirilmesine ve görüntülenmesine izin vermek için nörobilim, sinir mühendisliği ve biyoloji alanlarında her yerde kullanılmaktadır 1,2,3,4,5,6,7,8,9,10,11 . Transgenik farelerin ve çoklu foton görüntülemenin güçlü kombinasyonu, in vivo beyindeki devre aktivitesi ve diğer biyolojik içgörüler hakkında son derece değerli bilgiler sağlamıştır 12,13,14,15,16,17,18. Kafatasına monte edilen minyatür mikroskoplar, uyanık, serbestçe hareket eden hayvanlarda kayıt yapılmasını sağlamak için bu yetenekleri daha da genişletmiştir19. Bir kranial pencere oluşturma işlemi, korteks20 üzerinde şeffaf bir cam parçasını sabitlemek için yeterince büyük kraniyotomiler üretmek için kranial kemiği inceltmek veya tamamen çıkarmak için güç delme gerektirir. Polidimetilsiloksan (PDMS) ve diğer polimerler de kraniyal pencere malzemeleri olarak test edilmiştir 9,21. Sonuçta, ideal kraniyal pencere, altındaki normal endojen aktiviteyi değiştirmeyen veya müdahale etmeyen penceredir. Bununla birlikte, kraniyal pencere sondajının altta yatan dokuyu ağırlaştırdığı, beyne zarar verdiği, çevrenin bozulmasına ve meninksleri çoklu foton görüntüleme derinliğini tıkadığı noktaya kadar etkilediği yaygın olarak kabul edilmektedir22. Ortaya çıkan nöroinflamasyon, kan-beyin bariyerinin (BBB) geçirgenliğinden, implant bölgesi etrafındaki glial hücrelerin aktivasyonuna ve işe alınmasına kadar geniş bir etki yelpazesine sahiptir23. Bu nedenle, daha güvenli ve daha tekrarlanabilir kraniyal pencere delme yöntemlerinin karakterize edilmesi, tutarlı görüntüleme kalitesi ve kafa karıştırıcı faktörlerin azaltılması için çok önemlidir.
Altta yatan dokuya travmayı en aza indirmek için özen gösterilirken, kemiği delme eylemi beyinde hem termal hem de mekanik bozulmalara neden olma potansiyeline sahiptir24,25. Dura içine kazara matkap penetrasyonundan kaynaklanan mekanik travma, değişen derecelerde kortikal yaralanmaya neden olabilir24. Shoffstall ve ark.25 tarafından yapılan bir çalışmada, kemik delme işleminden kaynaklanan ısı, beyin parankiminde Evans Blue (EB) boyasının varlığıyla belirtildiği gibi, BBB geçirgenliğinin artmasına neden olmuştur 25. İntravenöz olarak enjekte edilen EB boyası, kan dolaşımındaki dolaşımdaki albümine bağlanır ve bu nedenle normalde sağlıklı bir BBB’yi kayda değer konsantrasyonlarda geçmez. Sonuç olarak, EB boyası yaygın olarak BBB geçirgenliği26,27’nin hassas bir belirteci olarak kullanılır. Çalışmaları, BBB geçirgenliğinin incelenen sonraki biyolojik sekeller üzerindeki etkisini doğrudan ölçmemiş olsa da, önceki çalışmalar BBB geçirgenliğini, kronik olarak implante edilmiş mikroelektrotlara ve motor fonksiyondaki değişikliklere karşı artmış nöroinflamatuar yanıt ile ilişkilendirmiştir28.
Çalışmanın amaçlarına bağlı olarak, termal ve mekanik hasarın büyüklüğü, çalışmanın titizliğini ve tekrarlanabilirliğini olumsuz yönde etkileyen bir deneysel hata kaynağına katkıda bulunabilir. Her biri farklı sondaj ekipmanları, hızları, tekniklerive kullanıcıları 1,2,3,4,5,6,7,8,9,10,11 kullanan kranial pencereler üretmek için düzinelerce atıf yapılan yöntem vardır. Shoffstall ve ark.25, ısıtma sonuçlarında gözlemlenen varyasyonun, matkabın uygulanan kuvveti, ilerleme hızı ve uygulama açısındaki değişkenliğe ve elle delme sırasında kontrol edilemeyen diğer hususlara atfedildiğini bildirmiştir 25. Otomatik sondaj sistemlerinin ve diğer stereotaksik ekipmanların tekrarlanabilirliği ve sonuç tutarlılığını artırabileceğine dair bir inanç vardır, ancak yayınlanmış yöntem çalışmaları, sonuçlardan biri olarak sıcaklığı veya BBB geçirgenliğini titizlikle değerlendirmemiştir. Bu nedenle, kraniyal pencereleri üretmek için daha tekrarlanabilir ve tutarlı bir şekilde uygulanan yöntemlerin yanı sıra, kraniyal pencere sondajının altta yatan sinir dokusu üzerindeki etkisini değerlendirmek için titizlikle uygulanan yöntemlere ihtiyaç vardır.
Bu çalışmanın odak noktası, kranial pencereler için tutarlı ve güvenli delme yöntemlerini belirlemek ve geliştirmektir. Kraniyal pencere kurulumu için kraniyotominin boyutu, beyin implante mikroelektrotları için standart kraniyotomilerden önemli ölçüde daha büyüktür. Bu tür kraniyotomiler standart ekipman kullanıldığında tek bir çapak deliği ile tamamlanamaz, bu nedenle elle yapıldığında cerrahlar arası teknik değişkenliği daha fazla ortaya çıkar20. Cerrahi delme robotları sahaya tanıtıldı, ancak yaygın olarak benimsenmedi1,6,29. Sondajın otomasyonu, gözlemlenen denemeden denemeye varyasyona katkıda bulunan değişkenler üzerinde kontrol sağlar ve bu da ekipmanın kullanımının cerrahlar arası ve cerrahlar arası etkileri azaltabileceğini düşündürmektedir. Kraniyal pencere yerleşimi için gereken daha büyük kraniyotominin ek zorluğu göz önüne alındığında bu özellikle ilgi çekicidir. Sondajın otomatikleştirilmesinin sağladığı kontrolün net faydaları olduğu varsayılabilirken, bu ekipmanların uygulanmasına ilişkin çok az değerlendirme yapılmıştır. Görünür lezyonlar gözlenmemiş olmasına rağmen5, EB kullanılarak daha yüksek duyarlılık testi istenmektedir.
Burada, BBB geçirgenliği, stereotaksik koordinatların programlanmasına, kraniyotomi planlamasına / haritalamasına ve matkap ucunun yönlendirilmiş yoluna atıfta bulunan bir dizi delme stiline (“noktadan noktaya” ve “yatay”) izin veren ilgili yazılıma sahip, ticari olarak temin edilebilen bir cerrahi delme robotu kullanılarak ölçülür. Başlangıçta, kafatası penceresini özetleyen sekiz “tohum” noktası delinir (Şekil 1A). Buradan, tohumlar arasındaki boşluk “noktadan noktaya” veya “yatay” matkap yöntemi kullanılarak kesilir. “Noktadan noktaya” dikey pilot delik kesimleri (CNC matkap presine benzer) gerçekleştirirken, “yatay”, deliği özetleyen kafatası penceresinin çevresi boyunca yatay kesimler gerçekleştirir (bir CNC yönlendiriciye benzer). Her iki yöntemin de sonucu, kafatası penceresini ortaya çıkarmak için çıkarılabilen bir kafatası parçasıdır. Delme işleminden kaynaklanan hasarı izole etmek için, herhangi bir ek hasarı önlemek için kafatası penceresi fiziksel olarak çıkarılmaz. Farelerde kraniyotomiler yapıldıktan sonra BBB geçirgenliğini ölçmek için floresan görüntüleme ile birleştirilmiş EB boyasının bir kombinasyonu kullanılır ve sondaj sırasında beyin yüzeyinin sıcaklığını doğrudan ölçmek için yerleştirilmiş bir termokupl kullanılır (Şekil 1B, C). Önceki gözlemler, 2 s aralıklarla darbeli delme açma / kapamanın, matkap ısıtması25’i hafifletmek için yeterli olduğunu ve bu nedenle cerrahi robot için deneysel yaklaşıma dahil edildiğini göstermiştir.
Sunulan çalışmanın amacı, kraniyotomi sondajından kaynaklanan termal hasarı değerlendirme yöntemlerini göstermektir. Yöntemler otomatik delme bağlamında sunulurken, bu tür yöntemler manuel delme şemalarına da uygulanabilir. Bu yöntemler, standart bir prosedür olarak kabul edilmeden önce ekipman ve / veya sondaj planlarının kullanımını doğrulamak için kullanılabilir.
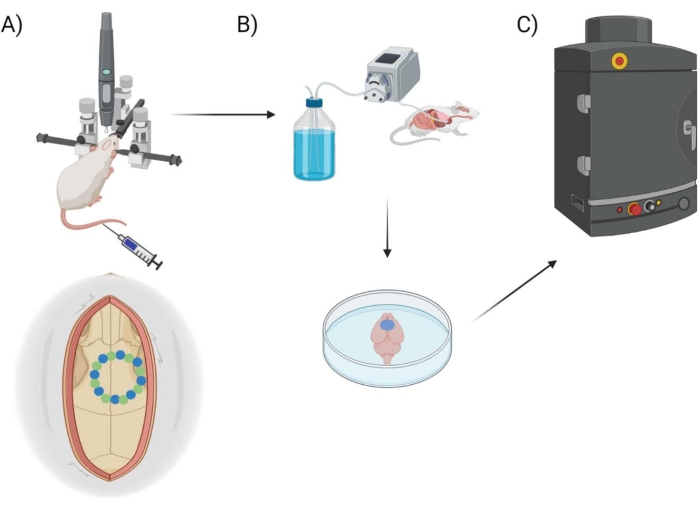
Şekil 1: Deneysel işlem hattı şeması. Hayvanların kraniyal pencere prosedürü sonrası EB ölçümü için maruz kaldıkları süreci gösteren şematik. (A) Stereotaksik çerçeve ve cerrahi robot matkap ile farenin şematik kurulumu. Motor korteks üzerinde tohum noktaları (yeşil) ve kenar noktaları (mavi) ile örnek bir kraniyal pencere gösterilmiştir. (B) Perfüzyon kurulumu, herhangi bir kanı çıkarmak için hayvan boyunca 1x Fosfat Tamponlu Salin (PBS) enjekte edilmesini ve ardından beynin ekstraksiyonunu içerir. (C) Beyin daha sonra Evans Blue boyası üzerinde floresan görüntüleme yapmak için EB floresan görüntüleme sistemi odasına yerleştirilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
EB boya ve görüntüleme kullanımı, yeni yöntemler ve teknikler için beyindeki vasküler hasarı değerlendirmek için basit, hızlı ve yararlıdır. İster cerrahi bir robot kullanın, ister şu anda laboratuvarda yapılan yöntemleri onaylayın, deneysel tedavilerin cerrahi etkiye karşı etkilerini izole etmek ve hayvan refahını iyileştirmek için cerrahi yöntemleri doğrulamak önemlidir. Bir termokupl kurulumu, ısınma oluşmamasını sağlamak için sondaj yöntemlerinin değerlendirilmesinde de yararlı…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Bu çalışma kısmen Amerika Birleşik Devletleri (ABD) Gazi İşleri Bakanlığı Rehabilitasyon Araştırma ve Geliştirme Servisi’nden GRANT12418820 (Capadona) ve GRANTI01RX003420 (Shoffstall / Capadona) Merit Review Awards # GRANT12635707 (Capadona) tarafından desteklenmiştir. Ek olarak, bu çalışma kısmen Ulusal Sağlık Enstitüsü, Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü GRANT12635723 (Capadona) ve Ulusal Biyomedikal Görüntüleme ve Biyomühendislik Enstitüsü, T32EB004314 (Capadona / Kirsch) tarafından da desteklenmiştir. Bu materyal, Ulusal Bilim Vakfı Lisansüstü Araştırma Bursu tarafından Hibe No. GRANT12635723 kapsamında desteklenen çalışmalara dayanmaktadır. Bu materyalde ifade edilen herhangi bir görüş, bulgu ve sonuç veya öneri, yazar(lar)a aittir ve Ulusal Bilim Vakfı’nın görüşlerini yansıtmak zorunda değildir.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
Riferimenti
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neuroscienze. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

