En effektiv clearingprotokoll for studier av frøutvikling i tomat (Solanum lycopersicum L.)
Summary
Tomatfrøet er en viktig modell for å studere genetikk og utviklingsbiologi under plantereproduksjon. Denne protokollen er nyttig for å rydde tomatfrø på ulike utviklingsstadier for å observere den finere embryonale strukturen.
Abstract
Tomat (Solanum lycopersicum L.) er en av de store kontantavlingene over hele verden. Tomatfrøet er en viktig modell for å studere genetikk og utviklingsbiologi under plantereproduksjon. Visualisering av finere embryonal struktur i et tomatfrø hindres ofte av frøbeleggslim, flercellelags integument og en tykkvegget endosperm, som må løses ved arbeidskrevende innebygging. Et enklere alternativ er å bruke vevsryddingsteknikker som gjør frøet nesten gjennomsiktig ved hjelp av kjemiske midler. Selv om konvensjonelle ryddeprosedyrer gir dyp innsikt i mindre frø med tynnere frøbelegg, fortsetter rydding av tomatfrø å være teknisk utfordrende, spesielt i de sene utviklingsstadiene.
Presentert her er en rask og arbeidsbesparende clearingprotokoll for å observere tomatfrøutvikling fra 3 til 23 dager etter blomstring når embryonal morfologi er nesten fullført. Denne metoden kombinerer klorhydratbasert clearingløsning som er mye brukt i Arabidopsis med andre modifikasjoner, inkludert utelatelse av formalin-aceto-alkohol (FAA) fiksering, tilsetning av natriumhypoklorittbehandling av frø, fjerning av myknet frøbeleggslim og vasking og vakuumbehandling. Denne metoden kan brukes til effektiv rydding av tomatfrø i forskjellige utviklingsstadier og er nyttig i full overvåking av utviklingsprosessen av mutantfrø med god romlig oppløsning. Denne clearingprotokollen kan også brukes på dyp avbildning av andre kommersielt viktige arter i Solanaceae.
Introduction
Tomat (S. lycopersicum L.) er en av de viktigste vegetabilske avlingene rundt om i verden, med en produksjon på 186,8 millioner tonn kjøttfulle frukter fra 5,1 millioner hektar i 20201. Den tilhører den store Solanaceae-familien med ca 2,716 arter2, inkludert mange kommersielt viktige avlinger som aubergine, paprika, potet og tobakk. Den kultiverte tomaten er en diploid art (2n = 2x = 24) med en genomstørrelse på ca. 900 Mb3. I lang tid har det blitt gjort store anstrengelser mot tomatdomestisering og avl ved å velge ønskelige egenskaper fra vill Solanum spp. Det er over 5000 tomattilganger oppført i Tomato Genetics Resource Center, og mer enn 80.000 bakterieplasma av tomater lagres over hele verden4. Tomatplanten er flerårig i drivhuset og forplantes av frø. Et modent tomatfrø består av tre hovedrom: et fullvoksent embryo, gjenværende endosperm av cellulær type og et hardt frøbelegg 5,6 (figur 1A). Etter dobbel befruktning går utviklingen av cellulær endosperm foran utviklingen av zygoter. Ved ~ 5-6 dager etter blomstring (DAF) observeres tocellet proembryo først når endospermen består av seks til åtte kjerner7. I Solanum pimpinellifolium nærmer embryoet seg sin endelige størrelse etter 20 DAF, og frø er levedyktige for spiring etter 32 DAF8. Etter hvert som embryoet utvikler seg, absorberes endospermen gradvis, og bare en liten mengde endosperm forblir i frøet. Den gjenværende endospermen består av mikropylær endosperm som omgir radikelspissen, og lateral endosperm i resten av frøet 9,10. Den ytre frøbelegget er utviklet fra fortykket og lignifisert ytre epidermis av integumentet, og med de døde lagene av integumentrester danner de et hardt skall for å beskytte embryoet og endospermen5.
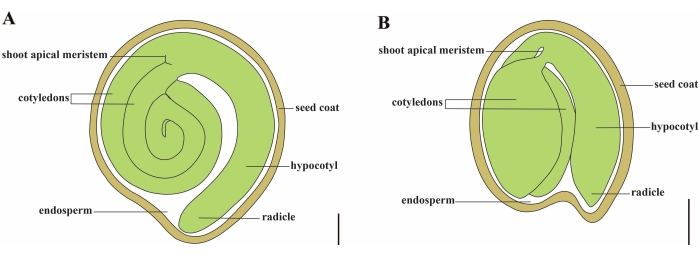
Figur 1: Skjematisk fremstilling av et modent frø i Solanum lycopersicum og Arabidopsis thaliana. (A) Langsgående anatomi av et modent tomatfrø. (B) Langsgående anatomi av et modent Arabidopsis-frø. Et modent tomatfrø er omtrent 70 ganger større i størrelse enn et Arabidopsis-frø. Skala barer = (A) 400 μm, (B) 100 μm. Vennligst klikk her for å se en større versjon av dette tallet.
Produksjon av tomatfrø av høy kvalitet avhenger av koordineringen mellom embryoet, endospermen og morsfrøkomponentene11. Dissekering av viktige gener og nettverk i frøutvikling krever en dyp og fullsporet fenotypisk registrering av mutante frø. Konvensjonelle innebyggingsteknikker, som den halvtynne delen og parafinseksjonen, brukes mye på tomatfrø for å observere de lokale og finere strukturene til embryoet12,13,14,15. Imidlertid er det vanligvis arbeidskrevende å analysere frøutviklingen fra tynne seksjoner og mangler romlig oppløsning på z-aksen. Til sammenligning er vevsrydding en rask og effektiv metode for å finne utviklingsstadiet av embryodefekter som mest sannsynlig vil oppstå16. Clearingmetoden reduserer ugjennomsiktigheten av indre vev ved å homogenisere brytningsindeksen med ett eller flere biokjemiske midler16. Hele vevsrydding tillater observasjon av en plantevevstruktur uten å ødelegge integriteten, og kombinasjonen av clearingteknologi og tredimensjonal avbildning har blitt en ideell løsning for å få informasjon om morfologien og utviklingstilstanden til et planteorgan17,18. Gjennom årene har frøryddingsteknikker blitt brukt i forskjellige plantearter, inkludert Arabidopsis thaliana, Hordeum vulgare og Beta vulgaris 19,20,21,22,23. Blant disse har hele eggløsningsryddingsteknologien vært en effektiv tilnærming til å studere frøutvikling av Arabidopsis, på grunn av sin lille størrelse, 4-5 lag av frøbeleggcellen og endospermen av kjernetypen24,25. Med kontinuerlig oppdatering av forskjellige clearingblandinger, for eksempel fremveksten av Hoyers løsning26, ble indre strukturer av byggeggløsningen avbildet med høy grad av klarhet, selv om endospermen utgjør hoveddelen av frøene. Embryogenese av sukkerroer kan observeres ved rydding kombinert med vakuumbehandling og mykning med saltsyre19. Ikke desto mindre, i motsetning til artene nevnt ovenfor, har embryologiske observasjoner ved å rydde protokoller i tomatfrø ikke blitt rapportert. Dette forhindrer detaljert undersøkelse av embryonal og frøutvikling av tomater.
Kloralhydrat brukes ofte som en clearingløsning som gjør at nedsenket vev og celler kan vises på forskjellige optiske plan, og bevarer cellene eller vevskomponentene vesentlig27,28,29. Kloralhydratbasert clearingprotokoll har blitt brukt til helmontering av frø for å observere embryo og endosperm av Arabidopsis21,28. Denne clearingløsningen er imidlertid ikke effektiv når det gjelder å rydde tomatfrø, som er mer ugjennomtrengelige enn Arabidopsisfrø. De fysiske barrierene inkluderer: (1) tomatintegumentet har nesten 20 cellelag ved 3 til 15 DAF 30,31, (2) tomatendospermen er cellulær type, ikke nukleær-type32, og (3) tomatfrø er omtrent 70 ganger større i størrelse33,34 og (4) produserer store mengder frøbelegg, som blokkerer penetrasjonen av clearingreagenser og påvirker visualiseringen av embryoceller.
Derfor presenterer denne rapporten en optimalisert kloralhydratbasert clearingmetode for helmontering av tomatfrø på forskjellige stadier, noe som muliggjør dyp avbildning av embryoutviklingsprosessen (figur 2).
Protocol
Representative Results
Discussion
Sammenlignet med mekanisk seksjonering er clearingteknologien mer fordelaktig for tredimensjonal avbildning, da den beholder integriteten til plantevev eller organer16. Konvensjonelle clearingprotokoller er ofte begrenset til små prøver på grunn av lettere penetrasjon av kjemiske løsninger. Tomatfrø er en problematisk prøve for vevsrydding fordi den er omtrent 70 ganger større enn et Arabidopsis-frø i størrelse og har flere permeabilitetsbarrierer. Arabidopsis frøbelegg…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Forfatterne er takknemlige for Dr. Jie Le og Dr. Xiufen Song for deres nyttige forslag til henholdsvis differensiell interferenskontrastmikroskopi og konvensjonell clearingmetode. Denne forskningen ble finansiert av National Natural Science Foundation of China (31870299) og Youth Innovation Promotion Association of the Chinese Academy of Sciences. Figur 2 ble opprettet med BioRender.com.
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
Riferimenti
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetica. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

