تطبيق AlDeSense لتقسيم خلايا سرطان المبيض إلى طبقات على أساس نشاط ألدهيد ديهيدروجينيز 1A1
Summary
تعد طرق قياس نشاط ALDH1A1 في الخلايا الحية أمرا بالغ الأهمية في أبحاث السرطان نظرا لوضعها كعلامة حيوية للجذع. في هذه الدراسة ، استخدمنا مسبارا فلوروجينيا انتقائيا للشكل لتحديد المستويات النسبية لنشاط ALDH1A1 في لوحة من خمسة خطوط خلايا سرطان المبيض.
Abstract
غالبا ما يعزى الانتكاس بعد علاج السرطان إلى استمرار مجموعة فرعية من الخلايا السرطانية المعروفة باسم الخلايا الجذعية السرطانية (CSCs) ، والتي تتميز بقدرتها الرائعة على بدء الورم وتجديده ذاتيا. اعتمادا على أصل الورم (على سبيل المثال ، المبايض) ، يمكن أن يختلف ملف تعريف العلامات الحيوية لسطح CSC بشكل كبير ، مما يجعل تحديد هذه الخلايا عن طريق تلطيخ المواد الكيميائية المناعية مسعى صعبا. على العكس من ذلك ، برز ألدهيد ديهيدروجيناز 1A1 (ALDH1A1) كعلامة ممتازة لتحديد الخلايا الجذعية السرطانية ، نظرا لملف تعريف التعبير المحفوظ في جميع الخلايا السلفية تقريبا بما في ذلك الخلايا الجذعية السرطانية. ينتمي الشكل المتماثل ALDH1A1 إلى عائلة فائقة من 19 إنزيما مسؤولة عن أكسدة مختلف الألدهيدات الداخلية و xenobiotic إلى منتجات حمض الكربوكسيل المقابلة. قام Chan et al. مؤخرا بتطوير AlDeSense ، وهو مسبار “تشغيل” انتقائي للشكل للكشف عن نشاط ALDH1A1 ، بالإضافة إلى كاشف تحكم مطابق غير تفاعلي (Ctrl-AlDeSense) لحساب التلوين خارج الهدف. وقد ثبت بالفعل أن هذه الأداة الانتقائية للشكل الأيزوفورم هي أداة كيميائية متعددة الاستخدامات من خلال الكشف عن نشاط ALDH1A1 في خلايا ابيضاض الدم النقوي K562 ، والغلاف الثديي ، والطعوم الخارجية CSC المشتقة من سرطان الجلد. في هذه المقالة ، تم عرض فائدة المسبار من خلال القياس الفلوري الإضافي ، والفحص المجهري متحد البؤر ، وتجارب قياس التدفق الخلوي حيث تم تحديد نشاط ALDH1A1 النسبي في لوحة من خمسة خطوط خلايا سرطان المبيض.
Introduction
الخلايا الجذعية السرطانية (CSCs) هي مجموعة فرعية من الخلايا السرطانية التي تظهر خصائص تشبه الخلايا الجذعية1. على غرار نظيراتها غير السرطانية ، تمتلك CSCs قدرة غير عادية على التجديد الذاتي والتكاثر. جنبا إلى جنب مع الآليات المدمجة الأخرى ، مثل تنظيم ناقلات الكاسيت المرتبطة ب ATP ، غالبا ما يتم تجنيب الخلايا الجذعية السرطانية من جهود إزالة الانتفاخ الجراحية الأولية ، بالإضافة إلى العلاج المساعداللاحق 2. نظرا لدورها الحاسم في مقاومة العلاج3 ، والانتكاس4 ، وورم خبيث5 ، أصبحت الخلايا الجذعية السرطانية أولوية في أبحاث السرطان. على الرغم من وجود مجموعة متنوعة من مستضدات سطح الخلية (على سبيل المثال ، CD133) التي يمكن استخدامها لتحديد CSCs6 ، إلا أن الاستفادة من النشاط الأنزيمي لنازعة هيدروجين الألدهيد (ALDHs) الموجودة في السيتوبلازم قد ظهرت كبديل جذاب7. ALDHs هي عائلة فائقة من 19 إنزيما مسؤولا عن تحفيز أكسدة الألدهيدات الداخلية والغريبة المنشأ التفاعلية مع منتجات حمض الكربوكسيل المقابلة8.
بشكل عام ، تعد إزالة سموم الألدهيد أمرا بالغ الأهمية في حماية الخلايا من أحداث التشابك غير المرغوب فيها والإجهاد التأكسدي الذي قد يضر بسلامة الخلايا الجذعية9. علاوة على ذلك ، يتحكم الشكل الإيزوفورم 1A1 في استقلاب حمض الريتينويك ، والذي بدوره يؤثر على الجذع عبر إشارات ريتينالديهيد10. تم مؤخرا تطوير AlDeSense 11,12 ، وهو مسبار استشعار قائم على نشاط جزيء صغير (ABS) للكشف بشكل انتقائي عن نشاط ALDH1A1. تحقق تصميمات ABS الكشف عن التحليل من خلال تغيير كيميائي بدلا من حدث ملزم ، مما يسمح بانتقائية عالية وتقليل الاستجابات خارج الهدف13،14،15،16. يعتمد مبدأ تصميم المسبار الفلوري الانتقائي للشكل المتماثل على آلية تبريد نقل الإلكترون المستحث ضوئيا (d-PeT)17 ، والتي تنشأ من المجموعة الوظيفية للألدهيد ، والتي تعمل على قمع التوقيع الفلوري للمسبار18. عند التحويل بوساطة ALDH1A1 إلى الحمض الكربوكسيلي ، يتم فتح الانحلال الإشعاعي لإنتاج منتج شديد الفلورسنت. نظرا لأن التبريد d-PeT ليس فعالا بنسبة 100٪ أبدا ، فقد تم النظر في التألق المتبقي الذي قد يؤدي إلى نتائج إيجابية خاطئة محتملة عند إنشاء هذا الفحص من خلال تطوير Ctrl-AlDeSense ، وهو كاشف غير مستجيب له خصائص فيزيائية ضوئية مطابقة (على سبيل المثال ، العائد الكمومي) ونمط تلطيخ سيتوبلازمي متطابق في الخلايا. عند استخدامه جنبا إلى جنب ، يمكن لهذا الاقتران الفريد أن يميز بشكل موثوق الخلايا ذات النشاط العالي ALDH1A1 عن تلك التي تظهر مستويات منخفضة عن طريق القياس الفلوري والتصوير الجزيئي وقياس التدفق الخلوي. ترتبط العديد من المزايا الرئيسية باستخدام الأصباغ القابلة للتنشيط الانتقائية للأشكال على الطرق الكيميائية المناعية التقليدية. على سبيل المثال ، يفترض أن تكون الخلايا الجذعية السرطانية مدفونة بعمق داخل الورم ، وبالتالي يمكن الوصول إليها بشكل أكبر لجزيء صغير بالنسبة للأجسام المضادة الكبيرة19. بالإضافة إلى ذلك ، لا يقوم منتج الفلورسنت المقلوب بتعديل أي مكون خلوي تساهميا ، مما يعني أنه يمكن إزالته بسهولة عبر دورات الغسيل لترك CSC في حالة غير معدلة. أخيرا ، تحدد استجابة التشغيل فقط الخلايا والوظائف القابلة للحياة ، مثل الكثير من مقايسة MTT ، نظرا لاعتمادها على العامل المساعد NAD +.
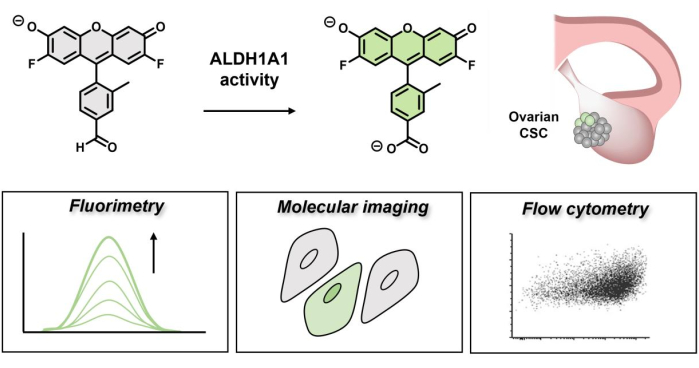
الشكل 1: تخطيطي يوضح تشغيل الفلورسنت ل AlDeSense. يتم تنشيط الصبغة الانتقائية للشكل الثابت بواسطة ALDH1A1 ويمكن استخدامها لتحديد نشاط ALDH1A1 المرتفع في خلايا سرطان المبيض عن طريق القياس الفلوري والتصوير الجزيئي وقياس التدفق الخلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
في العمل السابق ، نجح فحص المسبار الفلوري الانتقائي للشكل المتماثل في تقسيم خلايا ALDH العالية (ALDH +) إلى طبقات من خلايا ALDH المنخفضة (ALDH-) في خلايا سرطان الدم المزمن البشرية K562 ، وخلايا سرطان الثدي البشرية MDA-MB-231 ، وخلايا سرطان الجلد B16F0 الفئران. هذا مهم لأنه بالنسبة للعديد من أنواع السرطان ، يشير التعبير البروتيني المرتفع ALDH1A1 إلى أسوأ المراجعالسريرية 20. هذا يفترض أن المستويات المرتفعة من ALDH1A1 تدل على الخلايا الجذعية السرطانية التي يمكن أن تتهرب من العلاج ، وتطور المقاومة ، وتنتشر في جميع أنحاء الجسم. ومع ذلك ، في حالة سرطان المبيض ، هناك دراسات تشير إلى نتيجة معاكسة (يرتبط تعبير ALDH1A1 المرتفع بتحسين بقاء المريض)21،22،23،24. في حين أن هذا قد يبدو متناقضا للوهلة الأولى ، إلا أن التعبير لا يرتبط بالضرورة بنشاط الإنزيم ، والذي قد يتأثر بالتغيرات في البيئة الدقيقة للورم (على سبيل المثال ، تدفق الأس الهيدروجيني ، وتدرجات الأكسجين) ، وتوافر العامل المساعد NAD + أو ركائز الألدهيد ، ومستويات الأحماض الكربوكسيلية (تثبيط المنتج) ، والتعديلات اللاحقة للترجمة التي يمكن أن تغير نشاط الإنزيم25 . بالإضافة إلى ذلك ، ينقسم سرطان المبيض إلى خمسة أنواع نسيجية رئيسية (مصلية عالية الدرجة ، مصلية منخفضة الدرجة ، بطانة الرحم ، خلية صافية ، ومخاطية) ، والتي نفترض أنها ستتميز بمستويات متغيرة من نشاط ALDH1A126. بهدف التحقيق في نشاط ALDH1A1 في أورام المبيض ، تم استخدام مقايسة مسبار فلوروجيني انتقائي للشكل لتحديد مجموعات ALDH1A1 + في لوحة من خمسة خطوط خلايا سرطان المبيض تنتمي إلى الأنواع النسيجية المختلفة المذكورة أعلاه. تشمل خطوط الخلايا التي تم اختبارها في هذه الدراسة خلايا BG-1 و Caov-3 و IGROV-1 و OVCAR-3 و PEO4 ، والتي تغطي الخلايا الصافية والأنماط النسيجية المصلية. هنا ، تم تسليط الضوء على تنوع وقابلية تعميم المسبار لتحديد الخلايا الجذعية السرطانية للباحثين الذين يسعون إلى إجراء دراسات مماثلة في خطوط الخلايا السرطانية الخالدة الأخرى وكذلك عينات المرضى. سيلقي استخدام AlDeSense الضوء على المسارات الكيميائية الحيوية المشاركة في صيانة CSC في البيئات الدقيقة المعقدة للأنسجة ويحتمل أن يكون بمثابة أداة سريرية لتحديد التشخيص وقياس عدوانية السرطان.
Protocol
Representative Results
Discussion
الانتقائية الشاملة هي قيد رئيسي للعديد من تحقيقات ALDH. ومع ذلك ، فقد تم الإبلاغ مؤخرا عن العديد من الأمثلة الانتقائية للأشكالالمتماثلة 32،33،34،35،36،37،38،39،40</su…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة (R35GM133581 إلى JC) ومركز السرطان في منحة الدراسات العليا في إلينوي (الممنوحة ل SG). تشكر JC مؤسسة Camille and Henry Dreyfus على الدعم. يشكر المؤلفون الدكتور توماس إي بيرود على مساهمته الأولية في إعداد مخزون AlDeSense و AlDeSense AM. بيشاردو بيغيرو والسيد جوزيف أ. فورزانو على مساعدتهما في إعداد مختلف السلائف الاصطناعية. نشكر البروفيسور إريك نيلسون (قسم علم وظائف الأعضاء الجزيئي والتكاملي ، UIUC) لخلايا Caov-3 و IGROV-1 و PEO4. نشكر البروفيسور بول هيرجنروثر (قسم الكيمياء ، UIUC) على خلايا BG-1. نشكر المرافق الأساسية في معهد Carl R. Woese لعلم الأحياء الجينومي للوصول إلى مجهر Zeiss LSM 700 Confocal والبرامج المقابلة. نشكر مرفق قياس التدفق الخلوي للوصول إلى BD LSR II CMtO Analyzer. نشكر الدكتورة ساندرا ماكماسترز ومرفق وسائط الخلية على المساعدة في إعداد وسائط زراعة الخلايا.
Materials
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
Riferimenti
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362 (2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142 (2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277 (2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502 (2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662 (2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).

