Fenotypische profilering van dopaminerge neuronen in de middenhersenen van menselijke stamcellen
Summary
Dit protocol beschrijft de celkweek van dopaminerge neuronen in de middenhersenen, gevolgd door immunologische kleuring en het genereren van neuronale fenotypische profielen op basis van verworven microscopisch kleine beelden met een hoog gehalte die de identificatie van fenotypische variaties als gevolg van genetische of chemische modulaties mogelijk maken.
Abstract
De ziekte van Parkinson (PD) is gekoppeld aan een reeks celbiologische processen die dopaminerge (mDA) neuronenverlies in de middenhersenen veroorzaken. Veel van de huidige in vitro PD-cellulaire modellen missen complexiteit en houden geen rekening met meerdere fenotypes. Fenotypische profilering in humaan geïnduceerde pluripotente stamcellen (iPSC)-afgeleide mDA-neuronen kan deze tekortkomingen aanpakken door tegelijkertijd een reeks neuronale fenotypes in een PD-relevant celtype parallel te meten. Hier beschrijven we een protocol voor het verkrijgen en analyseren van fenotypische profielen van in de handel verkrijgbare menselijke mDA-neuronen. Een neuronspecifiek fluorescerend kleuringspaneel wordt gebruikt om de nucleaire, α-synucleïne, tyrosinehydroxylase (TH) en microtubuli-geassocieerd proteïne 2 (MAP2) gerelateerde fenotypes te visualiseren. Het beschreven fenotypische profileringsprotocol is schaalbaar omdat het gebruik maakt van platen met 384 putjes, automatische vloeistofverwerking en high-throughput microscopie. Het nut van het protocol wordt geïllustreerd met behulp van gezonde donor mDA-neuronen en mDA-neuronen die de PD-gekoppelde G2019S-mutatie dragen in het Leucine-rijke repeat kinase 2 (LRRK2)-gen. Beide cellijnen werden behandeld met de LRRK2-kinaseremmer PFE-360 en fenotypische veranderingen werden gemeten. Daarnaast laten we zien hoe multidimensionale fenotypische profielen kunnen worden geanalyseerd met behulp van clustering of machine learning-gestuurde gesuperviseerde classificatiemethoden. Het beschreven protocol zal vooral interessant zijn voor onderzoekers die werken aan het modelleren van neuronale ziekten of het bestuderen van effecten van chemische verbindingen in menselijke neuronen.
Introduction
Bij de ziekte van Parkinson (PD) zijn verschillende celbiologische processen verstoord. Mitochondriale disfunctie, oxidatieve stress, eiwitafbraakdefecten, verstoring van vesiculaire handel en endolysosomale functie zijn bijvoorbeeld vaak in verband gebracht met dopaminerge (mDA) neuronenverlies in de middenhersenen, worden vaak waargenomen bij PD1. Daarom lijkt PD meerdere ziektemechanismen te omvatten die met elkaar kunnen interageren en elkaar kunnen verergeren. Een nuttige manier om dit mechanistische samenspel te onderzoeken, is het creëren van een uitgebreide fenotypische vingerafdruk of profiel van dopaminerge (mDA) neuronen in de middenhersenen.
Fenotypische profilering is een benadering waarbij een profiel van een steekproef wordt gemaakt op basis van een verzameling meetbare kenmerken, en ten tweede worden voorspellingen gedaan over een steekproef op basis van dit profiel 2,3. Het doel van profilering is om een breed scala aan kenmerken vast te leggen, waarvan sommige mogelijk niet eerder in verband zijn gebracht met een ziekte of behandeling3. Hierdoor kan profilering onverwachte biologische processen aan het licht brengen. Fenotypische profilering is meestal gebaseerd op fluorescerend gekleurde cellen, en gestandaardiseerde assays, zoals Cell Painting, zijn ontwikkeld om fenotypische profielen te creëren4. Recentelijk is fenotypische profilering bijvoorbeeld toegepast voor de karakterisering van kleine moleculen of de nauwkeurige voorspelling van PD-subtypes uitsluitend op basis van van patiënten afgeleide fibroblasten 5,6. Ondanks deze vooruitgang is fenotypische profilering zelden toegepast op postmitotisch gedifferentieerde cellen, zoals van menselijke geïnduceerde pluripotente stamcellen (iPSC) afgeleide mDA-neuronen die PD-gekoppelde mutaties tot expressie brengen, zoals LRRK2 G2019S. Belangrijke uitdagingen van iPSC-afgeleide modellen zijn onder meer de aanwezigheid van subtiele of variabele pathologische kenmerken in differentiatiebatches of genotypen, en het feit dat geïsoleerde PD-fenotypes niet de volledige complexiteit van de ziekte weergeven. Bovendien, hoewel iPSC-neuronale modellen fysiologisch relevant zijn, worden ze zelden gebruikt in PD-onderzoeksprocessen vanwege zorgen over technische complexiteit 7,8.
We hebben eerder een robuuste methodologie ontwikkeld om meerdere PD-gerelateerde pathofysiologische fenotypes te meten in menselijke mDA-neuronen die zowel gevoelig zijn voor genetische als door chemische verbindingen geïnduceerde fenotypische veranderingen. Dit artikel beschrijft in detail een verder geoptimaliseerde versie van deze methodologie om fenotypische profielen te maken van mDA-neuronen (Figuur 1). Dit protocol heeft verschillende voordelen ten opzichte van de eerder beschreven fenotypische profileringsbenaderingen, zoals het gebruik van hoogwaardige mDA-neuronen en technische reproduceerbaarheid. Voor het eerst maakt dit protocol fenotypische profilering mogelijk in fysiologisch relevante post-mitotische mDA-neuronen na chemische verstoringen op een zeer schaalbare manier. Volledig gedifferentieerde en gecryopreserveerde mDA-neuronen zijn in de handel verkrijgbaar, waardoor de differentiatievariabiliteit van batch tot batch aanzienlijk wordt verminderd. Ten tweede kan de technische variabiliteit verder worden verminderd door gebruik te maken van een goed gedefinieerd experimenteel ontwerp (d.w.z. kweekduur of het vermijden van randputten), geautomatiseerde vloeistofbehandeling en geautomatiseerde microscopie. Daarnaast worden hier de eerste stappen van fenotypische profielanalyse met behulp van unsupervised clustering of supervised classificatiebenaderingen beschreven, waarbij wordt aangegeven hoe fenotypische profileringsgegevens kunnen worden geanalyseerd. Dit protocol zal nuttig zijn voor onderzoekers die geïnteresseerd zijn in fenotypische veranderingen van mDA-neuronen geïnduceerd door genetische of chemische verstoringen, met name wanneer een zeer schaalbare onderzoeksopzet vereist is, bijvoorbeeld tijdens screeningcampagnes of wanneer de effecten van een kleiner aantal verbindingen moeten worden bestudeerd, bijvoorbeeld om toxische effecten te bepalen. Samenvattend wordt verwacht dat de toepassing van fenotypische profilering van menselijke neuronen een waardevolle techniek is om complexe ziektegerelateerde fenotypes te bestuderen en de cellulaire effecten van kandidaat-geneesmiddelen te karakteriseren.
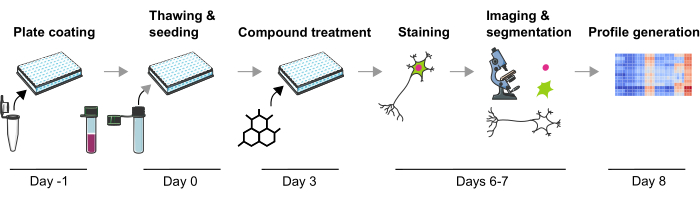
Figuur 1: Schematische weergave van het experimentele protocol voor het genereren van op afbeeldingen gebaseerde fenotypische profielen van menselijke iPSC-afgeleide mDA-neuronen. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Fenotypische profilering is een techniek om een groot aantal fenotypes in cellen te meten door fluorescerende kleuringen, microscopie en beeldanalyse toe te passen. Fenotypische profielen kunnen worden verkregen en vergeleken tussen cellijnen of andere experimentele omstandigheden om complexe veranderingen in de celbiologie te begrijpen die onopgemerkt kunnen blijven bij het gebruik van een enkele uitlezing. Hier beschrijven we de toepassing van fenotypische profilering op menselijke iPSC-afgeleid…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
De auteurs willen alle collega’s bij Ksilink bedanken voor hun waardevolle hulp en discussies die hebben geleid tot het ontwerp van het gepresenteerde protocol.
Materials
| Anti- chicken – Alexa 647 | Jackson ImmunoRearch | 703-605-155 | Immunofluorescence |
| Anaconda | https://www.anaconda.com/download | ||
| Anti-Map2 | Novus | NB300-213 | Immunofluorescence |
| Anti-mouse – Alexa 488 | Thermo Fisher | A11001 | Immunofluorescence |
| Anti-rabbit – Alexa 555 | Thermo Fisher | A21429 | Immunofluorescence |
| Anti-Tyrosine Hydroxylase | Merck | T2928 | Immunofluorescence |
| Anti-α-synuclein | Abcam | 138501 | Immunofluorescence |
| Bravo Automated Liquid Handling Platform with 384ST head | Agilent | If no liquid handler is available, the use of an electronic multichannel pipette is recommended. | |
| Confocal microscope | Yokogawa | CV7000 | The use of an automated confocal fluorescence microscope is recommended to ensure image quality consistency. |
| Countess Automated cell counter | Invitrogen | Cell counting before seeding. Can also be done using a manual counting chamber. | |
| DPBS +/+ | Gibco | 14040-133 | Buffer for washing |
| EL406 Washer Dispenser | BioTek (Agilent) | If no liquid handler is available, the use of an electronic multichannel pipette is recommended. | |
| Formaldehyde Solution (PFA 16 %) | Euromedex | EM-15710-S | Fixation before staining |
| Hoechst 33342 | Invitrogen | H3570 | Nuclear staining |
| iCell Base Medium 1 | Fujifilm | M1010 | Base medium for neurons |
| iCell DPN, Donor#01279, Phenotype AHN, lot#106339, 1M | Fujifilm | C1087 | Apparently healthy donor |
| iCell DPN, Donor#11299, Phenotype LRRK2 G2019S, phenotype PD lot#106139 | Fujifilm | C1149 | Donor carrying LRRK2 G2019S mutation |
| iCell Nervous System Supplement | Fujifilm | M1031 | Supplement for base medium |
| iCell Neural Supplement B | Fujifilm | M1029 | Supplement for base medium |
| Jupyter Python Notebook | In-house development | https://github.com/Ksilink/Notebooks/tree/main/Neuro/DopaNeuronProfiling | Notebook to perform phenotypic profile visualization and classification from raw data. |
| Laminin | Biolamina | LN521 | Plate coating |
| PFE-360 | MedChemExpress | HY-120085 | LRRK2 kinase inhibitor |
| PhenoLink | In-house development | https://github.com/Ksilink/PhenoLink | Software for image analysis |
| PhenoPlate 384w, PDL coated | Perkin Elmer | 6057500 | Pre-coated plate for cell culture and imaging. This plate allows imaging of all wells using all objectives of the Yokogawa CV7000 microscope. |
| Storage plates Abgene 120 µL | Thermo Scientific | AB-0781 | Necessary for compound dispensing using the Vprep pipetting system. If not available, the use of an electronic multichannel pipette is recommended. |
| Triton | Sigma | T9284 | Permeabilization before lysis |
| Trypan Blue | Sigma | T8154-20ML | Determination of living cells |
| Vprep Pipetting System | Agilent | Medium change and compound dispensing. Alternatively, an electronic multichannel pipette can be used. |
Riferimenti
- Panicker, N., Ge, P., Dawson, V. L., Dawson, T. M. The cell biology of Parkinson’s disease. The Journal of Cell Biology. 220 (4), 202012095 (2021).
- Caicedo, J. C., et al. Data-analysis strategies for image-based cell profiling. Nature Methods. 14 (9), 849-863 (2017).
- Chandrasekaran, S. N., Ceulemans, H., Boyd, J. D., Carpenter, A. E. Image-based profiling for drug discovery: due for a machine-learning upgrade. Nature Reviews Drug Discovery. 20 (2), 145-159 (2021).
- Bray, M. -. A., et al. Cell Painting, a high-content image-based assay for morphological profiling using multiplexed fluorescent dyes. Nature Protocols. 11 (9), 1757-1774 (2016).
- Schiff, L., et al. Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts. Nature Communications. 13 (1), 1590 (2022).
- Ziegler, S., Sievers, S., Waldmann, H. Morphological profiling of small molecules. Cell Chemical Biology. 28 (3), 300-319 (2021).
- Cobb, M. M., Ravisankar, A., Skibinski, G., Finkbeiner, S. iPS cells in the study of PD molecular pathogenesis. Cell and Tissue Research. 373 (1), 61-77 (2018).
- Elitt, M. S., Barbar, L., Tesar, P. J. Drug screening for human genetic diseases using iPSC models. Human Molecular Genetics. 27 (R2), 89-98 (2018).
- Vuidel, A., et al. High-content phenotyping of Parkinson’s disease patient stem cell-derived midbrain dopaminergic neurons using machine learning classification. Stem Cell Reports. 17 (10), 2349-2364 (2022).
- Stirling, D. R., Swain-Bowden, M. J., Lucas, A. M., Carpenter, A. E., Cimini, B. A., Goodman, A. CellProfiler 4: improvements in speed, utility and usability. BMC Bioinformatics. 22 (1), 433 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Sofroniew, N., et al. . napari: a multi-dimensional image viewer for Python. , (2022).
- Berthold, M. R., et al. KNIME: The Konstanz Information Miner. Data Analysis, Machine Learning and Applications. , 319-326 (2008).
- Fathi, A., et al. Diverging Parkinson’s Disease Pathology between patient-derived GBAN370S, LRRK2G2019S and engineered SNCAA53T iPSC-derived Dopaminergic Neurons. bioRxiv. , (2023).
- Wang, Y., Huang, H., Rudin, C., Shaposhnik, Y. Understanding How Dimension Reduction Tools Work: An Empirical Approach to Deciphering t-SNE, UMAP, TriMap, and PaCMAP for Data Visualization. Journal of Machine Learning Research. 22 (201), 1-73 (2021).
- Ke, G., et al. LightGBM: A highly efficient gradient boosting decision tree. Advances in Neural Information Processing Systems. 30, (2017).
- Avazzadeh, S., Baena, J. M., Keighron, C., Feller-Sanchez, Y., Quinlan, L. R. Modelling Parkinson’s Disease: iPSCs towards Better Understanding of Human Pathology. Brain Sciences. 11 (3), 373 (2021).
- Sánchez-Danés, A., et al. Disease-specific phenotypes in dopamine neurons from human iPS-based models of genetic and sporadic Parkinson’s disease. EMBO Molecular Medicine. 4 (5), 380-395 (2012).
- Oosterveen, T., et al. Pluripotent stem cell derived dopaminergic subpopulations model the selective neuron degeneration in Parkinson’s disease. Stem Cell Reports. 16 (11), 2718-2735 (2021).
- Hughes, R. E., et al. Multiparametric high-content cell painting identifies copper ionophores as selective modulators of esophageal cancer phenotypes. ACS Chemical Biology. 17 (7), 1876-1889 (2022).
- Akbarzadeh, M., et al. Morphological profiling by means of the Cell Painting assay enables identification of tubulin-targeting compounds. Cell Chemical Biology. 29 (6), 1053-1064 (2022).
- Schiff, L., et al. Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts. Nature Communications. 13 (1), 1590 (2022).
- Way, G. P., et al. Morphology and gene expression profiling provide complementary information for mapping cell state. Cell Systems. 13 (11), 911-923 (2022).
- Feng, Y., Mitchison, T. J., Bender, A., Young, D. W., Tallarico, J. A. Multi-parameter phenotypic profiling: using cellular effects to characterize small-molecule compounds. Nature Reviews Drug Discovery. 8 (7), 567-578 (2009).
- Antonov, S. A., Novosadova, E. V. Current state-of-the-art and unresolved problems in using human induced pluripotent stem cell-derived dopamine neurons for parkinson’s disease drug development. International Journal of Molecular Sciences. 22 (7), 3381 (2021).
- Miller, J. D., et al. Human iPSC-based modeling of late-onset disease via progerin-induced aging. Cell Stem Cell. 13 (6), 691-705 (2013).
- Bezard, E., Gross, C. E., Brotchie, J. M. Presymptomatic compensation in Parkinson’s disease is not dopamine-mediated. Trends in Neurosciences. 26 (4), 215-221 (2003).
- Wu, Y., Le, W., Jankovic, J. Preclinical Biomarkers of parkinson disease. Archives of Neurology. 68 (1), 22-30 (2011).
- Verstraelen, P., et al. Systematic quantification of synapses in primary neuronal culture. iScience. 23 (9), 101542 (2020).
- Liu-Yesucevitz, L., et al. ALS-Linked mutations enlarge TDP-43-enriched neuronal RNA granules in the dendritic arbor. The Journal of Neuroscience. 34 (12), 4167-4174 (2014).

