פרופיל פנוטיפי של נוירונים דופמינרגיים שמקורם בתאי גזע אנושיים במוח התיכון
Summary
פרוטוקול זה מתאר את תרבית התאים של נוירונים דופמינרגיים במוח התיכון האנושי, ולאחר מכן צביעה אימונולוגית ויצירת פרופילים פנוטיפיים עצביים מתמונות מיקרוסקופיות שנרכשו בתוכן גבוה ומאפשרים זיהוי של וריאציות פנוטיפיות עקב מודולציות גנטיות או כימיות.
Abstract
מחלת פרקינסון (PD) קשורה למגוון תהליכים ביולוגיים של התא הגורמים לאובדן נוירונים דופמינרגיים במוח התיכון (MDA). מודלים תאיים רבים של PD במבחנה חסרים מורכבות ואינם לוקחים בחשבון פנוטיפים מרובים. פרופיל פנוטיפי בתאי עצב mDA שמקורם בתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSC) יכול לטפל בחסרונות אלה על ידי מדידה בו זמנית של מגוון פנוטיפים עצביים בסוג תא רלוונטי למחלת פרקינסון במקביל. במאמר זה אנו מתארים פרוטוקול להשגה וניתוח של פרופילים פנוטיפיים מנוירוני mDA אנושיים הזמינים באופן מסחרי. פאנל צביעה פלואורסצנטי ספציפי לנוירון משמש להמחשת הפנוטיפים הקשורים לגרעין, α-סינוקלאין, טירוזין הידרוקסילאז (TH) וחלבון הקשור למיקרוטובול 2 (MAP2). פרוטוקול הפרופיל הפנוטיפי המתואר ניתן להרחבה מכיוון שהוא משתמש בלוחות 384 בארות, טיפול אוטומטי בנוזלים ומיקרוסקופ בתפוקה גבוהה. התועלת של הפרוטוקול מודגמת באמצעות נוירונים mDA מתורם בריא ונוירוני mDA הנושאים את מוטציית G2019S המקושרת ל- PD בגן קינאז חוזר עשיר בלאוצין 2 (LRRK2). שני קווי התאים טופלו במעכב קינאז LRRK2 PFE-360 ונמדדו שינויים פנוטיפיים. בנוסף, אנו מדגימים כיצד ניתן לנתח פרופילים פנוטיפיים רב-ממדיים באמצעות אשכולות או שיטות סיווג מונחות למידת מכונה. הפרוטוקול המתואר יעניין במיוחד חוקרים העובדים על מודלים של מחלות עצביות או חוקרים השפעות כימיות של תרכובות בתאי עצב אנושיים.
Introduction
מגוון תהליכים ביולוגיים של התא מופרעים במחלת פרקינסון (PD). לדוגמה, תפקוד לקוי של המיטוכונדריה, עקה חמצונית, פגמים בפירוק חלבונים, הפרעה בסחר שלפוחית השתן ותפקוד אנדוליזוזומלי נקשרו לאובדן נוירונים דופמינרגיים במוח התיכון (mDA), נצפו בדרך כלל במחלת פרקינסון1. לכן, נראה כי פרקינסון מערבת מנגנוני מחלה מרובים שיכולים לתקשר זה עם זה ולהחמיר זה את זה. דרך שימושית אחת לחקור את יחסי הגומלין המכניסטיים האלה היא יצירת טביעת אצבע פנוטיפית מקיפה או פרופיל של נוירונים דופמינרגיים במוח התיכון (mDA).
פרופיל פנוטיפי הוא גישה הכוללת יצירת פרופיל של מדגם המבוסס על אוסף של מאפיינים מדידים, ושנית, היא כוללת ביצוע תחזיות לגבי מדגם המבוסס על פרופיל זה 2,3. מטרת יצירת הפרופילים היא ללכוד מגוון רחב של תכונות, שחלקן אולי לא היו קשורות בעבר למחלה או לטיפול3. כתוצאה מכך, פרופיל יכול לחשוף תהליכים ביולוגיים בלתי צפויים. פרופיל פנוטיפי מסתמך בדרך כלל על תאים מוכתמים פלואורסצנטית, ובדיקות סטנדרטיות, כגון צביעת תאים, פותחו ליצירת פרופילים פנוטיפיים4. לאחרונה, פרופיל פנוטיפי יושם, למשל, עבור אפיון של מולקולות קטנות או חיזוי מדויק של תת-סוגים של PD אך ורק על סמך פיברובלסטיםשמקורם במטופל 5,6. למרות התקדמות זו, פרופיל פנוטיפי כמעט ולא יושם על תאים ממוינים פוסט-מיטוטיים, כגון תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSC) שמקורם בתאי עצב mDA המבטאים מוטציות הקשורות לפרקינסון כגון LRRK2 G2019S. אתגרים משמעותיים של מודלים שמקורם ב-iPSC כוללים את נוכחותם של מאפיינים פתולוגיים עדינים או משתנים על פני קבוצות התמיינות או גנוטיפים, והעובדה שפנוטיפים מבודדים של פרקינסון אינם לוכדים את מלוא המורכבות של המחלה. יתר על כן, בעוד מודלים עצביים iPSC רלוונטיים מבחינה פיזיולוגית, הם משמשים לעתים רחוקות בתהליכי גילוי תרופות PD בשל חששות לגבי מורכבות טכנית 7,8.
בעבר פיתחנו מתודולוגיה חזקה למדידת פנוטיפים פתופיזיולוגיים מרובים הקשורים לפרקינסון בנוירוני mDA אנושיים הרגישים הן לשינויים פנוטיפיים גנטיים והן כימיים הנגרמים על ידי תרכובת9. מאמר זה מתאר בפירוט גרסה ממוטבת נוספת של המתודולוגיה הזו ליצירת פרופילים פנוטיפיים מתאי עצב mDA (איור 1). לפרוטוקול זה יש מספר יתרונות על פני גישות הפרופיל הפנוטיפיות שתוארו קודם לכן, כגון שימוש בנוירוני mDA באיכות גבוהה ויכולת שחזור טכנית. לראשונה, פרוטוקול זה מאפשר יצירת פרופיל פנוטיפי בנוירוני mDA פוסט-מיטוטיים רלוונטיים מבחינה פיזיולוגית לאחר הפרעות כימיות באופן מדרגי ביותר. נוירוני mDA ממוינים לחלוטין ושמורים בהקפאה זמינים מסחרית, ומפחיתים באופן משמעותי את שונות ההתמיינות בין אצווה לאצווה. שנית, ניתן לצמצם עוד יותר את השונות הטכנית על ידי שימוש בתכנון ניסויי מוגדר היטב (כלומר, משך תרבית או הימנעות מבארות קצה), טיפול אוטומטי בנוזלים ומיקרוסקופ אוטומטי. בנוסף, השלבים הראשונים של ניתוח פרופיל פנוטיפי באמצעות אשכולות לא מפוקחים או גישות סיווג מפוקחות מתוארים כאן, המציינים כיצד ניתן לנתח נתוני פרופיל פנוטיפי. פרוטוקול זה ישמש חוקרים המעוניינים בשינויים פנוטיפיים של נוירוני mDA הנגרמים על ידי הפרעות גנטיות או כימיות, במיוחד כאשר נדרש מערך מחקר מדרגי מאוד, למשל, במהלך מסעות סינון או כאשר יש לחקור את ההשפעות של מספר קטן יותר של תרכובות, למשל, כדי לקבוע השפעות רעילות. לסיכום, צפוי כי היישום של פרופיל פנוטיפי של נוירונים אנושיים הוא טכניקה רבת ערך לחקר פנוטיפים מורכבים הקשורים למחלות ולאפיין את ההשפעות התאיות של מועמדים לתרופות.
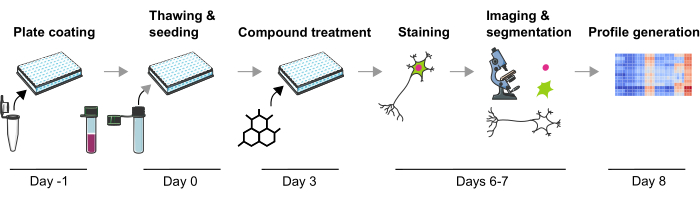
איור 1: תיאור סכמטי של פרוטוקול הניסוי ליצירת פרופילים פנוטיפיים מבוססי תמונה מתאי עצב mDA אנושיים שמקורם בתאי עצב שמקורם בתאי עצב iPSC. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
פרופיל פנוטיפי הוא טכניקה למדידת מספר רב של פנוטיפים בתאים על ידי החלת כתמים פלואורסצנטיים, מיקרוסקופיה וניתוח תמונה3. ניתן לקבל פרופילים פנוטיפיים ולהשוות אותם בין קווי תאים או תנאי ניסוי אחרים כדי להבין שינויים מורכבים בביולוגיה התאית שעשויים להיעלם מעיניהם בעת שימוש בקר?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
המחברים רוצים להודות לכל העמיתים ב-Ksilink על עזרתם רבת הערך והדיונים שהובילו לעיצוב הפרוטוקול המוצג.
Materials
| Anti- chicken – Alexa 647 | Jackson ImmunoRearch | 703-605-155 | Immunofluorescence |
| Anaconda | https://www.anaconda.com/download | ||
| Anti-Map2 | Novus | NB300-213 | Immunofluorescence |
| Anti-mouse – Alexa 488 | Thermo Fisher | A11001 | Immunofluorescence |
| Anti-rabbit – Alexa 555 | Thermo Fisher | A21429 | Immunofluorescence |
| Anti-Tyrosine Hydroxylase | Merck | T2928 | Immunofluorescence |
| Anti-α-synuclein | Abcam | 138501 | Immunofluorescence |
| Bravo Automated Liquid Handling Platform with 384ST head | Agilent | If no liquid handler is available, the use of an electronic multichannel pipette is recommended. | |
| Confocal microscope | Yokogawa | CV7000 | The use of an automated confocal fluorescence microscope is recommended to ensure image quality consistency. |
| Countess Automated cell counter | Invitrogen | Cell counting before seeding. Can also be done using a manual counting chamber. | |
| DPBS +/+ | Gibco | 14040-133 | Buffer for washing |
| EL406 Washer Dispenser | BioTek (Agilent) | If no liquid handler is available, the use of an electronic multichannel pipette is recommended. | |
| Formaldehyde Solution (PFA 16 %) | Euromedex | EM-15710-S | Fixation before staining |
| Hoechst 33342 | Invitrogen | H3570 | Nuclear staining |
| iCell Base Medium 1 | Fujifilm | M1010 | Base medium for neurons |
| iCell DPN, Donor#01279, Phenotype AHN, lot#106339, 1M | Fujifilm | C1087 | Apparently healthy donor |
| iCell DPN, Donor#11299, Phenotype LRRK2 G2019S, phenotype PD lot#106139 | Fujifilm | C1149 | Donor carrying LRRK2 G2019S mutation |
| iCell Nervous System Supplement | Fujifilm | M1031 | Supplement for base medium |
| iCell Neural Supplement B | Fujifilm | M1029 | Supplement for base medium |
| Jupyter Python Notebook | In-house development | https://github.com/Ksilink/Notebooks/tree/main/Neuro/DopaNeuronProfiling | Notebook to perform phenotypic profile visualization and classification from raw data. |
| Laminin | Biolamina | LN521 | Plate coating |
| PFE-360 | MedChemExpress | HY-120085 | LRRK2 kinase inhibitor |
| PhenoLink | In-house development | https://github.com/Ksilink/PhenoLink | Software for image analysis |
| PhenoPlate 384w, PDL coated | Perkin Elmer | 6057500 | Pre-coated plate for cell culture and imaging. This plate allows imaging of all wells using all objectives of the Yokogawa CV7000 microscope. |
| Storage plates Abgene 120 µL | Thermo Scientific | AB-0781 | Necessary for compound dispensing using the Vprep pipetting system. If not available, the use of an electronic multichannel pipette is recommended. |
| Triton | Sigma | T9284 | Permeabilization before lysis |
| Trypan Blue | Sigma | T8154-20ML | Determination of living cells |
| Vprep Pipetting System | Agilent | Medium change and compound dispensing. Alternatively, an electronic multichannel pipette can be used. |
Riferimenti
- Panicker, N., Ge, P., Dawson, V. L., Dawson, T. M. The cell biology of Parkinson’s disease. The Journal of Cell Biology. 220 (4), 202012095 (2021).
- Caicedo, J. C., et al. Data-analysis strategies for image-based cell profiling. Nature Methods. 14 (9), 849-863 (2017).
- Chandrasekaran, S. N., Ceulemans, H., Boyd, J. D., Carpenter, A. E. Image-based profiling for drug discovery: due for a machine-learning upgrade. Nature Reviews Drug Discovery. 20 (2), 145-159 (2021).
- Bray, M. -. A., et al. Cell Painting, a high-content image-based assay for morphological profiling using multiplexed fluorescent dyes. Nature Protocols. 11 (9), 1757-1774 (2016).
- Schiff, L., et al. Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts. Nature Communications. 13 (1), 1590 (2022).
- Ziegler, S., Sievers, S., Waldmann, H. Morphological profiling of small molecules. Cell Chemical Biology. 28 (3), 300-319 (2021).
- Cobb, M. M., Ravisankar, A., Skibinski, G., Finkbeiner, S. iPS cells in the study of PD molecular pathogenesis. Cell and Tissue Research. 373 (1), 61-77 (2018).
- Elitt, M. S., Barbar, L., Tesar, P. J. Drug screening for human genetic diseases using iPSC models. Human Molecular Genetics. 27 (R2), 89-98 (2018).
- Vuidel, A., et al. High-content phenotyping of Parkinson’s disease patient stem cell-derived midbrain dopaminergic neurons using machine learning classification. Stem Cell Reports. 17 (10), 2349-2364 (2022).
- Stirling, D. R., Swain-Bowden, M. J., Lucas, A. M., Carpenter, A. E., Cimini, B. A., Goodman, A. CellProfiler 4: improvements in speed, utility and usability. BMC Bioinformatics. 22 (1), 433 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Sofroniew, N., et al. . napari: a multi-dimensional image viewer for Python. , (2022).
- Berthold, M. R., et al. KNIME: The Konstanz Information Miner. Data Analysis, Machine Learning and Applications. , 319-326 (2008).
- Fathi, A., et al. Diverging Parkinson’s Disease Pathology between patient-derived GBAN370S, LRRK2G2019S and engineered SNCAA53T iPSC-derived Dopaminergic Neurons. bioRxiv. , (2023).
- Wang, Y., Huang, H., Rudin, C., Shaposhnik, Y. Understanding How Dimension Reduction Tools Work: An Empirical Approach to Deciphering t-SNE, UMAP, TriMap, and PaCMAP for Data Visualization. Journal of Machine Learning Research. 22 (201), 1-73 (2021).
- Ke, G., et al. LightGBM: A highly efficient gradient boosting decision tree. Advances in Neural Information Processing Systems. 30, (2017).
- Avazzadeh, S., Baena, J. M., Keighron, C., Feller-Sanchez, Y., Quinlan, L. R. Modelling Parkinson’s Disease: iPSCs towards Better Understanding of Human Pathology. Brain Sciences. 11 (3), 373 (2021).
- Sánchez-Danés, A., et al. Disease-specific phenotypes in dopamine neurons from human iPS-based models of genetic and sporadic Parkinson’s disease. EMBO Molecular Medicine. 4 (5), 380-395 (2012).
- Oosterveen, T., et al. Pluripotent stem cell derived dopaminergic subpopulations model the selective neuron degeneration in Parkinson’s disease. Stem Cell Reports. 16 (11), 2718-2735 (2021).
- Hughes, R. E., et al. Multiparametric high-content cell painting identifies copper ionophores as selective modulators of esophageal cancer phenotypes. ACS Chemical Biology. 17 (7), 1876-1889 (2022).
- Akbarzadeh, M., et al. Morphological profiling by means of the Cell Painting assay enables identification of tubulin-targeting compounds. Cell Chemical Biology. 29 (6), 1053-1064 (2022).
- Schiff, L., et al. Integrating deep learning and unbiased automated high-content screening to identify complex disease signatures in human fibroblasts. Nature Communications. 13 (1), 1590 (2022).
- Way, G. P., et al. Morphology and gene expression profiling provide complementary information for mapping cell state. Cell Systems. 13 (11), 911-923 (2022).
- Feng, Y., Mitchison, T. J., Bender, A., Young, D. W., Tallarico, J. A. Multi-parameter phenotypic profiling: using cellular effects to characterize small-molecule compounds. Nature Reviews Drug Discovery. 8 (7), 567-578 (2009).
- Antonov, S. A., Novosadova, E. V. Current state-of-the-art and unresolved problems in using human induced pluripotent stem cell-derived dopamine neurons for parkinson’s disease drug development. International Journal of Molecular Sciences. 22 (7), 3381 (2021).
- Miller, J. D., et al. Human iPSC-based modeling of late-onset disease via progerin-induced aging. Cell Stem Cell. 13 (6), 691-705 (2013).
- Bezard, E., Gross, C. E., Brotchie, J. M. Presymptomatic compensation in Parkinson’s disease is not dopamine-mediated. Trends in Neurosciences. 26 (4), 215-221 (2003).
- Wu, Y., Le, W., Jankovic, J. Preclinical Biomarkers of parkinson disease. Archives of Neurology. 68 (1), 22-30 (2011).
- Verstraelen, P., et al. Systematic quantification of synapses in primary neuronal culture. iScience. 23 (9), 101542 (2020).
- Liu-Yesucevitz, L., et al. ALS-Linked mutations enlarge TDP-43-enriched neuronal RNA granules in the dendritic arbor. The Journal of Neuroscience. 34 (12), 4167-4174 (2014).

