Un esperimento che utilizza la spettroscopia funzionale nel vicino infrarosso e i movimenti di puntamento multiarticolare dell'arto inferiore assistiti da robot
Summary
Si stima che 1 persona su 6 in tutto il mondo avrà un ictus nel corso della vita, causando disabilità a lungo termine, i cui meccanismi di riabilitazione sono ancora poco compresi. Questo studio propone un protocollo per valutare l’attivazione cerebrale mediante spettroscopia funzionale nel vicino infrarosso (fNIRS) durante una sessione di terapia robotica degli arti inferiori.
Abstract
L’ictus colpisce circa 17 milioni di persone in tutto il mondo ogni anno ed è una delle principali cause di disabilità a lungo termine. La terapia robotica si è dimostrata promettente nell’aiutare i pazienti colpiti da ictus a recuperare le funzioni motorie perdute. Una potenziale strada per aumentare la comprensione di come avviene il recupero motorio è quella di studiare l’attivazione cerebrale durante i movimenti che sono presi di mira dalla terapia in individui sani. La spettroscopia funzionale nel vicino infrarosso (fNIRS) è emersa come una promettente tecnica di neuroimaging per esaminare le basi neurali della funzione motoria. Questo studio mirava a indagare i correlati neurali fNIRS di movimenti complessi degli arti inferiori in soggetti sani. Ai partecipanti è stato chiesto di eseguire cicli di riposo e movimento per 6 minuti utilizzando un dispositivo robotico per la riabilitazione motoria. L’attività richiedeva movimenti coordinati dell’articolazione del ginocchio e della caviglia per puntare ai bersagli visualizzati sullo schermo di un computer. Sono state esplorate due condizioni sperimentali con diversi livelli di assistenza al movimento forniti dal robot. I risultati hanno mostrato che il protocollo fNIRS ha rilevato efficacemente le regioni cerebrali associate al controllo motorio durante il compito. In particolare, tutti i soggetti hanno mostrato una maggiore attivazione nell’area premotoria controlaterale durante la condizione di assenza di assistenza rispetto alla condizione assistita. In conclusione, la fNIRS sembra essere un approccio valido per rilevare le variazioni nella concentrazione di ossiemoglobina associate a movimenti di puntamento multiarticolare dell’arto inferiore. Questa ricerca potrebbe contribuire alla comprensione dei meccanismi di recupero motorio dell’ictus e potrebbe aprire la strada a migliori trattamenti riabilitativi per i pazienti con ictus. Tuttavia, sono necessarie ulteriori ricerche per chiarire appieno il potenziale della fNIRS nello studio della funzione motoria e delle sue applicazioni in ambito clinico.
Introduction
I dati epidemiologici indicano che in tutto il mondo ci sono ~17 milioni di nuovi casi di ictus ogni anno, con un aumento dell’incidenza nei paesi a basso e medio reddito1. Si stima che il numero di nuovi casi salirà a 77 milioni entro il 20302. La compromissione motoria dovuta all’ictus spesso influisce sulla mobilità del paziente e sulla partecipazione alle attività della vita quotidiana, contribuendo a una bassa qualità della vita. La riabilitazione motoria tradizionale comprende la terapia manuale, ma negli ultimi decenni sono stati sviluppati sistemi robotici per la riabilitazione. Questi sistemi sono in grado di fornire una terapia ad alta intensità, dose, quantificabilità, affidabilità, ripetibilità e flessibilità3 e hanno dimostrato un potenziale come trattamenti riabilitativi efficaci per pazienti con ictus sia acuto che cronico 4,5,6. Oltre ad erogare la terapia, i sistemi robotici per la riabilitazione possono essere utilizzati come strumenti di valutazione in quanto possono essere dotati di sensori in grado di misurare i dati cinematici/cinetici del movimento del paziente 7,8. Per la riabilitazione motoria degli arti superiori, tali dati non solo si sono dimostrati utili per valutare il livello di recupero motorio del paziente indotto dalla terapia robotica e sono serviti come strumento supplementare alle valutazioni cliniche tradizionali 9,10, ma hanno anche contribuito a far progredire la comprensione del processo di recupero motorio dall’ictus11, 12 così come il controllo neurale del movimento e l’apprendimento motorio in soggetti sani 3,13,14. Di conseguenza, questi risultati hanno fornito una base per migliorare i trattamenti riabilitativi15.
Negli ultimi due decenni, sono stati proposti molti dispositivi robotici per la neuroriabilitazione degli arti inferiori, che vanno dagli esoscheletri che supportano il peso corporeo del paziente durante la deambulazione (ad esempio, su un tapis roulant, come Lokomat16) ai sistemi robotici stazionari che consentono al paziente di esercitare la caviglia, il ginocchio o il piede senza camminare (come il Rutgers Ankle17, il robot per la riabilitazione della caviglia ad alte prestazioni18 e il robot per la riabilitazione caviglia/piede del Gwangju Institute of Science and Technology (GIST)19) o ortesi attive per il piede che sono esoscheletri azionati indossati dal paziente per camminare fuori terra o su un tapis roulant (come l’ortesi per andatura motorizzata20 e la caviglia MITAnklebot 21). Vedere 22,23,4 per una recensione sui robot per la riabilitazione degli arti inferiori.
I risultati degli studi clinici sui dispositivi robotici per la riabilitazione degli arti inferiori su pazienti colpiti da ictus sono stati incoraggianti e hanno dimostrato che questi sistemi possono migliorare il range di movimento (ROM) delle articolazioni, la forza muscolare o l’andatura, a seconda del dispositivo specifico e del protocollo clinico (vedere 24,25 per una revisione sull’efficacia dei robot degli arti inferiori per la riabilitazione). Mentre è stato postulato che la terapia assistita da robot promuova cambiamenti neuroplastici, che alla fine si traducono in un miglioramento delle capacità motorie26, il modo in cui avviene esattamente il processo di recupero motorio dall’ictus e quali protocolli di allenamento robotico ottimizzano il processo di recupero delle capacità motorie degli arti inferiori, rimangono per lo più poco chiari. In effetti, c’è una significativa e crescente disparità tra il crescente sviluppo di robot per la riabilitazione (sia da parte di ricercatori accademici che di enti commerciali) e la limitata comprensione dei meccanismi neurofisiologici che sono alla base del recupero motorio4. Le misurazioni della cinematica del movimento o delle coppie articolari effettuate con sensori incorporati hanno contribuito a descrivere quantitativamente i cambiamenti comportamentali motori che si verificano quando i pazienti recuperano le capacità motorie degli arti inferiori 27,28,29, colmando parzialmente questa lacuna. Tuttavia, i correlati neurali alla base di tali cambiamenti sono stati meno studiati. Ciò è dovuto a diversi motivi.
L’imaging funzionale cerebrale richiede molto tempo e talvolta è difficile da completare nel contesto degli studi clinici, che spesso richiedono di ridurre al minimo il carico del paziente per massimizzare la probabilità di aderenza del paziente allo studio. Ciò è particolarmente vero per le persone che hanno subito un ictus, dato che l’affaticamento post-ictus e la debolezza muscolare sono spesso osservati30. Inoltre, le modalità di imaging basate su campi magnetici, come la risonanza magnetica funzionale (fMRI), richiedono che sia l’hardware del paziente che quello robotico siano a prova di magnete.
Tra le modalità di imaging non invasive, la spettroscopia funzionale nel vicino infrarosso (fNIRS) è una tecnica di imaging particolarmente adatta per valutare le aree di attivazione cerebrale in soggetti sottoposti a terapia robotica. Analogamente alla fMRI, la fNIRS misura l’ossigenazione/deossigenazione del sangue nel cervello. Tuttavia, a differenza della fMRI, la fNIRS è completamente compatibile con l’hardware robotico ed è spesso portatile, essendo utilizzabile anche al letto del paziente. Inoltre, fNIRS ha un basso costo e una minore sensibilità agli artefatti da movimento 31,32,33.
Nonostante i suoi evidenti vantaggi e l’uso diffuso in molti contesti clinici sin dalla sua prima introduzione alla fine degli anni ’7034, solo pochi studi hanno utilizzato la fNIRS per quantificare l’attivazione cerebrale associata ai movimenti degli arti inferiori e al recupero motorio dell’ictus. Gli studi FNIRS volti a chiarire i meccanismi di controllo neurale del movimento e/o i meccanismi o la valutazione del recupero motorio dall’ictus hanno indagato principalmente movimenti monoarticolari (ad esempio, flessione dorsale, flessione plantare o movimenti di estensione del ginocchio 35,36,37), camminata 38,39,40,41,42,43 o ciclismo44. Vedere45 per una recensione. Allo stesso modo, gli studi fNIRS sulla terapia robot-assistita per l’arto inferiore si sono concentrati principalmente sulla riabilitazione della deambulazione robot-assistita; Vedi46 per una recensione. Alcuni studi si sono concentrati sull’utilizzo di fNIRS come parte di un sistema di interfaccia cervello-computer (BCI) per derivare segnali di controllo per dispositivi robotici47,48; sebbene quest’area di ricerca si basi anche sull’elaborazione dei segnali fNIRS, il suo obiettivo è diverso e principalmente focalizzato sulla decodifica delle intenzioni dei pazienti (ad esempio, pazienti con gravi disabilità motorie).
Lo studio pilota qui presentato fa parte di uno sforzo iniziale per studiare gli effetti di un sistema robotico per la riabilitazione degli arti inferiori. Il robot è in grado di fornire una riabilitazione mirata agli arti inferiori che prevede l’allenamento nei movimenti multiarticolari quotidiani e di fornire una terapia alle singole articolazioni (ad esempio, ginocchio o caviglia) dell’arto inferiore (ad esempio, implementare un programma di riabilitazione dal basso verso l’alto).
Lo studio aveva lo scopo di indagare la fattibilità di un protocollo sperimentale che richiedesse l’acquisizione di dati fNIRS durante l’esecuzione di movimenti di puntamento multiarticolare degli arti inferiori. La durata del periodo di acquisizione dei dati in questo studio, che è stato limitato a 6 minuti, è più breve rispetto ai tipici protocolli fNIRS. Si è trattato di una scelta voluta con l’obiettivo di migliorare la praticità e l’applicabilità clinica di questa ricerca, in particolare nei pazienti con mobilità o forza limitate. Anche l’identificazione dei correlati fNIRS di movimenti multiarticolari così complessi e l’acquisizione di informazioni su come l’attivazione cerebrale è stata modulata dall’assistenza del robot sono stati punti di interesse. A tal fine, sono state condotte due sessioni di esperimenti con gli stessi partecipanti: una senza assistenza robotica e una con assistenza robotica. Infine, è importante sottolineare che questo studio si è concentrato su soggetti sani al fine di stabilire una base per la ricerca futura in termini di fattibilità del protocollo di registrazione e valutazione dell’attivazione cerebrale durante i movimenti mirati dalla terapia robotica.
Apparecchio
Per condurre i nostri esperimenti è stato utilizzato un robot portatile progettato per la riabilitazione degli arti inferiori (vedi Figura 1). Il robot ha un’area di lavoro raggiungibile in 3D ed è compatto e leggero, con un peso di circa 35 libbre, il che lo rende facile da trasportare e installare.
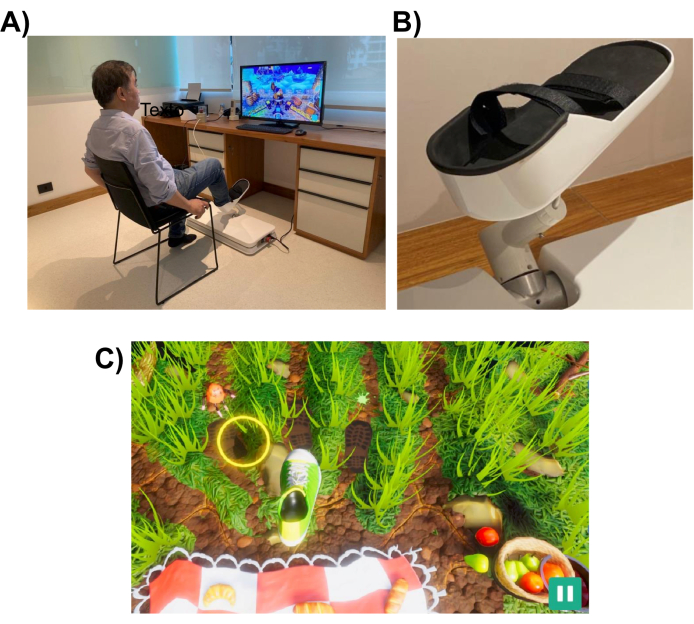
Figura 1: Configurazione sperimentale. (A) Il sistema robotico (installato sul pavimento) progettato per l’arto inferiore. Un volontario viene mostrato mentre utilizza l’interfaccia con il piede destro. (B) Struttura di supporto per il piede del soggetto che consente il fissaggio al sistema robotico. (C) Uno screenshot del gioco Picnic. L’obiettivo del gioco è muovere il piede (scarpa verde e bianca) verso il bersaglio (cerchio giallo). Fare clic qui per visualizzare una versione più grande di questa figura.
Il sistema robotico è progettato per assistere il paziente nell’esecuzione di movimenti degli arti inferiori simili a quelli eseguiti nelle attività quotidiane, come puntare o calciare. Utilizza giochi interattivi di realtà virtuale, che vengono visualizzati sul monitor di un computer o su uno schermo televisivo posto di fronte al dispositivo robotico (vedi Figura 1). L’effettore dell’estremità del robot è collegato all’arto inferiore del paziente (ad esempio, la caviglia) e la sua posizione è mappata sulla posizione di un cursore sullo schermo. Un gioco tipico mostra i bersagli di movimento del paziente (ad esempio, l’oggetto da indicare o dove calciare la palla).
Per completare l’attività di movimento, il robot può assistere il paziente con un livello di assistenza che può variare da assistenza completa a nessuna. Il livello di assistenza robotica viene scelto all’inizio di ogni seduta riabilitativa in base al livello di compromissione motoria del paziente. I movimenti eseguiti dal soggetto vengono utilizzati dal gioco per valutare le prestazioni del paziente e fornirgli un feedback sulle sue prestazioni (ad esempio, ROM, numero di movimenti e livello di assistenza robotica). I giochi sono progettati per essere interattivi e divertenti per sostenere l’interesse e l’attenzione del paziente. In questo studio, i partecipanti hanno giocato al “gioco del picnic”, in cui il giocatore doveva impedire agli insetti di raggiungere l’asciugamano e rubare il cibo (vedi Figura 1, pannello in basso, per uno screenshot).
L’acquisizione dei dati è stata eseguita con un sistema di acquisizione fNIRS portatile con due diversi optodi a onda continua (760 nm e 850 nm), 8 sorgenti LED a doppia punta e 8 rivelatori attivi a doppia punta. I segnali sono stati acquisiti utilizzando una frequenza di campionamento di 10,17 Hz. Per l’ottimizzazione della calibrazione e la registrazione del segnale è stato utilizzato un computer portatile utilizzando una rete Wi-Fi creata dal sistema fNIRS.
Un cappuccio è stato utilizzato per tenere gli optodi nelle posizioni predeterminate. Le sorgenti e i rivelatori sono stati collocati secondo il sistema EEG internazionale 10-10 in una distribuzione spaziale a griglia. Ogni canale fNIRS è stato definito da una coppia sorgente-rivelatore con distanze inter-optodate di circa 30 mm. Gli optodi sono stati posizionati sopra le aree del motore supplementare, del premotore e del motore nelle posizioni mostrate nella Figura 2. Il numero totale di canali era di 28, dove 8 erano canali a breve distanza che sono stati accoppiati a ciascuna sorgente utilizzando un adattatore in fibra ottica per un singolo rivelatore. Data la configurazione di multiplexing dell’hardware, è possibile acquisire informazioni a breve distanza da tutte le sorgenti utilizzando un solo rivelatore.
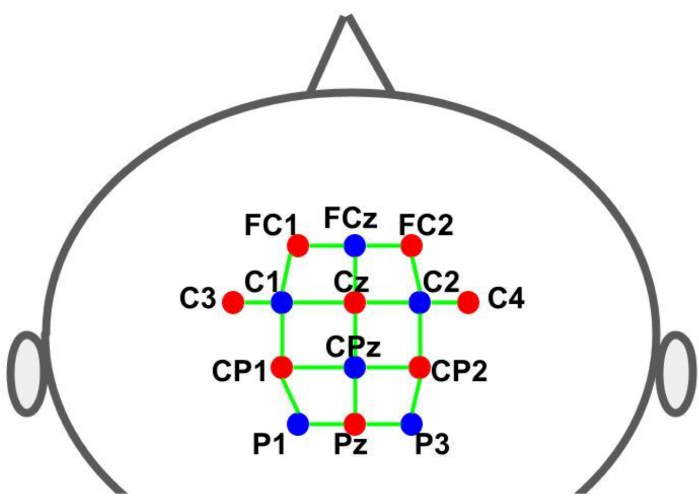
Figura 2: Layout di montaggio utilizzando il sistema EEG 10-10. Le lettere e i numeri indicano le posizioni della sorgente/rivelatore. I punti rossi e blu rappresentano rispettivamente gli optodi della sorgente e del rivelatore. Le linee verdi rappresentano i canali fNIRS costituiti da coppie sorgente e rivelatore. Fare clic qui per visualizzare una versione più grande di questa figura.
Disegno sperimentale
L’esperimento è stato condotto in due distinte condizioni sperimentali, diverse per il livello di assistenza fornito dal robot ai movimenti del soggetto. Nella prima condizione, il robot è stato programmato per non fornire alcuna assistenza ai movimenti del soggetto, mentre nella seconda condizione, il robot ha controllato i movimenti del piede e delle gambe del soggetto (movimento assistito dal robot).
Ogni esperimento ha seguito un paradigma di progettazione a blocchi che prevedeva cicli alternati di un compito motorio (giocare – 30 secondi) e riposo (30 secondi), come illustrato nella Figura 3. L’inizio e la conclusione di ogni fase (gioco/gioco o riposo) sono stati segnalati visivamente al soggetto attraverso lo schermo del computer. Durante la fase di riposo, è stato visualizzato un messaggio che indicava una pausa. Ogni ciclo (gioco/gioco + riposo) ha avuto una durata di 60 s ed è stato ripetuto sei volte, per un tempo di esecuzione totale di 360 s (6 min).
I partecipanti hanno giocato al “gioco del picnic”, in cui l’obiettivo era quello di impedire agli insetti di raggiungere l’asciugamano e rubare il cibo. Questo gioco prevedeva una sequenza di movimenti degli arti inferiori, partendo da un bersaglio di partenza designato (posizione iniziale) ed estendendosi verso uno dei tre bersagli esterni prima di tornare al bersaglio di partenza. Sullo schermo, i bersagli esterni erano rappresentati visivamente come insetti animati in movimento, che i partecipanti dovevano raggiungere e calpestare. C’erano tre bersagli esterni, ognuno presentato casualmente un numero uguale di volte, insieme a un bersaglio comune per ogni movimento. La distanza che il piede doveva percorrere dal bersaglio principale alla posizione dei bersagli esterni formava un arco, che misurava circa 26 cm. Il compito motorio richiedeva l’esecuzione di movimenti multiarticolari, che richiedevano la coordinazione tra i movimenti di flessione/estensione del ginocchio, flessione plantare e flessione dorsale.
Le registrazioni dei dati fNIRS sono state sincronizzate con gli stimoli visivi presentati dal gioco al soggetto attraverso un impulso transistor-transistor-logic (TTL) generato dal robot. Gli impulsi sono stati generati all’inizio di ogni fase (gioco/gioco e riposo). Pertanto, tutto il controllo dei tempi è stato eseguito dal gioco, che ha fornito segnali visivi (bersagli) al partecipante per iniziare ogni movimento, ha inviato segnali TTL al sistema fNIRS per contrassegnare le registrazioni dell’attività cerebrale e, se richiesto dall’esperimento, ha inviato segnali al sistema di controllo del robot per avviare l’assistenza al movimento.
Protocol
Representative Results
Discussion
In questo studio proof-of-concept, è stata studiata la fattibilità di fare inferenze sulla mappatura dell’attivazione cerebrale utilizzando i dati fNIRS di soggetti sani mentre si esercitavano con diversi tipi di movimenti utilizzando un robot per la riabilitazione degli arti inferiori. Le sessioni tipiche di registrazione fNIRS negli adulti durano più di 6 minutie 54 minuti. Tuttavia, per rendere fattibili le registrazioni nel contesto di un contesto di riabilitazione, la durata complessiva de…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Le opinioni, le ipotesi, le conclusioni e le raccomandazioni di questo studio sono quelle degli autori e non rappresentano necessariamente le opinioni dell’agenzia di finanziamento. Il JRS è grato alla Fondazione di Ricerca San Paolo (FAPESP, numeri di sovvenzione 2021/05332-8, 2018/04654-9, 2018/21934-5 e 2023/02538-0) e a Jackson Cionek per il supporto tecnologico. AMM e Vivax Ltda sono grate a FAPESP (Fondazione di Ricerca di San Paolo) e FINEP (Agenzia Brasiliana per l’Innovazione). Questo progetto è stato finanziato con sovvenzioni di FAPESP (numero di sovvenzione 2018/09559-4) e FINEP (numero di sovvenzione 2019/09933-6).
Materials
| 32 inch Smart TV | Samsung | N/A | TV connected to robot via HDMI cable |
| 8-detector silicon photodiode (SiPD) optodes for optical detection with dual tip | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| 8-source optodes bundle for optical illumination with dual tip | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| Aurora acquisition software | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| Laptop Precision XPS 13 | Dell Technologies (Round Rock, TX, USA) | ||
| nirsLAB fNIRS Analysis software | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| NIRSports2 fNIRS acquisition system | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | It has two different continuous wave optics (760 and 850 nm), 8 dual-ended LED sources and 8 dual-ended active detectors. |
| R | R-project.org (open source software) | https://www.r-project.org/ | |
| Standard cut cap, black color for up to 128 holders. | Easycap GmbH (Wörthsee, Germany) | https://www.easycap.de/ | |
| Vivax Assistive Rehabilitation Machine (ARM) | Vivax Ltda (São Paulo, Brazil) | https://vivaxbr.com/home/ | It is a portable robot designed to deliver lower limb rehabilitation. It has a 3D reachable workspace and is compact and light, weighing about 35 lb., which makes it easy to transport and to install. |
Riferimenti
- GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. Neurology. 18 (5), 439-458 (2019).
- GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. The Lancet. Neurology. 20 (10), 795-820 (2021).
- Huang, V. S., Krakauer, J. W. Robotic neurorehabilitation: a computational motor learning perspective. Journal of NeuroEngineering and Rehabilitation. 6, 5 (2009).
- Hobbs, B., Artemiadis, P. A Review of Robot-Assisted Lower-Limb Stroke Therapy: Unexplored Paths and Future Directions in Gait Rehabilitation. Frontiers in neurorobotics. 14, 19 (2020).
- Bertani, R., Melegari, C., De Cola, M. C., Bramanti, A., Bramanti, P., Calabrò, R. S. Effects of robot-assisted upper limb rehabilitation in stroke patients: a systematic review with meta-analysis. Neurological Sciences. 38 (9), 1561-1569 (2017).
- Warutkar, V., Dadgal, R., Mangulkar, U. R. Use of robotics in gait rehabilitation following stroke: A review. Cureus. 14 (11), e31075 (2022).
- Dipietro, L., et al. Changing motor synergies in chronic stroke. Journal of Neurophysiology. 98 (2), 757-768 (2007).
- Dipietro, L., et al. Learning, not adaptation, characterizes stroke motor recovery: evidence from kinematic changes induced by robot-assisted therapy in trained and untrained task in the same workspace. IEEE Trans Neural Syst Rehabil Eng. 20 (1), 48-57 (2012).
- Bosecker, C., Dipietro, L., Volpe, B., Krebs, H. I. Kinematic robot-based evaluation scales and clinical counterparts to measure upper limb motor performance in patients with chronic stroke. Neurorehabilitation and Neural Repair. 24 (1), 62-69 (2010).
- Krebs, H. I., et al. Robotic measurement of arm movements after stroke establishes biomarkers of motor recovery. Stroke. 45 (1), 200-204 (2014).
- Volpe, B. T., et al. Robotic devices as therapeutic and diagnostic tools for stroke recovery. Archives of Neurology. 66 (9), 1086-1090 (2009).
- Hogan, N., et al. Motions or muscles? Some behavioral factors underlying robotic assistance of motor recovery. Journal of Rehabilitation Research and Development. 43 (5), 605-618 (2006).
- Shadmehr, R., Wise, S. P. . The Computational Neurobiology of Reaching and Pointing: A Foundation for Motor Learning. , (2005).
- Dipietro, L., Poizner, H., Krebs, H. I. Spatiotemporal dynamics of online motor correction processing revealed by high-density electroencephalography. J Cogn Neurosci. 26 (9), 1966-1980 (2014).
- Krebs, H., et al. Rehabilitation robotics: Performance-based progressive robot-assisted therapy. Autonomous Robots. 15, 7-20 (2003).
- Colombo, G., Joerg, M., Schreier, R., Dietz, V. Treadmill training of paraplegic patients using a robotic orthosis. Journal of Rehabilitation Research and Development. 37 (6), 693-700 (2000).
- Girone, M., et al. A Stewart platform-based system for ankle telerehabilitation. Autonomous Robots. 10, 203-212 (2001).
- Saglia, J. A., Tsagarakis, N. G., Dai, J. S., Caldwell, D. G. A high-performance redundantly actuated parallel mechanism for ankle rehabilitation. The International Journal of Robotics Research. 28 (9), 1216-1227 (2009).
- Yoon, J., Ryu, J. A novel reconfigurable ankle/foot rehabilitation robot. , 2290-2295 (2005).
- Ruthenberg, B. J., Wasylewski, N. A., Beard, J. E. An experimental device for investigating the force and power requirements of a powered gait orthosis. Journal of Rehabilitation Research and Development. 34 (2), 203-213 (1997).
- Forrester, L. W., et al. Clinical application of a modular ankle robot for stroke rehabilitation. NeuroRehabilitation. 33 (1), 85-97 (2013).
- Díaz, I., Gil, J. J., Sánchez, E. Lower-limb robotic rehabilitation: Literature review and challenges. Journal of Robotics. 2011, 759764 (2011).
- Zhang, X., Yue, Z., Wang, J. Robotics in lower-limb rehabilitation after stroke. Behavioural Neurology. 2017, 3731802 (2017).
- Zhang, M., Davies, T. C., Xie, S. Effectiveness of robot-assisted therapy on ankle rehabilitation – a systematic review. Journal of NeuroEngineering and Rehabilitation. 10, 30 (2013).
- Lo, K., Stephenson, M., Lockwood, C. Effectiveness of robotic assisted rehabilitation for mobility and functional ability in adult stroke patients: a systematic review protocol. JBI Database of Systematic Reviews and Implementation Reports. 15 (1), 39-48 (2017).
- Belda-Lois, J. M., et al. Rehabilitation of gait after stroke: a review towards a top-down approach. Journal of NeuroEngineering and Rehabilitation. 8, 66 (2011).
- Bortole, M., et al. The H2 robotic exoskeleton for gait rehabilitation after stroke: early findings from a clinical study. Journal of NeuroEngineering and Rehabilitation. 12, 54 (2015).
- Banala, S. K., Kim, S. H., Agrawal, S. K., Scholz, J. P. Robot assisted gait training with active leg exoskeleton (ALEX). IEEE Transactions on Neural Systems and Rehabilitation Engineering. 17 (1), 2-8 (2009).
- Bartenbach, V., Wyss, D., Seuret, D., Riener, R. A lower limb exoskeleton research platform to investigate human-robot interaction. 2015 IEEE International Conference on Rehabilitation Robotics (ICORR). 2015, 600-605 (2015).
- Hinkle, J. L., et al. Poststroke fatigue: Emerging evidence and approaches to management: A scientific statement for healthcare professionals from the American heart association. Stroke. 48 (7), e159-e170 (2017).
- Balardin, J. B., Zimeo Morais, G. A., Furucho, R. A., Trambaiolli, L. R., Sato, J. R. Impact of communicative head movements on the quality of functional near-infrared spectroscopy signals: negligible effects for affirmative and negative gestures and consistent artifacts related to raising eyebrows. Journal of Biomedical Optics. 22 (4), 4601 (2017).
- Nazeer, H., Naseer, N., Mehboob, A., Khan, M. J., Khan, R. A., Khan, U. S., Ayaz, Y. Enhancing classification performance of fNIRS-BCI by identifying cortically active channels using the z-score method. Sensors. 20 (23), 6995 (2020).
- Ayaz, H., et al. Optical imaging and spectroscopy for the study of the human brain: status report. Neurophotonics. 9, S24001 (2022).
- Chen, W. L., et al. Functional near-infrared spectroscopy and its clinical application in the field of neuroscience: Advances and future directions. Frontiers in Neuroscience. 14, 724 (2020).
- Yamamoto, K., Miyata, T., Onozuka, A., Koyama, H., Ohtsu, H., Nagawa, H. Plantar flexion as an alternative to treadmill exercise for evaluating patients with intermittent claudication. European Journal of Vascular and Endovascular Surgery. 33 (3), 325-329 (2007).
- Formenti, D., et al. Effects of knee extension with different speeds of movement on muscle and cerebral oxygenation. PeerJ. 6, 5704 (2018).
- Miyai, I., et al. Cortical mapping of gait in humans: a near-infrared spectroscopic topography study. NeuroImage. 14 (5), 1186-1192 (2001).
- Miyai, I., et al. Premotor cortex is involved in restoration of gait in stroke. Annals of Neurology. 52 (2), 188-194 (2002).
- Mihara, M., et al. Sustained prefrontal activation during ataxic gait: a compensatory mechanism for ataxic stroke?. NeuroImage. 37 (4), 1338-1345 (2007).
- Rea, M., et al. Lower limb movement preparation in chronic stroke: A pilot study toward an fNIRS-BCI for gait rehabilitation. Neurorehabilitation and Neural Repair. 28 (6), 564-575 (2014).
- Holtzer, R., Verghese, J., Allali, G., Izzetoglu, M., Wang, C., Mahoney, J. R. Neurological gait abnormalities moderate the functional brain signature of the posture first hypothesis. Brain Topography. 29 (2), 334-343 (2016).
- Kim, H. Y., Yang, S. P., Park, G. L., Kim, E. J., You, J. S. Best facilitated cortical activation during different stepping, treadmill, and robot-assisted walking training paradigms and speeds: A functional near-infrared spectroscopy neuroimaging study. NeuroRehabilitation. 38 (2), 171-178 (2016).
- Khan, H., Nazeer, H., Engell, H., Naseer, N., Korostynska, O., Mirtaheri, P. Prefrontal cortex activation measured during different footwear and ground conditions using fNIRS-A case study. 2021 IEEE International Conference on Artificial Intelligence and Mechatronics Systems (AIMS). , 1-6 (2021).
- Lin, P. Y., Chen, J. J., Lin, S. I. The cortical control of cycling exercise in stroke patients: an fNIRS study). Human Brain Mapping. 34 (10), 2381-2390 (2013).
- Yang, M., Yang, Z., Yuan, T., Feng, W., Wang, P. A systemic review of functional near-infrared spectroscopy for stroke: Current application and future directions. Frontiers in Neurology. 10, 58 (2019).
- Berger, A., Horst, F., Müller, S., Steinberg, F., Doppelmayr, M. Current state and future prospects of EEG and fNIRS in robot-assisted gait rehabilitation: A brief review. Frontiers in Human Neuroscience. 13, 172 (2019).
- Khan, R. A., Naseer, N., Qureshi, N. K., et al. fNIRS-based Neurorobotic Interface for gait rehabilitation. J NeuroEngineering Rehabil. 15 (1), 7 (2018).
- Khan, H., Naseer, N., Yazidi, A., Eide, P. K., Hassan, H. W., Mirtaheri, P. Analysis of Human Gait Using Hybrid EEG-fNIRS-Based BCI System: A Review. Front. Hum. Neurosci. 14, (2020).
- Delpy, D. T., Cope, M. Quantification in tissue near-infrared spectroscopy. Philosophical Transactions of the Royal Society B: Biological Sciences. 352 (1354), 649-659 (1997).
- Huppert, T. J. Commentary on the statistical properties of noise and its implication on general linear models in functional near-infrared spectroscopy. Neurophotonics. 3, 010401 (2016).
- Alexandre, F., Heraud, N., Oliver, N., Varray, A. Cortical implication in lower voluntary muscle force production in non-hypoxemic COPD patients. PLoS One. 9 (6), 100961 (2014).
- Yoon, T., Vanden Noven, M. L., Nielson, K. A., Hunter, S. K. Brain areas associated with force steadiness and intensity during isometric ankle dorsiflexion in men and women. Experimental Brain Research. 232 (10), 3133-3145 (2014).
- Ciccarelli, O., et al. Identifying brain regions for integrative sensorimotor processing with ankle movements. Experimental Brain Research. 166 (1), 31-42 (2005).
- Udina, C., et al. Functional near-infrared spectroscopy to study cerebral hemodynamics in older adults during cognitive and motor tasks: A review. Frontiers in Aging Neuroscience. 11, 367 (2020).
- Thickbroom, G. W., Phillips, B. A., Morris, I., Byrnes, M. L., Mastaglia, F. L. Isometric force-related activity in sensorimotor cortex measured with functional MRI. Experimental Brain Research. 121 (1), 59-64 (1998).
- Derosière, G., Alexandre, F., Bourdillon, N., Mandrick, K., Ward, T. E., Perrey, S. Similar scaling of contralateral and ipsilateral cortical responses during graded unimanual force generation. NeuroImage. 85 (1), 471-477 (2014).
- Shi, P., Li, A., Yu, H. Response of the cerebral cortex to resistance and non-resistance exercise under different trajectories: A functional near-infrared spectroscopy study. Frontiers in Neuroscience. 15, 685920 (2021).
- Dettmers, C., et al. Relation between cerebral activity and force in the motor areas of the human brain. Journal of Neurophysiology. 74 (2), 802-815 (1995).
- Keisker, B., Hepp-Reymond, M. C., Blickenstorfer, A., Kollias, S. S. Differential representation of dynamic and static power grip force in the sensorimotor network. The European Journal of Neuroscience. 31 (8), 1483-1491 (2010).
- Harada, T., Miyai, I., Suzuki, M., Kubota, K. Gait capacity affects cortical activation patterns related to speed control in the elderly. Experimental Brain Research. 193 (3), 445-454 (2009).
- Saleh, S., et al. The role of premotor areas in dual tasking in healthy controls and persons with multiple sclerosis: An fNIRS imaging study. Frontiers in Behavioral Neuroscience. 12, 296 (2018).
- Bonnal, J., et al. Relation between cortical activation and effort during robot-mediated walking in healthy people: A functional near-infrared spectroscopy neuroimaging study (fNIRS). Sensors. 22 (15), 5542 (2022).
- Shibuya, K., Sadamoto, T., Sato, K., Moriyama, M., Iwadate, M. Quantification of delayed oxygenation in ipsilateral primary motor cortex compared with contralateral side during a unimanual dominant-hand motor task using near-infrared spectroscopy. Brain Research. 1210, 142-147 (2008).
- Dai, T. H., Liu, J. Z., Sahgal, V., Brown, R. W., Yue, G. W. Relationship between muscle output and functional MRI-measured brain activation. Experimental brain research. 140 (3), 290-300 (2001).
- Cabibel, V., Hordacre, B., Perrey, S. Implication of the ipsilateral motor network in unilateral voluntary muscle contraction: the cross-activation phenomenon. Journal of Neurophysiology. 123 (5), 2090-2098 (2020).
- Akselrod, M., Martuzzi, R., Serino, A., vander Zwaag, W., Gassert, R., Blanke, O. Anatomical and functional properties of the foot and leg representation in areas 3b, 1 and 2 of primary somatosensory cortex in humans: A 7T fMRI study. NeuroImage. 159, 473-487 (2017).
- Brigadoi, S., Cooper, R. J. How short is short? Optimum source-detector distance for short-separation channels in functional near-infrared spectroscopy. Neurophotonics. 2 (2), 025005 (2015).
- Funahashi, S. Prefrontal contribution to decision-making under free-choice conditions. Frontiers in Neuroscience. 11, 431 (2017).
- Simon, S. R., Meunier, M., Piettre, L., Berardi, A. M., Segebarth, C. M., Boussaoud, D. Spatial attention and memory versus motor preparation: premotor cortex involvement as revealed by fMRI. Journal of Neurophysiology. 88 (4), 2047-2057 (2002).
- Desmurget, M., Sirigu, A. A parietal-premotor network for movement intention and motor awareness. Trends in Cognitive Sciences. 13 (10), 411-419 (2009).
- Nachev, P., Kennard, C., Husain, M. Functional role of the supplementary and pre-supplementary motor areas. Nature reviews. Neuroscience. 9 (11), 856-869 (2008).
- Thoenissen, D., Zilles, K., Toni, I. Differential involvement of parietal and precentral regions in movement preparation and motor intention. The Journal of neuroscience: the official journal of the Society for Neuroscience. 22 (20), 9024-9034 (2002).
- Al-Quraishi, M. S., Elamvazuthi, I., Tang, T. B., Al-Qurishi, M., Adil, S. H., Ebrahim, M. Bimodal data fusion of simultaneous measurements of EEG and fNIRS during lower limb movements. Brain Sciences. 11 (6), 713 (2021).
- Bishnoi, A., Holtzer, R., Hernandez, M. E. Brain Activation Changes While Walking in Adults with and without Neurological Disease: Systematic Review and Meta-Analysis of Functional Near-Infrared Spectroscopy Studies. Brain sciences. 11 (3), 291 (2021).
- Oh, S., Song, M., Kim, J. Validating attentive locomotion training using interactive treadmill: an fNIRS study. Journal of NeuroEngineering and Rehabilitation. 15 (1), 122 (2018).

