機能的近赤外分光法とロボット支援下肢の多関節指差し運動を用いた実験
Summary
世界では、6人に1人が一生のうちに脳卒中を発症し、長期的な障害を引き起こすと推定されていますが、そのリハビリテーションメカニズムはまだよくわかっていません。この研究では、機能的近赤外分光法(fNIRS)による脳の活性化を評価するためのプロトコルを提案します 下肢ロボット療法セッション中。
Abstract
脳卒中は、世界中で毎年約1,700万人が罹患しており、長期的な障害の主な原因となっています。ロボット療法は、脳卒中患者が失われた運動機能を取り戻すのを助けることが期待されています。運動回復がどのように起こるかについての理解を深めるための1つの潜在的な手段は、健康な人の治療の対象となる運動中の脳の活性化を研究することです。機能的近赤外分光法(fNIRS)は、運動機能の神経基盤を調べるための有望な神経イメージング技術として浮上しています。この研究は、健康な被験者における複雑な下肢運動のfNIRS神経相関を調査することを目的としていました。参加者は、運動リハビリテーション用のロボットデバイスを使用して、6分間の休息と運動のサイクルを実行するように求められました。このタスクでは、膝関節と足首関節を協調して動かし、コンピューター画面に表示されたターゲットを指す必要がありました。ロボットによる移動支援のレベルが異なる2つの実験条件が検討されました。その結果、fNIRSプロトコルは、タスク中の運動制御に関連する脳領域を効果的に検出することを示しました。特に、すべての被験者は、補助状態と比較して、補助なしの状態中に反対側の運動前野でより大きな活性化を示しました。結論として、fNIRSは、下肢の多関節ポインティング運動に関連するオキシヘモグロビン濃度の変化を検出するための貴重なアプローチであるように思われます。本研究は、脳卒中の運動回復機構の解明に寄与し、脳卒中患者のリハビリテーション治療の改善に道を開くことが期待されます。しかし、fNIRSの運動機能研究や臨床現場での応用の可能性を十分に解明するには、さらなる研究が必要です。
Introduction
疫学データによると、世界中で毎年1,700~1,700万人の脳卒中患者が新たに発生しており、低・中所得国で発生率が増加しています1。新規感染者数は2030年までに7,700万人に増加すると推定されています2。脳卒中による運動障害は、患者の可動性や日常生活活動への参加に影響を与えることが多く、生活の質の低下の一因となります。従来の運動リハビリテーションには手技療法が含まれますが、過去数十年の間にリハビリテーション用のロボットシステムが開発されてきました。これらのシステムは、高強度、線量、定量化可能性、信頼性、再現性、柔軟性3で治療を提供することができ、急性および慢性脳卒中患者の両方に効果的なリハビリテーション治療としての可能性を示しています4,5,6。リハビリテーション用のロボットシステムは、治療を提供するだけでなく、患者の運動学的/運動学的データを測定できるセンサーを装備できるため、評価ツールとして使用することができます7,8。上肢の運動リハビリテーションでは、このようなデータは、ロボット療法によって誘発される患者の運動回復のレベルを評価するのに有用であることが証明され、従来の臨床評価9,10の補足ツールとして役立つだけでなく、脳卒中からの運動回復プロセスの理解を深めることにも貢献しています11。12、および健康な被験者における運動と運動学習の神経制御3,13,14。その結果、これらの知見はリハビリテーション治療を強化するための基盤を提供した15。
過去20年間にわたり、下肢のニューロリハビリテーションのための多くのロボット装置が提案され、歩行中に患者の体重を支える外骨格(例えば、ロコマット16のようなトレッドミルの上)から、患者が歩かずに足首、膝、または足を運動できる固定ロボットシステム(ラトガースアンクル17など、 高性能足関節リハビリテーションロボット18、および光州科学技術院(GIST)の足首/足リハビリテーションロボット19)、または患者が地上またはトレッドミルの上を歩くために装着する作動式外骨格であるアクティブフット装具(電動歩行装具20やMITアンクルボット21など)。下肢のリハビリテーションのためのロボットのレビューについては、22,23,4を参照してください。
脳卒中患者の下肢リハビリテーションのためのロボットデバイスの臨床試験の結果は有望であり、これらのシステムは、特定のデバイスと臨床プロトコルに応じて、関節の可動域(ROM)、筋力、または歩行を改善する可能性があることが示されています(リハビリテーションのための下肢ロボットの有効性に関するレビューについては、24,25を参照してください)。ロボット支援療法は神経可塑性の変化を促進し、最終的には運動能力の改善をもたらすと仮定されているが26、脳卒中からの運動回復のプロセスが正確にどのように起こるのか、そしてどのロボットトレーニングプロトコルが下肢の運動能力の回復プロセスを最適化するのかは、ほとんど不明のままである。実際、リハビリテーションロボットの開発が進んでいること(学術研究者や営利団体によるもの)と、運動回復の根底にある神経生理学的メカニズムの理解が限られていることとの間には、大きな格差が広がっています4。埋め込まれたセンサーで取得された運動学または関節トルクの測定は、患者が下肢の運動能力を回復するにつれて発生する運動行動の変化を定量的に記述することに貢献しています27,28,29、このギャップを部分的に埋めます。しかし、このような変化の根底にある神経相関はあまり研究されていません。これにはいくつかの理由があります。
脳機能イメージングは時間がかかり、臨床試験の文脈では完了するのが難しい場合があり、多くの場合、患者の負担を最小限に抑えて、患者が研究にアドヒアランスする可能性を最大限に高める必要があります。これは、脳卒中後の倦怠感や筋力低下が頻繁に観察されることを考えると、脳卒中を患った人に特に当てはまります30。また、機能的磁気共鳴画像法(fMRI)など、磁場に基づくイメージングモダリティでは、患者とロボットの両方のハードウェアが磁石で安全であることが求められます。
非侵襲的イメージングモダリティの中で、機能的近赤外分光法(fNIRS)は、ロボット療法を受けている被験者の脳活性化領域を評価するのに特に適したイメージング技術です。fMRIと同様に、fNIRSは脳内の血液酸素化/脱酸素化を測定します。しかし、fMRIとは異なり、fNIRSはロボットハードウェアと完全に互換性があり、多くの場合、ポータブルであり、ベッドサイドでも使用できます。また、fNIRSは低コストであり、モーションアーチファクトに対する感度が低い31,32,33。
70年代後半に初めて導入されて以来、多くの臨床現場でfNIRSの明らかな利点と広く使用されているにもかかわらず34、下肢運動と脳卒中運動回復に関連する脳の活性化を定量化するためにfNIRSを使用した研究はごくわずかです。運動の神経制御のメカニズムの解明や脳卒中からの運動回復のメカニズムや評価を目的としたFNIRS研究は、主に単関節運動(背屈、足底屈曲、膝伸展運動35,36,37)、歩行38,39,40,41,42,43、サイクリング44を調査してきた。レビューについては、45を参照してください。同様に、下肢のロボット支援療法に関するfNIRSの研究は、主にロボット支援歩行リハビリテーションに焦点を当てています。レビューについては、46を参照してください。いくつかの研究は、ロボットデバイスの制御信号を導き出すために、ブレイン・コンピュータ・インターフェース(BCI)システムの一部としてfNIRSを使用することに焦点を当てています47,48。この研究分野もfNIRS信号の処理に依存していますが、その目標は異なり、主に患者の意図(重度の運動障害のある患者など)を解読することに焦点を当てています。
本稿で紹介するパイロット研究は、下肢のリハビリテーションにおけるロボットシステムの効果を調査するための初期取り組みの一環である。このロボットは、日常的な多関節運動のトレーニングを含むターゲット指向の下肢リハビリテーションを提供するだけでなく、下肢の単一関節(膝や足首など)に治療を提供する(つまり、ボトムアップのリハビリテーションプログラムを実施する)ことができます。
この研究は、下肢の多関節ポインティング運動の実行中にfNIRSデータの取得を必要とする実験プロトコルの実現可能性を調査することを目的としていました。本研究におけるデータ取得期間は6分に制限されており、一般的なfNIRSプロトコルよりも短くなっています。これは、特に可動性や筋力が制限されている患者において、この研究の実用性と臨床的応用性を高めることを目的として行われた意図的な選択でした。また、このような複雑な多関節運動のfNIRS相関を特定し、ロボットの支援によって脳の活性化がどのように調節されているかについての洞察を得ることも興味深いポイントでした。この目的のために、同じ参加者で、ロボット支援なしとロボット支援ありの2つの実験セッションを実施しました。最後に、この研究は、ロボット療法の対象となる運動中の脳の活性化の記録プロトコルの実現可能性と評価の観点から、将来の研究の基礎を確立するために、健康な被験者に焦点を当てたことに注意することが重要です。
装置
下肢のリハビリテーションを行うように設計されたポータブルロボット( 図1参照)を使用して実験を行いました。ロボットは3Dで到達可能なワークスペースを備えており、コンパクトで軽量で、重量は約35ポンドであるため、持ち運びや設置が簡単です。
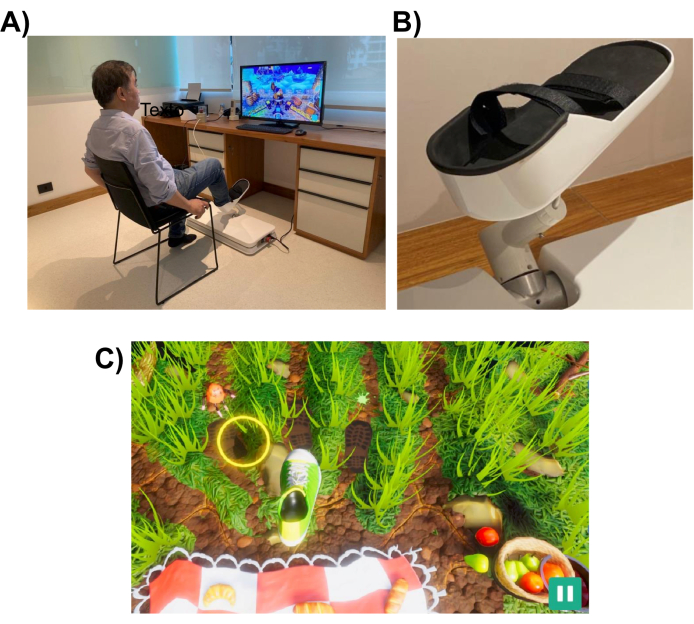
図1:実験装置。 (A)下肢用に設計されたロボットシステム(床に設置)。ボランティアが右足でインターフェースを利用している様子が描かれています。(B)ロボットシステムへの取り付けを可能にする被験者の足の支持構造。(C)ピクニックゲームのスクリーンショット。ゲームの目的は、足(緑と白の靴)をターゲット(黄色の円)に移動することです。 この図の拡大版をご覧になるには、ここをクリックしてください。
このロボットシステムは、指差しや蹴りなどの日常的な作業と同様の下肢の動きを患者が行うのを支援するように設計されています。インタラクティブなバーチャルリアリティゲームを使用しており、ロボットデバイスの前に設置されたコンピューターモニターまたはテレビ画面に表示されます( 図1を参照)。ロボットエンドエフェクタは患者の下肢(足首など)に取り付けられ、その位置は画面上のカーソルの位置にマッピングされます。典型的なゲームは、患者の運動ターゲット(例えば、指し示す物体やボールを蹴る場所)を示す。
移動タスクを完了するために、ロボットは、完全な支援からなしまでの範囲のレベルの支援で患者を支援する場合があります。ロボット支援のレベルは、患者の運動障害のレベルに基づいて、各リハビリテーションセッションの開始時に選択されます。被験者が行った動きは、患者のパフォーマンスをスコアリングし、パフォーマンスに関するフィードバック(ROM、動きの数、ロボット支援のレベルなど)を提供するためにゲームによって使用されます。ゲームは、患者の興味と注意を維持するために、インタラクティブで楽しいように設計されています。この研究では、参加者は「ピクニックゲーム」をプレイし、プレイヤーは昆虫がタオルに到達して食べ物を盗むのを阻止しなければなりませんでした(スクリーンショットは 図1の下部パネルを参照)。
データ取得は、2つの異なる連続波オプトード(760 nmおよび850 nm)、8つのデュアルチップLED光源、および8つのデュアルチップアクティブ検出器を備えたポータブルfNIRS取得システムを使用して実行しました。信号は、10.17Hzのサンプリングレートを使用して取得されました。ラップトップは、fNIRSシステムによって作成されたWi-Fiネットワークを使用して、キャリブレーションの最適化と信号記録に使用されました。
キャップを使用して、オプトードを所定の位置に保持しました。線源と検出器は、10-10 国際脳波システムに従ってグリッド空間分布に配置されました。各fNIRSチャネルは、オプトード間距離が約30 mmのソース-検出器ペアによって定義されました。オプトードは、 図2に示す位置の補助モーター、プリモーター、およびモーター領域の上に配置されました。チャンネルの総数は28で、そのうち8つは短距離チャンネルで、光ファイバーアダプタを使用して1つの検出器に結合されていました。ハードウェアの多重化設定により、1つの検出器のみを使用して、すべてのソースから短距離情報を取得することができます。
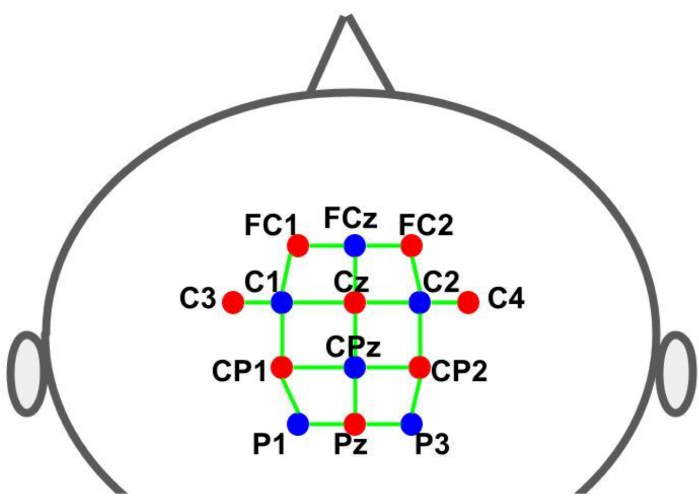
図2:10-10脳波システムを使用したモンタージュレイアウト。 文字と数字は、ソース/検出器の位置を示します。赤と青のドットは、それぞれ光源と検出器のオプトードを表します。緑色の線は、光源と検出器のペアで構成されるfNIRSチャンネルを表しています。 この図の拡大版をご覧になるには、ここをクリックしてください。
実験計画法
この実験は、被験者の動きに対するロボットの支援レベルが異なる2つの異なる実験条件で行われました。第1の条件では、ロボットは被験者の動きを補助しないようにプログラムされ、第2の条件では、ロボットは被験者の足と脚の動きを制御する(ロボット支援運動)ようにプログラムされました。
各実験は、 図3に示すように、運動タスク(ゲームをプレイする-30秒)と休息(30秒)の交互のサイクルを含むブロック設計パラダイムに従っていました。各フェーズ(プレイ/ゲームまたは休憩)の開始と終了は、コンピューター画面を介して被験者に視覚的に信号されました。休止フェーズ中に、一時停止を示すメッセージが表示されました。各サイクル (プレイ/ゲーム + 休憩) の持続時間は 60 秒で、6 回繰り返されたため、合計実行時間は 360 秒 (6 分) になりました。
参加者は「ピクニックゲーム」を行い、昆虫がタオルに手を伸ばして食べ物を盗むのを防ぐことを目的としました。このゲームでは、指定されたホームターゲット(初期位置)から始まり、ホームターゲットに戻る前に、3つの外側のターゲットのうちの1つに向かって伸びるという、一連の下肢の動きが含まれていました。画面上では、外側のターゲットが動く昆虫のアニメーションとして視覚的に表現され、参加者は手を伸ばして踏まなければなりませんでした。外側に到達するターゲットは3つあり、それぞれが同じ回数ランダムに提示され、すべての動きに共通のホームターゲットがいました。ホームターゲットから外側のターゲットの位置まで足が移動するのに必要な距離は、約26cmの円弧を形成しました。運動課題は、膝の屈伸、足底屈曲、背屈運動の協調を必要とする多関節運動の実行を必要としました。
fNIRSのデータ記録は、ロボットが生成したトランジスタ-トランジスタ-ロジック(TTL)パルスを介して、ゲームが被験者に提示する視覚刺激と同期しました。パルスは、各フェーズ(プレイ/ゲームおよび休息)の開始時に生成されました。したがって、すべてのタイミング制御はゲームによって行われ、参加者に視覚的な手がかり(ターゲット)を提供して各動きを開始し、TTL信号をfNIRSシステムに送信して脳活動の記録をマークし、実験で必要に応じてロボット制御システムに信号を送信して動作支援を開始します。
Protocol
Representative Results
Discussion
本実証研究では、健常者が下肢リハビリテーションロボットを用いて様々な動きで運動している間に、fNIRSデータを用いて脳活性化マッピングを推論する可能性を検討しました。成人の典型的なfNIRS記録セッションは、6分54秒以上です。ただし、リハビリテーションの設定で記録を実行可能にするには、被験者の不必要な疲労と労力を避けるために、実験の全体的な期間を最…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この研究の意見、仮説、結論、および推奨事項は著者のものであり、必ずしも資金提供機関の意見を表すものではありません。JRSは、サンパウロ研究財団(FAPESP、助成金番号2021/05332-8、2018/04654-9、2018/21934-5、2023/02538-0)とジャクソン・シオネクの技術支援に感謝しています。AMMとVivax Ltdaは、FAPESP(サンパウロ研究財団)とFINETP(ブラジルイノベーション庁)に感謝しています。このプロジェクトは、FAPESP(助成金番号2018/09559-4)およびFINEP(助成金番号2019/09933-6)からの助成金で資金提供されました。
Materials
| 32 inch Smart TV | Samsung | N/A | TV connected to robot via HDMI cable |
| 8-detector silicon photodiode (SiPD) optodes for optical detection with dual tip | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| 8-source optodes bundle for optical illumination with dual tip | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| Aurora acquisition software | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| Laptop Precision XPS 13 | Dell Technologies (Round Rock, TX, USA) | ||
| nirsLAB fNIRS Analysis software | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| NIRSports2 fNIRS acquisition system | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | It has two different continuous wave optics (760 and 850 nm), 8 dual-ended LED sources and 8 dual-ended active detectors. |
| R | R-project.org (open source software) | https://www.r-project.org/ | |
| Standard cut cap, black color for up to 128 holders. | Easycap GmbH (Wörthsee, Germany) | https://www.easycap.de/ | |
| Vivax Assistive Rehabilitation Machine (ARM) | Vivax Ltda (São Paulo, Brazil) | https://vivaxbr.com/home/ | It is a portable robot designed to deliver lower limb rehabilitation. It has a 3D reachable workspace and is compact and light, weighing about 35 lb., which makes it easy to transport and to install. |
Riferimenti
- GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. Neurology. 18 (5), 439-458 (2019).
- GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. The Lancet. Neurology. 20 (10), 795-820 (2021).
- Huang, V. S., Krakauer, J. W. Robotic neurorehabilitation: a computational motor learning perspective. Journal of NeuroEngineering and Rehabilitation. 6, 5 (2009).
- Hobbs, B., Artemiadis, P. A Review of Robot-Assisted Lower-Limb Stroke Therapy: Unexplored Paths and Future Directions in Gait Rehabilitation. Frontiers in neurorobotics. 14, 19 (2020).
- Bertani, R., Melegari, C., De Cola, M. C., Bramanti, A., Bramanti, P., Calabrò, R. S. Effects of robot-assisted upper limb rehabilitation in stroke patients: a systematic review with meta-analysis. Neurological Sciences. 38 (9), 1561-1569 (2017).
- Warutkar, V., Dadgal, R., Mangulkar, U. R. Use of robotics in gait rehabilitation following stroke: A review. Cureus. 14 (11), e31075 (2022).
- Dipietro, L., et al. Changing motor synergies in chronic stroke. Journal of Neurophysiology. 98 (2), 757-768 (2007).
- Dipietro, L., et al. Learning, not adaptation, characterizes stroke motor recovery: evidence from kinematic changes induced by robot-assisted therapy in trained and untrained task in the same workspace. IEEE Trans Neural Syst Rehabil Eng. 20 (1), 48-57 (2012).
- Bosecker, C., Dipietro, L., Volpe, B., Krebs, H. I. Kinematic robot-based evaluation scales and clinical counterparts to measure upper limb motor performance in patients with chronic stroke. Neurorehabilitation and Neural Repair. 24 (1), 62-69 (2010).
- Krebs, H. I., et al. Robotic measurement of arm movements after stroke establishes biomarkers of motor recovery. Stroke. 45 (1), 200-204 (2014).
- Volpe, B. T., et al. Robotic devices as therapeutic and diagnostic tools for stroke recovery. Archives of Neurology. 66 (9), 1086-1090 (2009).
- Hogan, N., et al. Motions or muscles? Some behavioral factors underlying robotic assistance of motor recovery. Journal of Rehabilitation Research and Development. 43 (5), 605-618 (2006).
- Shadmehr, R., Wise, S. P. . The Computational Neurobiology of Reaching and Pointing: A Foundation for Motor Learning. , (2005).
- Dipietro, L., Poizner, H., Krebs, H. I. Spatiotemporal dynamics of online motor correction processing revealed by high-density electroencephalography. J Cogn Neurosci. 26 (9), 1966-1980 (2014).
- Krebs, H., et al. Rehabilitation robotics: Performance-based progressive robot-assisted therapy. Autonomous Robots. 15, 7-20 (2003).
- Colombo, G., Joerg, M., Schreier, R., Dietz, V. Treadmill training of paraplegic patients using a robotic orthosis. Journal of Rehabilitation Research and Development. 37 (6), 693-700 (2000).
- Girone, M., et al. A Stewart platform-based system for ankle telerehabilitation. Autonomous Robots. 10, 203-212 (2001).
- Saglia, J. A., Tsagarakis, N. G., Dai, J. S., Caldwell, D. G. A high-performance redundantly actuated parallel mechanism for ankle rehabilitation. The International Journal of Robotics Research. 28 (9), 1216-1227 (2009).
- Yoon, J., Ryu, J. A novel reconfigurable ankle/foot rehabilitation robot. , 2290-2295 (2005).
- Ruthenberg, B. J., Wasylewski, N. A., Beard, J. E. An experimental device for investigating the force and power requirements of a powered gait orthosis. Journal of Rehabilitation Research and Development. 34 (2), 203-213 (1997).
- Forrester, L. W., et al. Clinical application of a modular ankle robot for stroke rehabilitation. NeuroRehabilitation. 33 (1), 85-97 (2013).
- Díaz, I., Gil, J. J., Sánchez, E. Lower-limb robotic rehabilitation: Literature review and challenges. Journal of Robotics. 2011, 759764 (2011).
- Zhang, X., Yue, Z., Wang, J. Robotics in lower-limb rehabilitation after stroke. Behavioural Neurology. 2017, 3731802 (2017).
- Zhang, M., Davies, T. C., Xie, S. Effectiveness of robot-assisted therapy on ankle rehabilitation – a systematic review. Journal of NeuroEngineering and Rehabilitation. 10, 30 (2013).
- Lo, K., Stephenson, M., Lockwood, C. Effectiveness of robotic assisted rehabilitation for mobility and functional ability in adult stroke patients: a systematic review protocol. JBI Database of Systematic Reviews and Implementation Reports. 15 (1), 39-48 (2017).
- Belda-Lois, J. M., et al. Rehabilitation of gait after stroke: a review towards a top-down approach. Journal of NeuroEngineering and Rehabilitation. 8, 66 (2011).
- Bortole, M., et al. The H2 robotic exoskeleton for gait rehabilitation after stroke: early findings from a clinical study. Journal of NeuroEngineering and Rehabilitation. 12, 54 (2015).
- Banala, S. K., Kim, S. H., Agrawal, S. K., Scholz, J. P. Robot assisted gait training with active leg exoskeleton (ALEX). IEEE Transactions on Neural Systems and Rehabilitation Engineering. 17 (1), 2-8 (2009).
- Bartenbach, V., Wyss, D., Seuret, D., Riener, R. A lower limb exoskeleton research platform to investigate human-robot interaction. 2015 IEEE International Conference on Rehabilitation Robotics (ICORR). 2015, 600-605 (2015).
- Hinkle, J. L., et al. Poststroke fatigue: Emerging evidence and approaches to management: A scientific statement for healthcare professionals from the American heart association. Stroke. 48 (7), e159-e170 (2017).
- Balardin, J. B., Zimeo Morais, G. A., Furucho, R. A., Trambaiolli, L. R., Sato, J. R. Impact of communicative head movements on the quality of functional near-infrared spectroscopy signals: negligible effects for affirmative and negative gestures and consistent artifacts related to raising eyebrows. Journal of Biomedical Optics. 22 (4), 4601 (2017).
- Nazeer, H., Naseer, N., Mehboob, A., Khan, M. J., Khan, R. A., Khan, U. S., Ayaz, Y. Enhancing classification performance of fNIRS-BCI by identifying cortically active channels using the z-score method. Sensors. 20 (23), 6995 (2020).
- Ayaz, H., et al. Optical imaging and spectroscopy for the study of the human brain: status report. Neurophotonics. 9, S24001 (2022).
- Chen, W. L., et al. Functional near-infrared spectroscopy and its clinical application in the field of neuroscience: Advances and future directions. Frontiers in Neuroscience. 14, 724 (2020).
- Yamamoto, K., Miyata, T., Onozuka, A., Koyama, H., Ohtsu, H., Nagawa, H. Plantar flexion as an alternative to treadmill exercise for evaluating patients with intermittent claudication. European Journal of Vascular and Endovascular Surgery. 33 (3), 325-329 (2007).
- Formenti, D., et al. Effects of knee extension with different speeds of movement on muscle and cerebral oxygenation. PeerJ. 6, 5704 (2018).
- Miyai, I., et al. Cortical mapping of gait in humans: a near-infrared spectroscopic topography study. NeuroImage. 14 (5), 1186-1192 (2001).
- Miyai, I., et al. Premotor cortex is involved in restoration of gait in stroke. Annals of Neurology. 52 (2), 188-194 (2002).
- Mihara, M., et al. Sustained prefrontal activation during ataxic gait: a compensatory mechanism for ataxic stroke?. NeuroImage. 37 (4), 1338-1345 (2007).
- Rea, M., et al. Lower limb movement preparation in chronic stroke: A pilot study toward an fNIRS-BCI for gait rehabilitation. Neurorehabilitation and Neural Repair. 28 (6), 564-575 (2014).
- Holtzer, R., Verghese, J., Allali, G., Izzetoglu, M., Wang, C., Mahoney, J. R. Neurological gait abnormalities moderate the functional brain signature of the posture first hypothesis. Brain Topography. 29 (2), 334-343 (2016).
- Kim, H. Y., Yang, S. P., Park, G. L., Kim, E. J., You, J. S. Best facilitated cortical activation during different stepping, treadmill, and robot-assisted walking training paradigms and speeds: A functional near-infrared spectroscopy neuroimaging study. NeuroRehabilitation. 38 (2), 171-178 (2016).
- Khan, H., Nazeer, H., Engell, H., Naseer, N., Korostynska, O., Mirtaheri, P. Prefrontal cortex activation measured during different footwear and ground conditions using fNIRS-A case study. 2021 IEEE International Conference on Artificial Intelligence and Mechatronics Systems (AIMS). , 1-6 (2021).
- Lin, P. Y., Chen, J. J., Lin, S. I. The cortical control of cycling exercise in stroke patients: an fNIRS study). Human Brain Mapping. 34 (10), 2381-2390 (2013).
- Yang, M., Yang, Z., Yuan, T., Feng, W., Wang, P. A systemic review of functional near-infrared spectroscopy for stroke: Current application and future directions. Frontiers in Neurology. 10, 58 (2019).
- Berger, A., Horst, F., Müller, S., Steinberg, F., Doppelmayr, M. Current state and future prospects of EEG and fNIRS in robot-assisted gait rehabilitation: A brief review. Frontiers in Human Neuroscience. 13, 172 (2019).
- Khan, R. A., Naseer, N., Qureshi, N. K., et al. fNIRS-based Neurorobotic Interface for gait rehabilitation. J NeuroEngineering Rehabil. 15 (1), 7 (2018).
- Khan, H., Naseer, N., Yazidi, A., Eide, P. K., Hassan, H. W., Mirtaheri, P. Analysis of Human Gait Using Hybrid EEG-fNIRS-Based BCI System: A Review. Front. Hum. Neurosci. 14, (2020).
- Delpy, D. T., Cope, M. Quantification in tissue near-infrared spectroscopy. Philosophical Transactions of the Royal Society B: Biological Sciences. 352 (1354), 649-659 (1997).
- Huppert, T. J. Commentary on the statistical properties of noise and its implication on general linear models in functional near-infrared spectroscopy. Neurophotonics. 3, 010401 (2016).
- Alexandre, F., Heraud, N., Oliver, N., Varray, A. Cortical implication in lower voluntary muscle force production in non-hypoxemic COPD patients. PLoS One. 9 (6), 100961 (2014).
- Yoon, T., Vanden Noven, M. L., Nielson, K. A., Hunter, S. K. Brain areas associated with force steadiness and intensity during isometric ankle dorsiflexion in men and women. Experimental Brain Research. 232 (10), 3133-3145 (2014).
- Ciccarelli, O., et al. Identifying brain regions for integrative sensorimotor processing with ankle movements. Experimental Brain Research. 166 (1), 31-42 (2005).
- Udina, C., et al. Functional near-infrared spectroscopy to study cerebral hemodynamics in older adults during cognitive and motor tasks: A review. Frontiers in Aging Neuroscience. 11, 367 (2020).
- Thickbroom, G. W., Phillips, B. A., Morris, I., Byrnes, M. L., Mastaglia, F. L. Isometric force-related activity in sensorimotor cortex measured with functional MRI. Experimental Brain Research. 121 (1), 59-64 (1998).
- Derosière, G., Alexandre, F., Bourdillon, N., Mandrick, K., Ward, T. E., Perrey, S. Similar scaling of contralateral and ipsilateral cortical responses during graded unimanual force generation. NeuroImage. 85 (1), 471-477 (2014).
- Shi, P., Li, A., Yu, H. Response of the cerebral cortex to resistance and non-resistance exercise under different trajectories: A functional near-infrared spectroscopy study. Frontiers in Neuroscience. 15, 685920 (2021).
- Dettmers, C., et al. Relation between cerebral activity and force in the motor areas of the human brain. Journal of Neurophysiology. 74 (2), 802-815 (1995).
- Keisker, B., Hepp-Reymond, M. C., Blickenstorfer, A., Kollias, S. S. Differential representation of dynamic and static power grip force in the sensorimotor network. The European Journal of Neuroscience. 31 (8), 1483-1491 (2010).
- Harada, T., Miyai, I., Suzuki, M., Kubota, K. Gait capacity affects cortical activation patterns related to speed control in the elderly. Experimental Brain Research. 193 (3), 445-454 (2009).
- Saleh, S., et al. The role of premotor areas in dual tasking in healthy controls and persons with multiple sclerosis: An fNIRS imaging study. Frontiers in Behavioral Neuroscience. 12, 296 (2018).
- Bonnal, J., et al. Relation between cortical activation and effort during robot-mediated walking in healthy people: A functional near-infrared spectroscopy neuroimaging study (fNIRS). Sensors. 22 (15), 5542 (2022).
- Shibuya, K., Sadamoto, T., Sato, K., Moriyama, M., Iwadate, M. Quantification of delayed oxygenation in ipsilateral primary motor cortex compared with contralateral side during a unimanual dominant-hand motor task using near-infrared spectroscopy. Brain Research. 1210, 142-147 (2008).
- Dai, T. H., Liu, J. Z., Sahgal, V., Brown, R. W., Yue, G. W. Relationship between muscle output and functional MRI-measured brain activation. Experimental brain research. 140 (3), 290-300 (2001).
- Cabibel, V., Hordacre, B., Perrey, S. Implication of the ipsilateral motor network in unilateral voluntary muscle contraction: the cross-activation phenomenon. Journal of Neurophysiology. 123 (5), 2090-2098 (2020).
- Akselrod, M., Martuzzi, R., Serino, A., vander Zwaag, W., Gassert, R., Blanke, O. Anatomical and functional properties of the foot and leg representation in areas 3b, 1 and 2 of primary somatosensory cortex in humans: A 7T fMRI study. NeuroImage. 159, 473-487 (2017).
- Brigadoi, S., Cooper, R. J. How short is short? Optimum source-detector distance for short-separation channels in functional near-infrared spectroscopy. Neurophotonics. 2 (2), 025005 (2015).
- Funahashi, S. Prefrontal contribution to decision-making under free-choice conditions. Frontiers in Neuroscience. 11, 431 (2017).
- Simon, S. R., Meunier, M., Piettre, L., Berardi, A. M., Segebarth, C. M., Boussaoud, D. Spatial attention and memory versus motor preparation: premotor cortex involvement as revealed by fMRI. Journal of Neurophysiology. 88 (4), 2047-2057 (2002).
- Desmurget, M., Sirigu, A. A parietal-premotor network for movement intention and motor awareness. Trends in Cognitive Sciences. 13 (10), 411-419 (2009).
- Nachev, P., Kennard, C., Husain, M. Functional role of the supplementary and pre-supplementary motor areas. Nature reviews. Neuroscience. 9 (11), 856-869 (2008).
- Thoenissen, D., Zilles, K., Toni, I. Differential involvement of parietal and precentral regions in movement preparation and motor intention. The Journal of neuroscience: the official journal of the Society for Neuroscience. 22 (20), 9024-9034 (2002).
- Al-Quraishi, M. S., Elamvazuthi, I., Tang, T. B., Al-Qurishi, M., Adil, S. H., Ebrahim, M. Bimodal data fusion of simultaneous measurements of EEG and fNIRS during lower limb movements. Brain Sciences. 11 (6), 713 (2021).
- Bishnoi, A., Holtzer, R., Hernandez, M. E. Brain Activation Changes While Walking in Adults with and without Neurological Disease: Systematic Review and Meta-Analysis of Functional Near-Infrared Spectroscopy Studies. Brain sciences. 11 (3), 291 (2021).
- Oh, S., Song, M., Kim, J. Validating attentive locomotion training using interactive treadmill: an fNIRS study. Journal of NeuroEngineering and Rehabilitation. 15 (1), 122 (2018).

