15.3:
Acqua: un acido e una base Bronsted-Lowry
15.3:
Acqua: un acido e una base Bronsted-Lowry
La reazione tra un acido di Brønsted-Lowry e l’acqua è chiamata ionizzazione acida. Ad esempio, quando il fluoruro di idrogeno si dissolve in acqua e ionizza, i protoni vengono trasferiti dalle molecole di fluoruro di idrogeno alle molecole d’acqua, producendo ioni di idronio e ioni fluoruro:
La ionizzazione di base di una specie si verifica quando accetta protoni da molecole d’acqua. Nell’esempio seguente, le molecole di piridina, C5NH5, subiscono ionizzazione di base quando vengono sciolte in acqua, producendo idrossido e ioni piridinium:
Le precedenti reazioni di ionizzazione suggeriscono che l’acqua può funzionare sia come base (come nella sua reazione con fluoruro di idrogeno) che come acido (come nella sua reazione con l’ammoniaca). Le specie in grado di donare o accettare protoni sono chiamate anfiprotiche, o più in generale, amphoteric, un termine che può essere usato per acidi e basi per definizioni diverse da quella di Brønsted-Lowry. Le equazioni seguenti mostrano le due possibili reazioni acido-base per due specie anfiprotiche, lo ione bicarbonato e l’acqua:
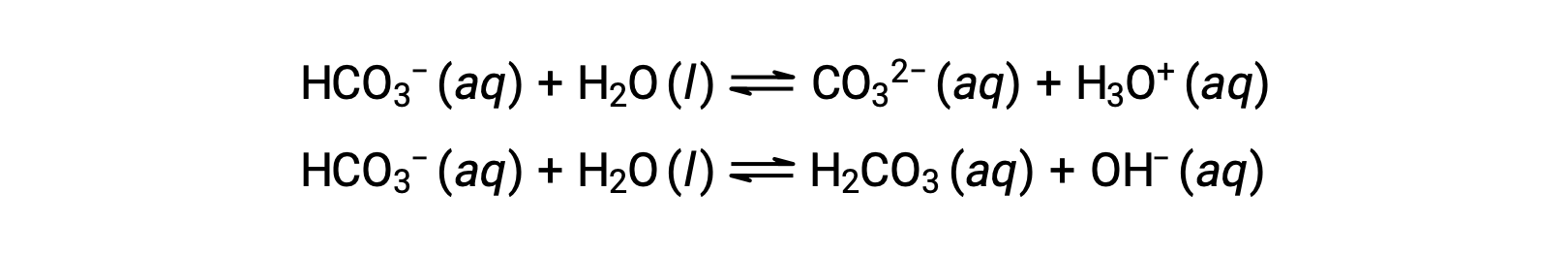
La prima equazione rappresenta la reazione del bicarbonato come acido con acqua come base, mentre la seconda rappresenta la reazione del bicarbonato come base con acqua come acido. Quando il bicarbonato viene aggiunto all’acqua, entrambi questi equilibri vengono stabiliti simultaneamente e la composizione della soluzione risultante può essere determinata attraverso opportuni calcoli di equilibrio. Allo stato liquido, le molecole di una sostanza anfiprotica possono reagire l’una con l’altra come illustrato per l’acqua nelle equazioni seguenti:
Il processo in cui le molecole simili reagiscono agli ioni di resa è chiamato autoionizzazione. L’acqua liquida subisce un’autoionizzazione in misura molto lieve; a 25 °C, circa due molecole d’acqua su miliardi vengono ionizzate. L’estensione del processo di autoionizzazione dell’acqua si riflette nel valore della sua costante di equilibrio, la costante ioni-prodotto per l’acqua, KW:
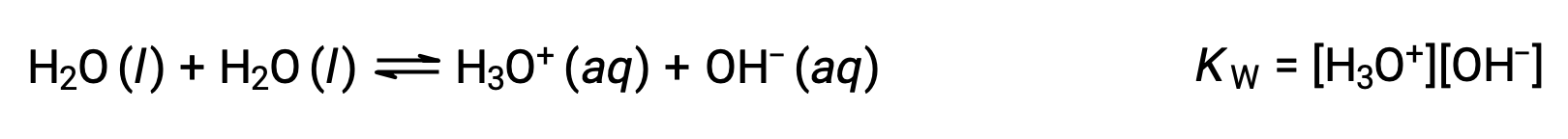
La leggera ionizzazione dell’acqua pura si riflette nel piccolo valore della costante di equilibrio; a 25 °C, KW ha un valore di 1,0 × 10−14.
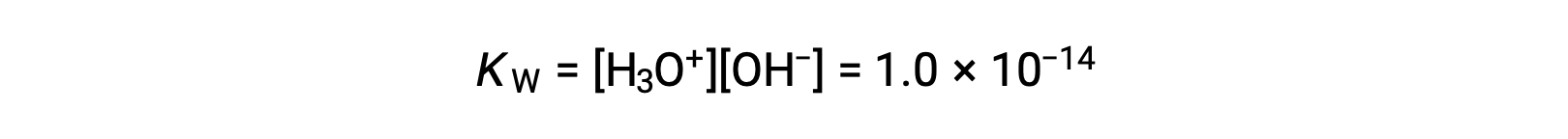
Il processo è endotermico, e quindi l’entità della ionizzazione e le concentrazioni risultanti di ioni idronio e ioni idrossido aumentano con la temperatura. Ad esempio, a 100 °C, il valore di KW è di circa 5,6 × 10−13, circa 50 volte superiore al valore a 25 °C.
L’autoionizzazione dell’acqua produce lo stesso numero di ioni idronio e idrossido. Pertanto, in acqua pura a 25 °C:
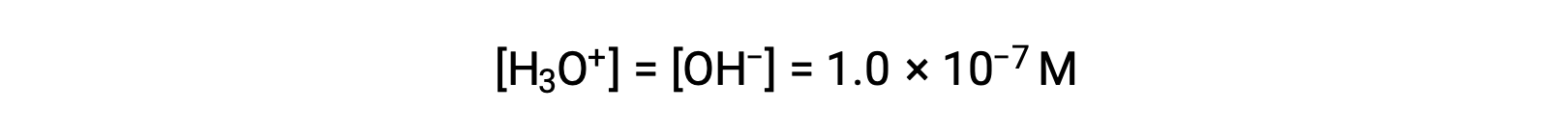
Le concentrazioni di questi ioni in una soluzione sono spesso determinanti critici delle proprietà della soluzione e dei comportamenti chimici degli altri suoi soluti, e un vocabolario specifico è stato sviluppato per descrivere queste concentrazioni in termini relativi. Una soluzione è neutra se contiene uguali concentrazioni di ioni idronio e idrossido; acido se contiene una maggiore concentrazione di ioni idronio rispetto agli ioni idrossido; e di base se contiene una concentrazione minore di ioni idronio rispetto agli ioni idrossido.
Riepilogo delle relazioni per soluzioni acide, di base e neutre
| Classificazione | Concentrazioni relative di ioni | pH a 25 °C |
| Acido | [H3O+] > [OH−] | pH < 7 |
| Neutro | [H3O+] = [OH−] | pH = 7 |
| Base | [H3O+] < [OH−] | pH > 7 |
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.1: Acidi e basi Brønsted-Lowrye Sezione 14.2: pH e pOH.
