הדמיית תהודה מגנטית מותחת דיפוזי בניתוח של מחלות ניווניות
Summary
המותחת דיפוזי הדמיה (DTI) בעצם משמשת ככלי מבוסס MRI כדי לזהות<em> In vivo</em> מיקרו של המוח ותהליכים פתולוגיים בשל הפרעות נוירולוגיות בתוך החומר לבן במוח. ניתוחים מבוססי DTI לאפשר ליישום למחלות מוח גם ברמת הקבוצה והן בנתונים נושא אחד.
Abstract
המותחת דיפוזי הדמיה (DTI) טכניקות לספק מידע על תהליכי microstructural של החומר הלבן במוח (WM) in vivo. היישומים הנוכחיים נועדו לחקור הבדלים של דפוסי מעורבות WM במחלות שונות במוח, הפרעות ניווניות במיוחד, על ידי שימוש בניתוחי DTI שונים בהשוואה לביקורות תואמות.
ניתוח נתוני DTI מתבצע באופנה משתנה, כלומר השוואת voxelwise של מדדים אזוריים דיפוזיה מבוסס כיוון כגון אנאיזוטרופיה השבר (FA), יחד עם מעקב סיבים (FT) מלווה בנתונים סטטיסטיים אנאיזוטרופיה השבר tractwise (TFAS) ברמת הקבוצה במטרה כדי לזהות הבדלים באנגלים לאורך מבני WM, מכוון להגדרה של דפוסים אזוריים של שינויי WM ברמת הקבוצה. הפיכת שטח סטנדרטי stereotaxic היא תנאי הכרחי ללימודים בקבוצה ודורשת נתונים יסודיים עיבוד לשמר דבין תלות irectional. היישומים הנוכחיים מראים גישות טכניות מותאמים במיוחד לשימור של מידע כמותי וכיוונית במהלך נורמליזציה המרחבי בניתוח הנתונים ברמת הקבוצה. על בסיס זה, ניתן ליישם טכניקות FT לנתונים ממוצעים של קבוצה על מנת לכמת מדדי מידע כהגדרתו על ידי FT. בנוסף, יישום של שיטות DTI, כלומר בהבדלי FA-מפות לאחר יישור stereotaxic, בניתוח אורך על בסיס פרטני נושא לחשוף מידע על ההתקדמות של הפרעות נוירולוגיות. שיפור איכות נוספת של תוצאות מבוססות DTI ניתן להשיג במהלך עיבוד מקדים על ידי יישום של חיסול מבוקר של כיווני שיפוע עם רמות רעש גבוהות.
לסיכום, DTI משמש להגדרת pathoanatomy WM מובהק של מחלות שונות במוח על ידי שילוב של כל ניתוח מוח DTI מבוסס והמבוסס בדרכי.
Introduction
הדמיה מותח דיפוזיה במוח האנושי
העניין (WM) שטחים הלבנים במערכת העצבים המרכזית מורכבים מאקסונים צפופים בנוסף לסוגים שונים של neuroglia ואוכלוסיות קטנות אחרות של תאים. קרום axonal כמו גם את סיבי החלבון המיושרים היטב בתוך האקסון מגביל ניצב דיפוזיה מים לכיוון הסיבים, מה שמוביל לפיזור מים במוח אניסוטרופי WM 1. נדני המיאלין סביב האקסונים עשויים גם לתרום אנאיזוטרופיה עבור שניהם התוך תאיים ומים 2.
תיאור כמותי של אנאיזוטרופיה זה יכול להיות מזוהה על ידי מותח דיפוזי הדמיה (DTI). DTI מפיק תמונות של רקמות משוקלל עם המאפיינים המקומיים של microstructural דיפוזיה מים. את תמונת העוצמות-בכל עמדה הן מוחלשים, תלוי בכח ואת הכיוון של מה שנקרא שיפוע דיפוזיה המגנטי (מיוצג בB-הערך), כמו גם על מיקרו המקומי שבו מולקולות המים לפזר 3, דיפוזיה המקדם D, ערך סקלר:
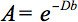
עם זאת, בנוכחות אנאיזוטרופיה בWM, כבר לא יכולה להיות מאופיינת דיפוזיה במקדם סקלרי אחת, אבל דורשת טנסור  אשר בקירוב הראשון מתאר את הניידות מולקולרית לאורך כל כיוון ומתאם בין הכיוונים אלה 4. אנאיזוטרופיה דיפוזיה נגרמת בעיקר על ידי הכיוון של קטעי סיבים בWM ומושפעת מתכונות מייקרו וmacrostructural. מהתכונות microstructural, ארגון intraaxonal נראה כי ההשפעה הגדולה ביותר על אנאיזוטרופיה דיפוזיה, מלבד הצפיפות של סיביםאריזת תא ND, מידת myelination, וקוטר סיב בודד. בקנה מידה מקרוסקופי, ההשתנות בכיוון של כל שטחי WM בvoxel ההדמיה משפיעה על מידת אנאיזוטרופיה 5 שלה.
אשר בקירוב הראשון מתאר את הניידות מולקולרית לאורך כל כיוון ומתאם בין הכיוונים אלה 4. אנאיזוטרופיה דיפוזיה נגרמת בעיקר על ידי הכיוון של קטעי סיבים בWM ומושפעת מתכונות מייקרו וmacrostructural. מהתכונות microstructural, ארגון intraaxonal נראה כי ההשפעה הגדולה ביותר על אנאיזוטרופיה דיפוזיה, מלבד הצפיפות של סיביםאריזת תא ND, מידת myelination, וקוטר סיב בודד. בקנה מידה מקרוסקופי, ההשתנות בכיוון של כל שטחי WM בvoxel ההדמיה משפיעה על מידת אנאיזוטרופיה 5 שלה.
במדידות DTI טיפוסיות, את ממדי voxel נמצאים בצו של מילימטרים. לפיכך, voxel תמיד מכיל את המידע הממוצע של מולקולות המים בתוך הנפח זיהה כי בדרך כלל מכסה מספר האקסונים, כמו גם את מולקולות מים הסמוכות. למרות סביבת multidirectional זה, DTI הוא רגיש לכיוון של הציר הראשי הגדול ביותר שמיישר לכיוון axonal הדומיננטי, כלומר תרומת axonal שולטת אות הנמדדת 2.
DTI מספק שני סוגים של מידע על הנכס של דיפוזיה מים: ראשית, כיוון שאינו תלויה במידה של אנאיזוטרופיה דיפוזיה 5 ושנית, הכיוון העיקרי של המים בדיפוזיה מתאר לעצמיvoxels הדואר, כלומר הנטייה דיפוזיה 6.
הפרוטוקולים הנוכחיים אמורים לספק מסגרת של טכניקות ניתוח DTI להשוואת כמותית של קבוצות נושא ברמת הקבוצה, כפי שמתוארים בחלק הבא.
כימות של נכסי דיפוזיה – ניתוח פרמטרים
האלמנטים של טנסור הסימטרי ניתן למדוד על ידי הדרגתיים דיפוזיה יחד לפחות שישה כיוונים הלא קוליניאריות ולא coplanar כך שB (משוואת 1) הפך למותח, וכתוצאה מכך הנחתה אות
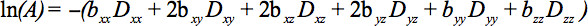
משוואה זו דורשת חשבונאית לאינטראקציות אפשריות בין הדמיה והדרגות דיפוזיה המיושמות בכיוונים מאונך (מבחינת קרוס) ואפילו בין הדרגות הדמיה שחלותבכיוונים מאונך 4.
טנסור דיפוזיה מהדרגה השנייה  תמיד יכול להיות diagonalized משאיר רק שלושה אלמנטים שאינם אפס לאורך האלכסון הראשי של טנסור, כלומר הערכים העצמיים (
תמיד יכול להיות diagonalized משאיר רק שלושה אלמנטים שאינם אפס לאורך האלכסון הראשי של טנסור, כלומר הערכים העצמיים ( 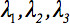 ). הערכים העצמיים משקפים את הצורה או תצורה של אליפסה. היחסים מתמטיים בין הקואורדינטות העיקריות של אליפסה ומסגרת המעבדה מתוארים על ידי וקטורים העצמיים
). הערכים העצמיים משקפים את הצורה או תצורה של אליפסה. היחסים מתמטיים בין הקואורדינטות העיקריות של אליפסה ומסגרת המעבדה מתוארים על ידי וקטורים העצמיים 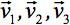
מאחר שיש כמה אתגרים בהצגת נתונים מותחים, הרעיון של ellipsoids דיפוזיה הוצע 3. את Eigendiffusivities של דואר אלהllipsoids מייצג את מקדמי דיפוזיה unidimensional בכיוון העיקרי של diffusivities של המדיום, כלומר הציר הראשי של אליפסה מייצג את כיוון ההתפשטות העיקרי בvoxel אשר עולה בקנה אחד עם הכיוון של הסיבים, ואילו האקסצנטרית של אליפסה מספק מידע על מידת אנאיזוטרופיה והסימטריה שלו. לכן, יכולים להיות מוגדרים מדדי אנאיזוטרופיה דיפוזיה כגון אנאיזוטרופיה השבר (FA) 7.
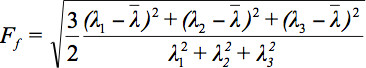
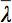 הוא ממוצע אריתמטי של כל הערכים העצמיים.
הוא ממוצע אריתמטי של כל הערכים העצמיים.
גישה נוספת היא להשתמש בכיוון העיקרי של טנסור דיפוזיה כדי לטפל בקישוריות WM של המוח, המקבילה לapproa tractographyפרק שבו יש כוונה לחקור אילו חלקים של המוח מחובר זה לזה. בהנחת שהכיוון של הרכיב המרכזי של טנסור דיפוזיה מייצג את הכיוון של שטחי axonal הדומיננטיים, שדה וקטורי 3-D מסופק בו כל וקטור מייצג את כיוון הסיבים. נכון לעכשיו, יש כמה גישות שונות כדי לשחזר קטעי WM אשר יכול להיות מחולק לשני סוגים: הסוג הראשון מבוסס על אלגוריתמי התפשטות קו באמצעות המידע מותח המקומי עבור כל שלב של התפשטות מערכת סיבי 2,8,9. הקטגוריה השנייה מבוססת על מזעור אנרגיה העולמית כדי למצוא את הנתיב האנרגטי החיובי ביותר בין שני אזורי WM, וכתוצאה מכך הגישה לסטטיסטיקה מרחביים המבוססת על מערכת (TBSS) 10 בו נעשה שימוש באלגוריתמים אחרים כגון נתונים סטטיסטיים אנאיזוטרופיה השבר tractwise (TFAS – ראה טקסט פרוטוקול, סעיף 2.4)..
הפיכת דוכן stereotaxicארד החלל
כמו בשיטות MRI מתקדמות אחרות, DTI-ומחקרים מבוססי FT בהקשר קליני להמשיך את המטרה הסופית לקטלג מורפולוגיה המוח של המטופל על מנת להקל על תהליך האבחון מבוסס על כמה אפליה מדד 11. מחקרים ברמת הקבוצה הם רלוונטיים ביותר אם הפנוטיפ הקליני הנפוץ אמור להיות בשל נזק לאחד או יותר מאזורים מסוימים במוח או רשת neuroanatomical ספציפית. כאן, עם הממוצע של תוצאות עבור נבדקים שונים הוא שימושי כדי להעריך דפוסים נפוצים של שינויי microstructural. לכל אחד יש מוח אדם להיות מועבר לתוך חלל stereotaxic כך, בשלב שני, בממוצע אריתמטי של התוצאות ברמת voxel-by-voxel אפשרי. נורמליזציה המרחבי אפשרה למיצוע אריתמטי של התוצאות המתקבלות מנושאים שונים על מנת לשפר את יחס אות לרעש (SNR) ולבצע השוואה של דגימות של חולים והמשךrols על מנת לנתח pathoanatomy חישובית של הפרעה מסוימת, למשל מחלות ניווניות אשר מזוהה עם העמדת של מערכת מסוימת במוח.
הגישה המוקדמת של נורמליזציה למרחב stereotaxic טופל על ידי 12 הציעה אלגוריתם לשינוי אטלס סטנדרטי הכולל זיהוי של אתרים שונים במוח וטיפי טיפין דרוג של רביעים מוח. כיום, רוב חבילות ניתוח נתונים המתקדמות MRI להשתמש נורמליזציה לנוירולוגיות מונטריאול המכון (משרד התשתיות הלאומי) stereotaxic שטח 13. לשינוי הזה, אלגוריתמי רישום מוח חצי אוטומטיים ואוטומטיים תוך שימוש בתבניות ספציפיות לימוד פותחו 14,15. בDTI, יש תשומת לב מיוחדת להיגרר לשמירת המידע כיוונית במהלך תהליך הנורמליזציה 16,17. היישום של שינויים מרחביים לתמונות DT-MR שנדרש לנורמליזציה המרחביאוספים של ערכות נתונים הוא, בניגוד לתמונות שיטתיות השתאה, מסובכות על ידי העובדה שהזיות טרופות מכילות מידע orientational אשר מושפע שוב על ידי השינוי. השפעה זו חייבת להיות מטופלת על מנת להבטיח את התקינות אנטומית של התמונה השתנתה. הנה, טכניקות ליישום שינויי affine לערכות נתונים DTI מוצגות.
יישום של DTI למחלות מוח
ההשוואה של נתוני DTI אורכי דורשת יישור / רישום של הנתונים של נושא אחד בין זה לזה. בהקשר זה, שימור המידע כיוונית הכרחי (כלומר סיבוב של טנסור דיפוזיה במהלך תמורות affine). יישומים אפשריים להפרעות ניווניות כבר דיווחו בעבר (למשל 18,19).
DTI כבר נקבע ככלי טכני לא פולשנית חזק לחקור in vivo neuropathology של שטחים עצביים WM (למשל 11,20,21,22). מדדים כמותיים המבוססים על DTI של תהליך דיפוזיה, למשל אנגלי, שכבר הוכח כסמנים רגישים ללימוד מגוון רחב של פתולוגיות WM, כגון שבץ 20, טרשת נפוצה 23, amyotrophic 24 טרשת לרוחב, בן 25, מחלת אלצהיימר 26 , וכמה הפרעות WM 27,28 אחרות.
בנוסף, ניתן להשתמש DTI עם FT לזהות קטעי WM 23. טכניקה זו, ועדיין לא בשימוש קליני שגרתי, מתגלה ככלי רב עוצמה להערכה של הפרעות במסלול ספציפי במחל נוירולוגית. בתוך השטחים שזוהו, מדדי כמותיים MRI שונים הנגזרים מDTI ורכישות נוספות (למשל תמונות ו / או העברת המגנטיזציה (MT) הדמיה T2 משוקללות) שהם בחינה אנטומית coregistered לנתוני DTI ניתן היה למדוד. הנני, כל אחד יכול להיות מדד Calculated כפונקציה של מיקום בתוך המערכת, המתייחס לחלקות המתארות וריאציה המרחבי שלהם, כמו פרופילים בדרכי.
בסריקות הבאות, אדם DTI שבוצעו על 1.5 טסלה MRI-סורקים (Siemens Medical, Erlangen, גרמניה) הייתה בשימוש כדי לחקור את הפוטנציאל של טכניקות ניתוח שונות לאיתור ליקויים בחומר לבן בקבוצות חולה, כמו גם ביחידים. לאחר בדיקת איכות אוטומטית לחיסולה של תנועת כרכים-פגומים ונפחים עם סוגים אחרים של חפצים, נהלים סטנדרטיים postprocessing הכנת נתוני DTI עבור הניתוח ברציפות. ניתוח גישות שונות שתודגמנה בחלק הבא, כלומר המוח הראשון, המבוסס כולו סטטיסטיקה מרחבית (WBSS), שני, FT, וסטטיסטיקת השבר שלישית, Tractwise אנאיזוטרופיה (TFAS). WBSS היא שיטה שפועלת באנלוגיה לmorphometry מבוסס voxel (VBM) שהוא בדרך כלל ידוע כmorphometry מבוסס voxel / סטטיסטיקה על נתוני DTI (VBM / DTI) <eמ '>. VBM הוא שיטה הפועלת על מקור תמונות שבו הבדלים בניגוד ניגוד בסריקות נפרדות צריכים להיפתר תוך WBSS הוא שיטה המשתמשת בהשוואת voxelwise של פרמטר פיזי. לכן, על אף אלגוריתמי דומה, מינוח המבדיל WBSS וVBM ישמש את הבאים.
Protocol
Representative Results
Discussion
מיצוע בין הנושא של DTI נתונים ניתן להשיג ביחס למשרעת דיפוזיה (על ידי שימוש במידע FA) וכיוון דיפוזיה (המבוסס על FT), בהתאמה. ממוצע של FA מפות מאפשר השוואה הסטטיסטית של קבוצות בכפוף ידי WBSS וTFAS. מסגרת המתודולוגית זה נותן מבוא לטכניקות DTI עם מיצוע בין הנושא והשוואה לקבוצה. נורמל?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
חלקים מהעבודה זו, כלומר מחקר על QC ותיקון לכיווני שיפוע פגום ביישום על נתונים של חולים עם הפרעות ההיפרקינטיות, נתמכו על ידי HD הרשת האירופית (EHDN פרויקט 070). בסריקות MRI במחקר מסוים זה נרכשו כחלק מעוקבת אתר לונדון Track-HD.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
References
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

