عزل خالية من التسمية والإثراء من خلال خلايا تلامس Dielectrophoresis
Summary
dielectrophoresis تماس (CDEP) يحقق الفرز وإثراء الجزيئات عبر خصائص عازلة الذاتية الخاصة بهم. قنوات القطب فلويديك استبدال الأقطاب المعدنية التقليدية لDEP، تناسب CDEP لعدم الإضرار-توصيف العقيمة والفرز من الجزيئات البيولوجية. ونحن لشرح كيفية إعداد microdevice CDEP وإجراء توصيف الخلايا والتجارب الفرز.
Abstract
Dielectrophoresis (DEP) هي الظاهرة التي الاستقطاب الجزيئات في مجال كهربائي غير موحدة تخضع حركة متعدية، ويمكن استخدامها لتوجيه حركة المجهرية الدقيقة في سطح علامة مستقلة الطريقة. تقليديا، وتشمل الأجهزة DEP الأقطاب المعدنية مستو منقوشة في القناة العينة. هذا النهج يمكن أن تكون مكلفة وتتطلب بيئة غرف الأبحاث المتخصصة. مؤخرا، تم تطوير نهج خالية من الاتصال يسمى dielectrophoresis تماس (CDEP). يستخدم هذا الأسلوب مبدأ الكلاسيكي DEP مع تجنب الاتصال المباشر بين الأقطاب وعينة من الزخرفة أقطاب فلويديك وقناة عينة من polydimethylsiloxane واحد (PDMS) الركيزة، ويحتوي التطبيق كاستراتيجية ميكروفلويديك السريع المصممة لفرز وإثراء المجهرية الدقيقة. فريدة من نوعها لهذا الأسلوب هو أن يتم إنشاء الحقل الكهربائي عبر قنوات القطب فلويديك تحتوي على السائل موصل للغاية، والتي يتم فصلها عنقناة عينة من حاجز رقيقة عازلة. لأن أقطاب معدنية عدم الاتصال مباشرة العينة، وتجنب التحليل الكهربائي، القطب التبطين، وتلوث العينة. بالإضافة إلى ذلك، وهذا يتيح عملية تلفيق غير مكلفة وبسيطة.
CDEP وبالتالي مناسبة تماما لمعالجة الجزيئات البيولوجية الحساسة. قوة dielectrophoretic بناء على الجزيئات لا يتوقف فقط على التدرجات المكانية للحقل الكهربائية المولدة حسب التصميم للتخصيص للهندسة الجهاز، ولكن الخصائص الفيزيائية الحيوية الجوهرية للخلية. على هذا النحو، CDEP هي تقنية خالية من التسمية التي يتجنب تبعا المؤشرات الحيوية، وأعرب سطح الجزيئية التي يمكن التعبير بنسب مختلفة ضمن مجموعة من السكان، في حين لا يزال يسمح توصيف، والإثراء، وفرز bioparticles.
هنا، ونحن لشرح أساسيات تصنيع والتجريب باستخدام CDEP. نفسر إعداد بسيطة من شريحة CDEP باستخدام الطباعة الحجرية الناعمةتقنيات ذ. نناقش الإجراء التجريبي لوصف تردد كروس من الجسيمات أو الخلية، والتردد الذي القوة dielectrophoretic هو صفر. أخيرا، علينا أن نظهر استخدام هذه التقنية لفرز خليط من خلايا سرطان المبيض والاستشعاع المجهرية (الخرز).
Introduction
تخصيب عينة بيولوجية والجسيمات الفرز غالبا ما يكون ضروريا لتحليلها لاحقا. 1 على سبيل المثال، عزل الخلايا نادرة من سوائل الجسم لها تطبيقات مهمة في الكشف عن السرطان والطب فردية. 2،3 وتقنيات تخصيب الأكثر شيوعا هي فلوري خلية تنشيط الفرز (FACS ) 4 وتنشيط الخلايا الفرز المغناطيسي (MACS)، 5 والتي تعتمد على علامات سطح أعرب لتمييز الخلايا. وتشمل الاستراتيجيات الأخرى الهيدروديناميكية 6 أو بالقصور الذاتي 7،8 الفرز، ملاقط بصرية، 9 acoustophoresis و 10 و dielectrophoresis. 11،12 Dielectrophoresis هو حركة الجسيمات الاستقطاب في وجود حقل كهربائي غير موحدة. وقد استخدم 13 DEP ل مجموعة واسعة من التطبيقات، بما في ذلك الخلايا 2،14 الفرز على أساس الجدوى، 15 تميز خصائص bioelectrical من الخلايا، ونوع 16 جي على التغيرات المستحثة في الخصائص الفيزيائية الحيوية للخلايا. يستخدم 17،18 DEP التقليدية أقطاب مستو منقوشة داخل قناة ميكروفلويديك لتطبيق الجهد وإحداث 13 غير موحدة الحقل الكهربائي. في حين أن هذا هو أسلوب قوية، يمكن أن تنشأ التحديات، مثل التبطين والقطب الكهربائي. dielectrophoresis مقرها عازل (المعهد) 19 وقد تناولت تحديات قاذورات، القطب التبطين، والتدهور المكاني للمجال الكهربائي من خلال تنميط هياكل العازلة التي تحفز على عدم الإتساق في حقل كهربائي DC. وقد استخدم المعهد لفصل انتقائي خلايا البكتيريا الحية والميتة، 19 عزل الجراثيم البكتيرية و 20 و التلاعب الحمض النووي، و21 بين التطبيقات الأخرى. التدفئة الجول يمكن أن يشكل تحديا لأنه يمكن أن يحدث نتيجة لارتفاع الفولتية DC المطلوبة في كثير من الأحيان. لتحسين هذه التحديات، وضعت الأجهزة بالغة الصغر خالية من الاتصال DEP. 22-24
<p clasق = "jove_content"> هذه التقنية المعروضة هنا يستخدم تماس dielectrophoresis (CDEP)، سميت بذلك لعدم وجود اتصال مباشر بين الأقطاب المعدنية والقناة العينة. 22 فريدة من نوعها لهذه الاستراتيجية هو استبدال الأقطاب المعدنية مع قنوات القطب السوائل مليئة حل موصل للغاية. تقترن هذه الأقطاب السوائل سعويا عبر الحاجز رقيقة عازلة للقناة عينة عن طريق الجهد AC. القضاء على عينة اتصال مع أقطاب يقلل من القضايا المرتبطة على أساس أساليب DEP مثل التحليل الكهربائي وتشكيل فقاعة، وتلوث العينة، والقطب التبطين. ونتيجة لذلك، CDEP مفيد وخاصة بالنسبة للعينات البيولوجية لأنها تدعم بقاء الخلايا في العينة. الأهم من ذلك، يمكن CDEP الحفاظ على عينة العقم. رقاقة يمكن أن تكون على استعداد في غطاء خلية ثقافة ويمكن أن تجرى التجربة دون الحاجة إلى الاتصال عينة أقطاب معدنية أو التي تتطلب أن تكون العينة مفتوحة للenvironmeالإقليم الشمالي. خزان بسيطة يمكن ان تكون ثابتة إلى منفذ رقاقة لتسهيل الانتعاش العقيمة العينة. بالإضافة إلى ذلك، تلفيق أقطاب السائل من نفس مادة البوليمر حيويا (PDMS) كقناة عينة يقلل من التكلفة الباهظة التي تتكبدها مع الزخرفة المخصصة من الأقطاب الكهربائية المعدنية، والوقت اللازم لتصنيع، ويحد من الحاجة إلى معدات غرف الأبحاث المتخصصة إلى الزخرفة الأولية من الطوابع قابلة لإعادة الاستخدام رقاقة السيليكون.حركة الجسيمات نتيجة لDEP يعتمد على خصائص الجسيمات والمتوسطة، فضلا عن التدرجات المكانية للمجال الكهربائي. وهناك عامل الجسيمات والتي تعتمد على التردد، ودعا عامل كلوسيوس-Mossotti (CM)، ويأخذ قيمة في نطاق -0.5 إلى 1، ويحدد اتجاه القوة DEP. ويسمى التردد الذي عامل CM هو بالضبط الصفر تردد كروس. هذه هي النقطة التي يمارس أي قوة dielectrophoretic على الجسيمات وعلامة التغييرات عامل CM. A قإنجل تردد كروس لالمجهرية الصلبة الخاملة يحدث عندما يتغير عامل CM من السلبية إلى الإيجابية 25 لخلايا الثدييات في البلدان المنخفضة عازلة الموصلية بناء على أمر من 0.01 S / م، وتردد كروس الأولى مما يدل على الانتقال من NDEP لpDEP موجود بالقرب من 10 – 100 كيلو هرتز، ويتأثر حجم والشكل والهيكل الخلوي، وخصائص غشاء الخلية. 26،27 وتردد كروس الثاني في التحول من نظام إلى pDEP NDEP هو بناء على أمر من 10 ميغاهرتز، ويتأثر نسبة النواة السيتوبلازم، السيتوبلازم الموصلية، والشبكة الإندوبلازمية. يمكن تطبيق 27 قوة DEP دون وجود تدفق السوائل، ولكن هنا نحن الاستفادة من السوائل المتدفقة لتحقيق الفرز مستمر من الجسيمات العالقة. التأثير المشترك لقوة dielectrophoretic وقوة السحب وستوكس تملي حركة متعدية من الجسيمات.
قمنا بتطوير أجهزة للعمل في نطاقين تردد. التردد العاليوقد عملت الأجهزة ذ (100-600 كيلو هرتز) باستخدام pDEP وحققت الفرز دفعة من الخلايا، مثل الخلايا السرطانية في البروستاتا بدء (التشنجات اللاإرادية)، الظهارية سطح المبيض (موسي) خلايا الفئران، MDA-MB-231 خلايا سرطان الثدي، أو العيش THP -1 الخلايا بشكل انتقائي من خلال محاصرة خلايا الفائدة على العزل المشاركات التي تقع في القناة العينة. 28-31 تردد السفلى (5-100 كيلو هرتز) الأجهزة تعمل بشكل مستمر، وعندما كانت تعمل على تردد واحد الذي يواجه السكان pDEP في حين أن الخبرات السكان الخلفية NDEP، يمكن إعادة توجيه مسارات الجسيمات لتحقيق الفرز. وقد استخدمت هذه الأجهزة 32-34 التردد المنخفض لفرز الخلايا السرطانية من خلايا الدم الحمراء، وتحديد التغيرات في خصائص عازلة من موسي خط الخلية تقدمية، وإلى إلقاء الضوء على آثار غير العلاجات الشحميات السفينغولية سامة على عكس خصائص عدوانية من الخلايا موسي العدوانية. بالإضافة إلى ذلك، الأجهزة بالغة الصغر CDEP يمكن تصميمها لتعمل على زيادة الإنتاجية، حاليا ما يصل إلى 1 مل / ساعةص. 31،35
كما هو موضح، والمرونة والتكلفة المنخفضة لعملية تلفيق تمكن هندستها جهاز مصمم خصيصا، والتي تسمح للإجراء التجريبي تقديمها لتكون ذات الصلة لمجموعة واسعة من التطبيقات. الهدف على المدى الطويل هو أن ندرك CDEP خالية من التسمية الفرز الخلية والتخصيب على مستوى السريرية، مع انتعاش عينة للثقافة أو معالجة لاحقة. تقنية المعروضة هنا هي طريقة بسيطة وغير مكلفة، من تلفيق لإجراء التجارب، مما يزيد من إمكانية الوصول إلى DEP. ونحن لشرح إعداد شريحة CDEP والبروتوكول التجريبي لتحقيق توصيف وإثراء خلايا سرطان المبيض من المجهرية الفلورسنت.
Protocol
Representative Results
Discussion
DEP هي تقنية قوية لتحديد خصائص عازلة من الجزيئات والجسيمات توجيه الحركة نحو فرز الطلبات، والعزلة، أو التخصيب. ويرجع ذلك إلى تأثير ضار للاتصال المباشر مع القطب عينة، اتخذت الآخرين نهج مماثلة لطريقة عرض في وقت سابق لتجنب الاتصال. على سبيل المثال، البشير وآخرون. وضعت الأجهزة DEP خالية من الاتصال باستخدام جهاز PDMS ميكروفلويديك فصلها عن المطبوعة أقطاب لوحات الدارات الكهربائية بواسطة ساترة الزجاج رقيقة، ويتم إجراء هذه التقنية متوفرة أيضا في شكل شريط فيديو. 23،36
هنا، لقد أظهرنا تصنيع رقاقة CDEP وأقطاب فلويديك باستخدام الركيزة PDMS واحد، وبروتوكول تجريبي لفصل خلايا سرطان المبيض من خليط من الخلايا والخرز الفلورسنت. وقد استخدمت هذه التقنية بنجاح لعرض مجموعة متنوعة من التطبيقات الأكثر تعقيدا وذات الصلة من الناحية الفسيولوجية، بما في ذلك فرز ليفالخلايا الإلكترونية والأموات، 28 ورم الخلايا بدء من خلايا سرطان البروستاتا، 30 الخلايا السرطانية من الخلايا تمييع الدم الحمراء، والتفريق بين 31،32 مراحل سرطان الثدي وسرطان المبيض 37 29 CDEP كما تم استخدامها لخلط الجسيمات. هذه 38 وتشير التطبيقات التي باستخدام تقنية بسيطة قدمت، وأغراض متنوعة يمكن تحقيق ذلك ببساطة عن طريق تغيير تصميم هندسة القناة.
. DEP مفيد على الميكروسكيل للتلاعب من الجزيئات 13 للجسيمات كروية، وقوة dielectrophoretic متعدية يعتمد على حجم والكهربائية خصائص الجسيمات والمتوسطة تعليق لها، فضلا عن التدرج الحقل الكهربائي التربيعية:
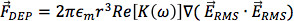
حيث ε م هو السماحية للتعليق المتوسطة، r هو نصف قطرهامن الجسيمات، والصليب الأحمر [ك (ω)] هو الجزء الحقيقي للعامل كلوسيوس-Mossotti (CM). عامل CM هو مقياس من الاستقطاب النسبية للجسيمات مقارنة المتوسطة بتوقيف ويحدد اتجاه القوة dielectrophoretic. ما توصف بأنها
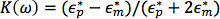
حيث 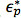 و
و 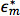 هي permittivities معقدة من الجسيمات والمتوسطة، على التوالي. السماحية معقدة،
هي permittivities معقدة من الجسيمات والمتوسطة، على التوالي. السماحية معقدة، 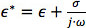 ، يعتمد على (σ) الموصلية و(ω) تردد. عامل CM من جسيمات كروية ونظريا ملزمة بين -0.5 و 1. إذا كان عامل CM هو سلبي، والجزيئات تجربة NDEP لأن المتوسط هو أكثر قطوب من الجسيمات، لذلك جسيمات تتحرك بعيدا عن مناطقالتدرجات الحقل الكهربائي عالية. إذا كان عامل CM هو إيجابي، والجزيئات هي أكثر قطوب من المتوسط وكانت تجربة pDEP التي تتحرك نحو مناطق التدرجات الحقل الكهربائي عالية.
، يعتمد على (σ) الموصلية و(ω) تردد. عامل CM من جسيمات كروية ونظريا ملزمة بين -0.5 و 1. إذا كان عامل CM هو سلبي، والجزيئات تجربة NDEP لأن المتوسط هو أكثر قطوب من الجسيمات، لذلك جسيمات تتحرك بعيدا عن مناطقالتدرجات الحقل الكهربائي عالية. إذا كان عامل CM هو إيجابي، والجزيئات هي أكثر قطوب من المتوسط وكانت تجربة pDEP التي تتحرك نحو مناطق التدرجات الحقل الكهربائي عالية.
للجزيئات البيولوجية التي هي nonhomogeneous في الهيكل، مثل الخلايا، يمكن تحديد عامل كلوسيوس-Mossotti من القيمة الفعالة للالسماحية الجسيمات:
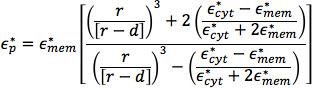
حيث 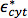 و
و 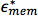 هي السماحية المعقدة للالسماحية المعقدة فعالة الداخلية للخلية، مثل السيتوبلازم، وغشاء البلازما، على التوالي؛ r هو نصف قطر الخلية، ود هو سمك غشاء البلازما 26
هي السماحية المعقدة للالسماحية المعقدة فعالة الداخلية للخلية، مثل السيتوبلازم، وغشاء البلازما، على التوالي؛ r هو نصف قطر الخلية، ود هو سمك غشاء البلازما 26
عندما يحدث DEP مع الجسيمات العالقة فيالسوائل، فإن حركة الجسيمات المتعلقة السائل توليد قوة جر على الجسيمات. يجب النظر في هذا قوة السحب عند تحديد القوة الشاملة تعمل على الجسيمات. لحالات من الاهتمام هنا، قوى اللزوجة الهيمنة ويفترض جسيمات كروية، والصغيرة، وتتحرك مع سرعة منخفضة نسبيا، لذلك ينص القانون السحب ستوكس تقريب جيد لقوة السحب:
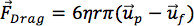
حيث η هو اللزوجة من السوائل، ش ع هي سرعة الجسيم، وو ش هي سرعة السائل، والتي يمكن أيضا أن تتحرك. نظرا لقوة dielectrophoretic، المعروف السوائل وخصائص الجسيمات، وسرعة تدفق معروفة، يمكن حلها التوازن بين قوة السحب وقوة dielectrophoretic لتقدير سرعة الجسيمات. معدل القص التي ينبغي أن تكون تجربة الخلايا تحت العتبة التي جيمكن أن يحدث الذراع lysing.
توصيف الخصائص الكهربائية للجزيئات من الضروري التنبؤ والسيطرة على الكيفية التي سيستجيب تحت DEP لهم. في هذا العمل، ونحن تستخدم خصيصا منخفضة التردد CDEP مع الخلايا موسي-L للتدليل على بروتوكول لتحديد تردد كروس أول من الخلايا، ثم أظهر الفرز مستمرة من الخرز البوليسترين والخلايا موسي-L على أساس معارضة ردودهم DEP.
تغيير وهندسة الجهاز CDEP تغيير التدرجات المكانية للمجال الكهربائي، مما يسمح لأجهزة مصممة لتكون ذات تردد عال أو منخفضة التردد العملية، وانتقائية عالية وكفاءة الفرز لنوع من الخلايا المحددة. بالإضافة إلى ذلك، وأجهزة إنتاجية عالية يمكن تطويرها عن طريق افتعال قنوات أوسع، 30 قناة في موازاة ذلك، 30 أو عن طريق تلفيق متعدد الطبقات 35، والتي هي مكدسة قنوات القطب عموديا فوق وتحت عميق نسبياقناة العينة. أغشية رقيقة تشكل حاجزا بين الطبقات. اختبار مبدئي مع الأجهزة ملفقة في ميثاأكريلات (PMMA) والبولي أظهرت (PC) أفلام رقيقة من الخلايا استجابة DEP موسي-L. تجري الجهود الحالية لتحسين متعدد الطبقات الأجهزة عالية الإنتاجية وتحسين نظام الطرفية في نهاية المطاف نحو منصة التوصيل واللعب. لتوسيع من تقنية تجريبية الأساسية المقدمة، التطبيقات ومواصفات الجهاز يمكن أن تكون مصممة لتناسب مطالب معينة، مثل الفرز مقابل التوصيف، أو إضافة خزانات نموذج ونظام شبه الآلي إلى الجهاز.
Disclosures
The authors have nothing to disclose.
Acknowledgements
وقد تم دعم هذا العمل بدعم جزئي من قبل مؤسسة العلوم الوطنية في إطار منحة رقم 0938047 EFRI، ومعهد تكنولوجيا فرجينيا للتكنولوجيا الحرجة والعلوم التطبيقية (ICTAS). فإن الكتاب أود أن أعرب عن تقديري للدكتور إيفا Schmelz والدكتور بول روبرتس لهديتهم نوع من الخلايا موسي-L. المؤلفين الاعتراف انجيلا اندرسون لمساعدتها مع خلية ثقافة، Caitlan Swaffar لها المساعدة في تحرير هذه الوثيقة وإعداد التجارب، وجميع أعضاء مختبر نظم Bioelectromechanical.
Materials
| Name of Reagent/Material | Company | Catalog Number | Comments |
| Polydimethylsiloxane (PDMS) | Dow Corning, Midland, MI,USA | Sylgard 184 | |
| Glass slides | The Microscope Depot | 76079 | 2×3 inch-ground edges |
| Microbore PTFE Tubing | Cole-Parmer Instrument Co, Vernon Hills, IL, USA | EW-06417-31 | Thin walled 20 gauge, 0.032″ID x 0.056″OD, 100 ft/roll |
| Luer-slip plastic syringes | National Scientific company | S7510-1 | |
| Needle tip | Howard Electronic instruments | JG20-1.0 | 20 Gauge 1.0″, ID=0.025″ OD=0.036″ |
| D(+)-Sucrose | Fisher Scientific, Fair Lawn, NJ | S3-500 | |
| D(+)-glucose, reagent ACS, anhydrous | Acros Organics N.V., Fair Lawn, NJ | AC410955000 | |
| RPMI-1640 Medium | Quality Biological Inc. | 112-025-101 | |
| Calcein AM, Molecular Probes | Invitrogen Corp. (life technologies), Carlsbad, CA, USA | C3100MP | excitation wavelength 488/emission wavelength 516 |
| Rhodamine B, O | Science Lab | SLR1465-100G | excitation wavelength 540/emission wavelength 625 |
| Phosphate buffered saline (10X) | Gbiosciences, St. Louis, MO | RC-147 | |
| Leica, inverted light microscope | Leica Microsystems, Bannockburn, IL, USA | Leica DMI 6000B | |
| Leica DFC420, color camera | Leica Microsystems, Bannockburn, IL, USA | Leica DFC420 | |
| Function generator | GW Instek, Taipei, Taiwan | GFG-3015 | |
| Wideband power amplifier | Amp-Line Corp., Oakland Gardens, NY, USA | AL-50HF-A | |
| HFHV Output Transformer | AL-T50-V25/300-F100K-600K | ||
| High voltage amplifier | Trek | Model 2205 | |
| USB Modular Oscilloscope, 100 MHz | AgilentTechnologies | U2701A | |
| Expanded Plasma Cleaner | Harrick Plasma | PDC-001/002 (115/230V) | air plasma |
| Scotch Magic tape | 3M | any available width is sufficient | |
| 1.5 mm puncher | Harris Uni-Core | Z708836-25EA | |
| .25% Trypsin-EDTA | Invitrogen | 25200-056 | |
| FluoSpheres Sulfate Microspheres | Invitrogen | F8858 | 4.0 μm, red fluorescent (excitation wavelength 580/emission wavelength 605) |
| AZ 9260 photoresist | AZ Electronic Materials | ||
| AZ 400 K developer | AZ Electronic Materials | ||
| Tetramethylammonium hydroxide (TMAH) 25% | provided by Virginia Tech cleanroom | ||
| Teflon coating | applied using DRIE machine | ||
| Silicon wafer | University Wafer | 452 | 100 mm diameter, 500 μm thickness, one side polished (SSP) |
| Deep Reactive Ion Etching (DRIE) | Alcatrel | AMS SDE 100 |
References
- Butler, M. . Cell culture and upstream processing. , (2007).
- Pratt, E. D., Huang, C., Hawkins, B. G., Gleghorn, J. P., Kirby, B. J. Rare Cell Capture in Microfluidic Devices. Chemical Engineering Science. 66, 1508-1522 (2011).
- Salmanzadeh, A. D., Davalos, R. V. Isolation of rare cells through their dielectrophoretic signature. Journal of Membrane Science and Technology. 3, e112 (2013).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. The Review of Scientific Instruments. 43, 404-409 (1972).
- Adams, J. D., Kim, U., Soh, H. T. Multitarget magnetic activated cell sorter. Proc. Natl. Acad. Sci. USA. 105, 18165-18170 (2008).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proc. Natl. Acad. Sci. U.S.A. 105, 3191-3196 (2008).
- Di Carlo, D., Irimia, D., Tompkins, R. G., Toner, M. Continuous inertial focusing, ordering, and separation of particles in microchannels. Proc. Natl. Acad. Sci. U.S.A. 104, 18892-18897 (2007).
- Di Carlo, D. Inertial microfluidics. Lab Chip. 9, 3038-3046 (2009).
- Grover, S. C., Skirtach, A. G., Gauthier, R. C., Grover, C. P. Automated single-cell sorting system based on optical trapping. J. Biomed. Opt. 6, 14-22 (2001).
- Lin, S. C. S., Mao, X. L., Huang, T. J. Surface acoustic wave (SAW) acoustophoresis: now and beyond. Lab Chip. 12, 2766-2770 (2012).
- Pethig, R. Review Article-Dielectrophoresis: Status of the theory, technology, and applications. Biomicrofluidics. 4, (2010).
- Gascoyne, P. R. C., Wang, X. B., Huang, Y., Becker, F. F. Dielectrophoretic separation of cancer cells from blood. Ieee T. Ind. Appl. 33, 670-678 (1997).
- Pohl, H. A. . Dielectrophoresis : the behavior of neutral matter in nonuniform electric fields. , (1978).
- Salmanzadeh, A., Davalos, R. V. Isolation of rare cells through their dielectrophoretic signature. Journal of Membrane Science. , (2012).
- Markx, G. H., Talary, M. S., Pethig, R. Separation of Viable and Nonviable Yeast Using Dielectrophoresis. J. Biotechnol. 32 (94), 29-37 (1994).
- Flanagan, L. A., et al. Unique dielectric properties distinguish stem cells and their differentiated progeny. Stem Cells. 26, 656-665 (2008).
- Labeed, F. H., Coley, H. M., Thomas, H., Hughes, M. P. Assessment of multidrug resistance reversal using dielectrophoresis and flow cytometry. Biophys. J. 85, 2028-2034 (2003).
- Hoettges, K. F., et al. Dielectrophoresis-activated multiwell plate for label-free high-throughput drug assessment. Anal. Chem. 80, 2063-2068 (2008).
- Lapizco-Encinas, B. H., Simmons, B. A., Cummings, E. B., Fintschenko, Y. Insulator-based dielectrophoresis for the selective concentration and separation of live bacteria in water. Electrophoresis. 25, 1695-1704 (2004).
- Davalos, R. V., et al. Performance impact of dynamic surface coatings on polymeric insulator-based dielectrophoretic particle separators. Anal. Bioanal. Chem. 390, 847-855 (2008).
- Gallo-Villanueva, R. C., Rodriguez-Lopez, C. E., Diaz-De-La-Garza, R. I., Reyes-Betanzo, C., Lapizco-Encinas, B. H. DNA manipulation by means of insulator-based dielectrophoresis employing direct current electric fields. Electrophoresis. 30, 4195-4205 (2009).
- Shafiee, H., Caldwell, J. L., Sano, M. B., Davalos, R. V. Contactless dielectrophoresis: a new technique for cell manipulation. Biomed Microdevices. 11, 997-1006 (2009).
- Park, K., Suk, H. J., Akin, D., Bashir, R. Dielectrophoresis-based cell manipulation using electrodes on a reusable printed circuit board. Lab Chip. 9, 2224-2229 (2009).
- Jen, C. P., Maslov, N. A., Shih, H. Y., Lee, Y. C., Hsiao, F. B. Particle focusing in a contactless dielectrophoretic microfluidic chip with insulating structures. Microsyst Technol. 18, 1879-1886 (2012).
- Hughes, M. P. AC electrokinetics: applications for nanotechnology. Nanotechnology. 11, 124-132 (2000).
- Pethig, R. Dielectrophoresis: Status of the theory, technology, and applications. Biomicrofluidics. 4, 022811 (2010).
- Pethig, R., Ferrari, M. a. u. r. o., Ozkan, M. i. h. r. i. m. a. h., Heller, M. i. c. h. a. e. l. . J. .. Ch. 4. BioMEMS and Biomedical Nanotechnology. 4, 103-126 (2007).
- Shafiee, H., Sano, M. B., Henslee, E. A., Caldwell, J. L., Davalos, R. V. Selective isolation of live/dead cells using contactless dielectrophoresis (cDEP). Lab Chip. 10, 438-445 (2010).
- Salmanzadeh, A., et al. Dielectrophoretic differentiation of mouse ovarian surface epithelial cells, macrophages, and fibroblasts using contactless dielectrophoresis. Biomicrofluidics. 6, (2012).
- Salmanzadeh, A., et al. Isolation of prostate tumor initiating cells (TICs) through their dielectrophoretic signature. Lab Chip. 12, 182-189 (2012).
- Salmanzadeh, A., Sano, M. B., Shafiee, H., Stremler, M., Davalos, R. V. Isolation of Rare Cancer Cells from Blood Cells Using Dielectrophoresis. , (2012).
- Sano, M. B., Caldwell, J. L., Davalos, R. V. Modeling and development of a low frequency contactless dielectrophoresis (cDEP) platform to sort cancer cells from dilute whole blood samples. Biosens. Bioelectron. 30, 13-20 (2011).
- Salmanzadeh, A., et al. Investigating Dielectric Properties of Different Stages of Syngeneic Murine Ovarian Cancer Cells. Biomicrofluidics. , (2013).
- Salmanzadeh, A., Sano, M. B., Shafiee, H., Stremler, M. A., Davalos, R. V. . , 590-593 (2012).
- Sano, M. B., Salmanzadeh, A., Davalos, R. V. Multilayer contactless dielectrophoresis: Theoretical considerations. Electrophoresis. 33, 1938-1946 (2012).
- Millet, L. J., Park, K., Watkins, N. N., Hsia, K. J., Bashir, R. Separating beads and cells in multi-channel microfluidic devices using dielectrophoresis and laminar. J. Vis. Exp. (48), e2545 (2011).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32, 2523-2529 (2011).
- Salmanzadeh, A., Shafiee, H., Davalos, R. V., Stremler, M. A. Microfluidic mixing using contactless dielectrophoresis. Electrophoresis. 32, 2569-2578 (2011).

