Behavioral Fenotypering van Muriene Disease Modellen met de Integrated Behavioral Station (INBEST)
Summary
Langdurige en uitgebreide monitoring van muizen in een home-kooi-omgeving biedt een dieper begrip van afwijkend gedrag in muismodellen van hersenziekten. Dit artikel beschrijft de Integrated Behavioral Station (INBEST) als de belangrijkste component van de hedendaagse gedragsanalyse.
Abstract
Door de snelle ontwikkelingen in de genetische manipulatie, hebben kleine knaagdieren de favoriete onderwerpen in vele disciplines van het biomedisch onderzoek geworden. In studies van chronische CNS-aandoeningen, is er een toenemende vraag naar murine modellen met hoog geldigheid op gedragsniveau. Echter, meerdere pathogene mechanismen en complexe functionele tekorten op te leggen vaak uitdagingen om betrouwbaar te meten en interpreteren van gedrag van chronisch zieke muizen. Daarom is de controle van het perifere pathologie en gedragsmatige profiel op verschillende tijdstippen met een batterij van tests nodig. Video-tracking, gedrags-spectroscopie, en op afstand overname van fysiologische maatregelen worden opkomende technologieën die het mogelijk maken voor een volledige, accurate en onpartijdige gedragsanalyse in een home-base-achtige setting. Dit rapport beschrijft een verfijnde fenotyperen protocol, dat een op maat gemaakte bewakingsorgaan (Integrated Behavioral Station, INBEST) dat zich richt op langdurige metingen van ba omvatsic functionele uitgangen, zoals spontane activiteit, voedsel / water-inname en gemotiveerd gedrag in een relatief stressvrije omgeving. Technische en conceptuele verbeteringen in INBEST ontwerp kan verder bevorderen reproduceerbaarheid en standaardisatie van gedragsonderzoek.
Introduction
Snelle ontwikkelingen in genetische manipulatie in de afgelopen decennia hebben geleid tot een ongekende toename van dierlijke modellen van menselijke ziekten. Muizen beschikken over de status van primair proefpersonen in biomedische wetenschappen om verschillende redenen. Vanuit praktisch oogpunt, zij een hoge reproductiesnelheid, zijn relatief goedkoop en eenvoudig te huisvesten. Vanuit een conceptueel oogpunt zijn ze genetisch dicht bij de mens, kunnen genetisch gemodificeerd worden met relatief gemak, en hebben hoogontwikkelde endocriene, het immuunsysteem en het zenuwstelsel. Naast de laesies genetische en cellulaire niveaus, moderne studies van hersenstoornissen vereisen demonstratie van repliceerbaar functionele tekorten die highlight gezicht, construeren of voorspellende waarde van een nieuw muismodel 1.
Een acute infectie bij een zoogdier homoeothermic resulteert vaak in de koortsreactie, die samen met ziekte gedrag vormt een van debelangrijkste overlevingsmechanismen 2. Acuut zieke dieren weer te geven significante veranderingen in voeding / water-inname en prestaties in taken afspiegeling is van emotionele reactiviteit, verkennende gedrag, en leren / geheugencapaciteit. Deze veranderingen is grotendeels verantwoordelijk voor een verminderde sociale / seksuele activiteit en het behoud van energie voor defensieve immuunreacties. Wanneer echter acute aandoeningen draaien chronische (zoals in vele immunologische, endocriene en neurologische ziekten), gedrags- prestaties verder verslechteren als gevolg van structurele beschadiging van verschillende organen, inclusief de hersenen 3.
Menselijke en dierlijke neurodegeneratieve aandoeningen gaan vaak gepaard met een constellatie van neurologische en gedragsstoornissen. Daarom is een belangrijk doel in het gedragsonderzoek van chronisch zieke dieren is de centrale effecten van de tekorten veroorzaakt door perifere symptomen te onderscheiden. De relatief korte duur van standaard gedragstaken beperkt de collection van informatie over elementaire functionele maatregelen, zoals de reukzin, rust, slaap, voedsel / water inname, of epileptische aanvallen. Het opnemen van deze maatregelen verbetert gedragsprofielen en maakt een betere interpretatie van de prestaties in-activiteit veeleisende taken.
Verfijningen in gedrags fenotyperen van zieke muizen
De tekortkomingen in de beoordeling van de gedrags-profiel van zieke muizen hebben continue bewaking van afzonderlijk gehuisveste muizen noodzakelijk door fast-verwerking pc's. Hoewel diverse gedrags batterijen zijn ontworpen 4, 5, hieronder zijn de procedures die zijn gebruikt om een diermodel van neuropsychiatrische lupus 6 goed vast. Deze batterij herhaaldelijk zowel subchronische en chronische diermodellen (figuur 1), toegepast zoals milde cognitieve stoornissen en de ziekte van Alzheimer 7. Na een reeks neurologische proeven 8-10, acustom gemaakte inrichting, ontworpen om de bovenstaande eisen te voldoen door gebruik continue controle van meerdere gedrags uitgangen een verrijkte huis-kooi-achtige omgeving, kunnen worden toegepast. Zo'n ethologisch-gebaseerde aanpak voor de beoordeling van de spontane verkennende activiteit en gemotiveerd gedrag zorgt voor een meer omvattend begrip van de prestaties tekorten in andere paradigma's, zoals die een afspiegeling is van leren en geheugen.
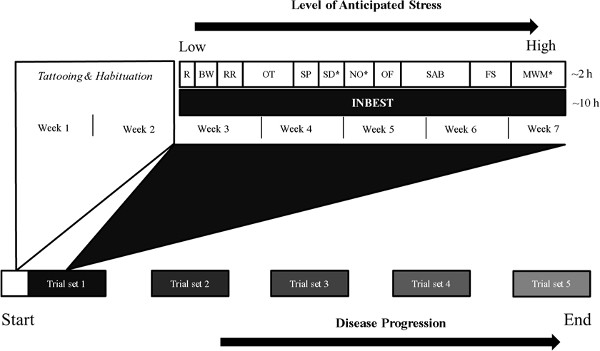
Figuur 1. Schematische weergave van longitudinale gedrags- fenotypering in ons laboratorium. De gedrags- batterij heeft evolueren van minder- naar meer- stressvolle taken die worden herhaald op verschillende tijdstippen om de effecten van langdurige factoren als ziekteprogressie beoordelen, farmacologische behandeling of immunologische reacties. INBEST en individuele tests worden uitgevoerd tijdens de donkere phase, vaak meer dan 10 en 2 uur, respectievelijk Afkortingen:. R – reflexen; BW – Beam Walking-test; RR – Rotarod; OT – Olfactorische testen; SP – Sucrose Preference-test; SD – Step Down-test; NO – Novel Object-test; VAN – Open-veld-test; SAB – Spontane Alternation Gedrag; FS – Gedwongen Swim-test; MWM – Morris Water Maze. * – Aspecten van de test (bijvoorbeeld locatie, context, kleur, vorm) die moeten worden gewijzigd in latere studies hele loop van experiment.
Continue video-opname en analyse van het gedrag in een home-kooi-achtige omgeving werden voor het eerst gemeld in 2007 11. Een meer complexe geautomatiseerde apparatuur die gedragstesten gebruikt in studies met auto-muizen integreert werd gepresenteerd op de 'Meten Behavior' ontmoeten een jaar later 12. De Integrated Behavioral Station (INBEST, Figuur 2A) is een modulair systeem, dat comprises van een schuilplaats, computergestuurd licht stimulus, twee-fotocel gecontroleerd lickometers (één voor water, een voor een oplossing van belang), een geautomatiseerde snackautomaat, een geautomatiseerd loopwiel, en een gedigitaliseerde klimmen mesh. Latencies, frequenties, en de duur van de specifieke gedragingen worden onderzocht met behulp van software op maat. Bewegingsapparaat en verkennende activiteit (bijvoorbeeld van een roman object of een onbekende soortgenoten) kan worden beoordeeld met video-tracking software (lijst van materialen / apparatuur), tijdens het slapen en minder frequent gedragspatronen, zoals zelfverwonding en epileptische aanvallen, kan handmatig worden gescoord met video-software voor het bijhouden of dedicated event-opname pakketten. Acht volledige INBEST / video-opstellingen worden gebruikt, waardoor gelijktijdige bewaking van 4 experimentele en 4 controle dieren (Figuur 2B).
<img alt="Figuur 2" src="/files/ftp_upload/51524/51524fig2.jpg" />
Figuur 2. Integrated Behavioral Station. (A) Schematische weergave van hardware en software die wordt gebruikt bij het ontwerpen van een INBEST doos (L = 39 x B = 53 x H = 50 cm). (B) Acht volledige INBEST dozen bieden een mogelijkheid voor gelijktijdige thuis-kooi bewaking van vier experimentele en vier controle muizen. Klik hier om een grotere versie van deze afbeelding te bekijken.
Afhankelijke variabelen zijn metingen van voedsel / water inname, responsiviteit naar verteerbaar stimulatie, spontane ambulante activiteit, klimmen, vrijwillige lopen, angst-gerelateerd gedrag (bijvoorbeeld, de exploratie van nieuwe object), verzorging, inbeslagneming en slapen. Daarnaast kunnen visuele stimuli worden gepresenteerd voor het conditioneren en leren paradigma. De voordelen van INBEST opzichte van standaard gedrags testen betreffen de afschaffing van de verstorende effecten induced door transport stress en continue, automatische verzameling maatregelen reflecterende nachtelijke activiteit, exploratie, angstige en depressieve-achtig gedrag. De integratie van gevoelige hardware componenten met een video-tracking-pakket levert een schat aan informatie, die een betere beoordeling van het gedrag toestaat met betrekking tot progressie van chronische ziekten in verschillende diermodellen. INBEST kan worden gebruikt om andere chronische CNS-aandoeningen (bv autisme, depressie, schizofrenie), alsmede in longitudinale studies gericht op de neurologische ontwikkeling, gedragseffecten van systemische / neoplastische aandoeningen en langdurige farmacotherapie bestuderen.
Protocol
Representative Results
Discussion
De detectie van functionele effecten bij dieren hangt grotendeels af van het vermogen van de onderzoeker aan de variabiliteit inherent aan gedragsonderzoek beperken. Daarom is het belangrijk om controle nauwgezet en minimaliseren potentiële verwart de betrouwbaarheid en reproduceerbaarheid van gedragsgegevens kunnen verminderen. Tegelijkertijd is het belangrijk te erkennen dat geen test weerspiegelt een enkel domein van gedrag dat kennis van neurologische functie is verplicht en dit gedrag is zeer gevoelig voor externe stressoren. Als de bovenstaande postulaten worden gewaardeerd, kan men concluderen dat uitgebreide gedragsanalyse moet het tijdsverloop van de respons gemeten omvatten, evenals, betrekken elementaire functionele eigenschappen en paradigma's die gebruikmaken van specifieke gedragsaspecten. Veel van deze criteria kan worden voldaan met behulp van geautomatiseerde beoordeling van de bewegingen en gedragsmatige handelingen in een verrijkte huis-kooi-omgeving.
Tot nu toe heeft het Emphasi geweestzed dat gedrags fenotyperen van muismodellen van ziekten bij de mens rechtvaardigt aanvullende overwegingen. Dit begrip is gebaseerd op de veronderstelling dat functionele homeostase wordt uitgedaagd door interne en externe stressoren tijdens het begin van de ziekte. Hoewel alle mogelijke verwart niet kan worden opgeheven door de introductie van geautomatiseerde, huis-kooi fenotypering, zijn kwesties met betrekking tot inconsistente milieu-instellingen, transport stress, en herhaald hanteren geminimaliseerd. Dit verhoogt aanzienlijk consistentie en precisie tussen de studies; zelfs kleine vermindering variabiliteit kan verbeteren de detectie van de effecten geïnduceerd door een beginnende ziekte. Inderdaad, INBEST verschaft een schat aan gegevens, die nauwkeuriger beoordeling van het begin, kinetiek, en de ernst van gedragsveranderingen en belangrijke relaties tussen verschillende ziekte geïnduceerde gedragsstoornissen toelaat. Betrouwbare video-volgen hangt af van twee lichtomstandigheden. Eerst wordt diffuus licht vereist in de testkamer te voorkomenartefacten uit nabijgelegen reflecterende objecten. Ten tweede kan hoog contrast worden verkregen door kiezen van een geschikte vloerkleur afwijken van het subject kleur zoveel mogelijk. In ons laboratorium wordt dit bereikt door het gebruik van vloed-lampen gepositioneerd onder de INBEST dozen en zwarte vloer trays bij het monitoren van albino muizen (witte of grijze achtergrond zou voldoende zijn als het testen van gepigmenteerde stammen). Met betrekking tot de gebeurtenis opname aspect van INBEST, de huidige hardware instelling (1 Piccolo videokaart met 4 ingangen) beperkt 4 vakken gelijktijdig gebruikt per PC. Dit is een vrij klein aantal dozen, terwijl een meer geschikte set-up zou 8 of zelfs 16 kooien 2 of 4 PC's respectievelijk vereisen, en dus. Bij voorkeur kan INBEST continu worden gebruikt gedurende 24 uur als het huis-kooi. Dit zou dieren volledig wennen aan de omgeving en vorming van stabiele, circadiane gedragspatronen, die op onpartijdige wijze worden geanalyseerd. Naar computer gegevensverlies door stroomuitval, een continu vermogen su voorkomenpply (of op zijn minst een Uninterruptible Power source) moet worden beveiligd. Tenslotte, om een goede beoordeling van de dagelijkse voedselinname garanderen, moet worden opgemerkt dat de grootte van voedsel pellets niet hoger zijn dan de grootte van de gaten in de voedseldispenser (de aanbevolen grootte van één voedselpellet 20 mg).
Het is niet te vergeten echter dat deze analyse ook moet nemen hoe de verschillende INBEST maatregelen kunnen interageren met elkaar. Bijvoorbeeld, muizen die meer tijd doorbrengen in het loopwiel zijn waarschijnlijk hoger hoeveelheden voedsel en water innemen van hun verhoogde calorie-eisen te voldoen. Evenzo kunnen muizen inname meer sacharoseoplossing hun inname van voedsel verminderen. De interpretatie van deze resultaten kunnen verder worden gecompliceerd door de algemene verbetering van de prestaties in de tijd, met name met betrekking tot gedrag en loopwiel activiteit voeropnamegedrag. Gezien hun incentive-eigenschappen, kunnen onderzoekers ook het beperken van de toegang tot sucrose-oplossing en t overwegenhij loopt wiel om de kans op post-voeropnamegedrag effecten en overmatig gewichtsverlies tegen te gaan, respectievelijk. Echter, kunnen deze zorgen meer relevant in sommige stammen zijn dan anderen omdat verschillende stammen van muizen hebben ongelijksoortige gedragsprofielen. Hoewel het uitvoeren van zowel de baseline en experimentele evaluatie controles voor veel van de problemen hierboven, moeten onderzoekers erkennen dat deze variabelen rekening moet worden gehouden bij het interpreteren van INBEST gegevens. Tegelijkertijd, kunnen bepaalde aspecten van gedrag bestudeerd in de huiselijke omgeving kooi, dus een combinatie met standaard tests om de gedrags profiel onderwerpen voltooien noodzakelijk.
Geautomatiseerde controle binnen gestandaardiseerd, maar flexibele omgevingen lijkt de logische volgende stap in de hedendaagse gedragsanalyse zijn. Een dergelijk niet-invasieve, ethologisch gebaseerde aanpak kunnen onderzoekers het volledige repertoire van gedragsreacties observeren gedurende een langdurige tijdsperiode. Deoretically, kan dit worden bereikt door het bestuderen gedrag in een "virtuele" verrijkt milieu dat sterk lijkt op een natuurlijke habitat. Verschillende onderzoeksgroepen hebben vision-based tracking tools die gedragsproblemen fenotyperen van muizen te ondersteunen in hun huis-kooi 22-25 beschreven, in tweetallen 26, 27, of in het kader van de grote sociale groepen 28. Hoge nauwkeurigheid en ruimtelijke resolutie kan worden bereikt door integreren video tracking microchiptechnologie voor gelijktijdige en gesynchroniseerde verzamelen van gedragsgegevens in een groep muizen 28. Thermografische camera kunnen detecteren warmte handtekeningen te combineren met implanteerbare microchips of transponders op de relatieve plaats en fundamentele fysiologische functies van elke muis (bijvoorbeeld lichaamstemperatuur, hart / ademhaling) verschaffen. Bovendien zou een geavanceerd 3D volgsysteem nauwkeuriger en kwantitatieve herkenning van gedrags- handelingen produceren. Om herhaaldelijk uitvoeren van een varischappij van testen, moet een dergelijk systeem worden geautomatiseerd, op afstand bestuurde, en modulair. Zo kan ruimtelijk geheugen bestudeerd in grotere omgevingen programmeren van de verschijning van distale signalen op LCD wanden en door het presenteren / verbergen dispensers met smakelijk voedsel van beweegbare vloeren. Op soortgelijke wijze kunnen nieuwe objecten worden gepresenteerd / verborgen op specifieke tijdstippen gedurende de studie. Dergelijke geautomatiseerde fenotyperen kan helpen bij het ophelderen van de genetische determinanten van gedrag, pathogene mechanismen onderliggende ziekte modellen, en de ontwikkeling van nieuwe therapeutische strategieën. Indien een consensus wordt bereikt met betrekking tot de testcondities, volgorde van de proeven, evenals de gebruikte hardware en software, mag men verwachten dat de langverwachte standaardisatie zou reproduceerbaarheid van gedragsonderzoek te verbeteren en te verheffen experimentele psychometrie naar een nieuw niveau.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by an Ontario Mental Health Foundation grant to B.S, and an Ontario Graduate Scholarship to M.K.
Materials
| Power control interface operating package | Med Associates Inc. | MED-SYST-8 | Interface box and PCI card that manage all A/D data inputs and outputs |
| Stimulus light | Med Associates Inc. | ENV-221M | 28 V DC, 100 mA, 2.5 cm diameter light (for presentation of a conditioned stimulus) |
| Head entry detector | Med Associates Inc. | ENV-254-CB | Permits head entry detection into the pellet receptacle |
| Photobeam lickometer | Med Associates Inc. | ENV-351W | Infrared sensor system for detecting beam interception by snout |
| Food pellets | Bio-Serv | F0163 | Dustless precisions food pellets (20 mg rodent grain-based diet) |
| Food dispenser | Med Associates Inc. | ENV-203-20 | Automated food dispensing system consisting of elevated plastic container and dispensing tube |
| Food receptacle | Med Associates Inc. | ENV-303R2W | Infrared sensitive base to signal when food pellet is dispensed or collected |
| Climbing mesh | Med Associates Inc. | CT-Climbing mesh | Durable metal rungs, dimensions |
| Med PC IV software | Med Associates Inc. | SOF-735 | Integrates data acquisition from all electronic devices |
| MPC2XL v1.4 | Med Associates Inc. | SOF-731 | Raw data transfer utility |
| Soft CR Pro v1.05 | Med Associates Inc. | SOF-722 | Remote online monitoring software |
| Running wheel | Med Associates Inc. | CT-MSUB-ENV-3042-X1 | Activity wheel for mice |
| Digital counter | Med Associates Inc. | ESUB-ENV-3000 | LCD counter (4 counts = 1 revolution = 54.6 cm length) |
| Picolo Diligent frame grabber | Euresys | High-resolution PCI video capture card | |
| Ethovision XT 8.5 | Noldus Information Technology | Video-tracking software | |
| Camera | Panasonic | WV-BP334 | Digital, low-lux video camera suspended from a custom-made metal stand |
| Video Splitter | American Dynamics | ADQUAD87 | Integrates and digitizes inputs from 4 video cameras |
References
- Henn, F. A., McKinney, W. T., Meltzer, H. Y. Ch. 67. Psychopharmacology: The Third Generation of Progress . , 687-695 (1987).
- Hart, B. L. The behavior of sick animals. Vet. Clin. North Am. Small Anim. Pract. 21, 225-237 (1991).
- Kapadia, M., Sakic, B. Autoimmune and inflammatory mechanisms of CNS damage. Prog. Neurobiol. 95, 301-333 (2011).
- Rogers, D. C. Behavioral and functional analysis of mouse phenotype: SHIRPA, a proposed protocol for comprehensive phenotype assessment. Mamm. Genome. 8, 711-713 (1997).
- Moy, S. S. Mouse behavioral tasks relevant to autism: phenotypes of 10 inbred strains. Behav. Brain Res. 176, 4-20 (2007).
- Gulinello, M., Putterman, C. The MRL/lpr mouse strain as a model for neuropsychiatric systemic lupus erythematosus. J. Biomed. Biotechnol. 2011, 207504 (2011).
- Marchese, M. Autoimmune manifestations in the 3xTg-AD model of Alzheimer’s disease. J. Alzheimers. Dis. 39, 191-210 (2014).
- Sakic, B. A behavioral profile of autoimmune lupus-prone MRL mice. Brain Behav. Immun. 6, 265-285 (1992).
- Sakic, B., Szechtman, H., Denburg, S. D., Carbotte, R. M., Denburg, J. A. Spatial learning during the course of autoimmune disease in MRL mice. Behav. Brain Res. 54, 57-66 (1993).
- Sakic, B. Disturbed emotionality in autoimmune MRL-lpr mice. Physiol. Behav. 56, 609-617 (1994).
- Visser, L., van den Bos, R., Kuurman, W. W., Kas, M. J., Spruijt, B. M. Novel approach to the behavioural characterization of inbred mice: automated home cage observations. Genes Brain Behav. 5, 458-466 (2006).
- Sakic, B. The use of integrated behavioral station in chronic behavioral studies. Measuring Behavior. , 328 (2008).
- Shinzawa, K. Neuroaxonal dystrophy caused by group VIA phospholipase A2 deficiency in mice: a model of human neurodegenerative disease. J. Neurosci. 28, 2212-2220 (2008).
- Quintana, A., Kruse, S. E., Kapur, R. P., Sanz, E., Palmiter, R. D. Complex I deficiency due to loss of Ndufs4 in the brain results in progressive encephalopathy resembling Leigh syndrome. Proc. Natl. Acad. Sci. U. S. A. 107, 10996-11001 (2010).
- Irwin, S. Comprehensive observational assessment: Ia. A systematic, quantitative procedure for assessing the behavioral and physiologic state of the mouse. Psychopharmacologia. 13, 222-257 (1968).
- Crawley, J. N. . What’s Wrong With My Mouse?: Behavioral Phenotyping of Transgenic and Knockout Mice. , (2007).
- Feeney, D. M., Gonzales, A., Law, W. A. Amphetamine, haloperidol and experience interact to affect rate of recovery after motor cortex injury. Science. 217, 855-857 (1982).
- Stanley, J. L. The mouse beam walking assay offers improved sensitivity over the mouse rotarod in determining motor coordination deficits induced by benzodiazepines. J. Psychopharmacol. 19, 221-227 (2005).
- Gulinello, M., Chen, F., Dobrenis, K. Early deficits in motor coordination and cognitive dysfunction in a mouse model of the neurodegenerative lysosomal storage disorder, Sandhoff disease. Behav. Brain Res. 193, 315-319 (2008).
- Rustay, N. R., Wahlsten, D., Crabbe, J. C. Influence of task parameters on rotarod performance and sensitivity to ethanol in mice. Behav. Brain Res. 141, 237-249 (2003).
- Kapadia, M. Altered olfactory function in the MRL model of CNS lupus. Behav. Brain Res. 234, 303-311 (2012).
- Jhuang, H. Automated home-cage behavioural phenotyping of mice. Nat. Commun. 1, 68 (2010).
- Steele, A. D., Jackson, W. S., King, O. D., Lindquist, S. The power of automated high-resolution behavior analysis revealed by its application to mouse models of Huntington’s and prion. Proc. Natl. Acad. Sci. U. S. A. 104, 1983-1988 (2007).
- Zarringhalam, K. An open system for automatic home-cage behavioral analysis and its application to male and female mouse models of Huntington’s disease. Behav. Brain Res. 229, 216-225 (2012).
- Chaumont, F. Computerized video analysis of social interactions in mice. Nat. Methods. 9, 410-417 (2012).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: interactive machine learning for automatic annotation of animal behavior. Nat. Methods. 10, 64-67 (2013).
- Weissbrod, A. Automated long-term tracking and social behavioural phenotyping of animal colonies within a semi-natural environment. Nat. Commun. 4, 2018 (2013).

