Comportamiento Fenotipificación de modelos murinos de enfermedades con la Estación Integrada Comportamiento (InBest)
Summary
Monitoreo prolongado y exhaustivo de los ratones en un ambiente en el hogar jaula proporciona una comprensión más profunda de la conducta aberrante en modelos murinos de enfermedades cerebrales. Este artículo describe la estación del Comportamiento Integrado (InBest) como componente clave del análisis del comportamiento contemporáneo.
Abstract
Debido a los rápidos avances en la ingeniería genética, pequeños roedores se han convertido en los temas preferidos en muchas disciplinas de la investigación biomédica. En los estudios de trastornos crónicos del SNC, existe una creciente demanda de los modelos murinos con alta validez en el nivel de comportamiento. Sin embargo, varios mecanismos patogénicos y los déficits funcionales complejas a menudo imponen retos para medir de forma fiable e interpretar el comportamiento de los ratones enfermos crónicos. Por lo tanto, se requiere la evaluación de la patología periférica y un perfil de comportamiento en varios puntos de tiempo utilizando una batería de pruebas. Vídeo-tracking, la espectroscopia de comportamiento, y la adquisición remota de medidas fisiológicas son tecnologías que permiten el análisis del comportamiento integral, precisa e imparcial en un hogar-base-como surgiendo. Este informe describe un protocolo de fenotipos refinada, que incluye un aparato de monitorización del cliente (estación de comportamiento integrado, InBest) que se centra en las mediciones prolongadas de basalidas funcionales sic, como la actividad espontánea, la comida / toma de agua y la conducta motivada en un ambiente relativamente libre de estrés. Las mejoras técnicas y conceptuales en el diseño InBest pueden promover una mayor reproducibilidad y la estandarización de los estudios de comportamiento.
Introduction
Los rápidos avances en la ingeniería genética en los últimos decenios han conducido a una proliferación sin precedentes de modelos animales de enfermedades humanas. Los ratones han adquirido la condición de sujetos experimentales primarios en ciencias biomédicas por varias razones. Desde un punto de vista práctico, tienen una alta tasa de reproducción, son relativamente baratos, y son fáciles de casa. Desde un punto de vista conceptual, que son genéticamente cercanos a los humanos, pueden ser modificadas genéticamente con relativa facilidad, y han endocrino, inmune y nervioso altamente desarrollado. Además de las lesiones en los niveles genéticos y celulares, los estudios contemporáneos de trastornos cerebrales requieren la demostración de los déficits funcionales replicables que cara más destacado, construir, o validez predictiva de un nuevo modelo de ratón 1.
Una infección aguda en un mamífero homeotermos a menudo resulta en la respuesta febril, que junto con comportamiento de la enfermedad, constituye una de lasprincipales mecanismos de supervivencia 2. Plenamente animales enfermos presentan alteraciones significativas en los alimentos / la ingesta de agua y el rendimiento en tareas de reflexión de la reactividad emocional, conducta exploratoria, y la capacidad de aprendizaje / memoria. Estos cambios explican en gran parte la actividad social / alteración sexual y la conservación de la energía para las reacciones inmunológicas defensivas. Sin embargo, cuando las condiciones agudas se convierten crónica (como se ve en muchos inmunológico, endocrino y enfermedades neurológicas), el rendimiento de comportamiento puede empeorar aún más debido al daño estructural de diversos órganos, incluyendo el cerebro 3.
Enfermedades neurodegenerativas humanas y animales son a menudo acompañadas por una constelación de déficits neurológicos y de comportamiento. Por lo tanto, un objetivo clave en los estudios de comportamiento de los animales enfermos crónicos es distinguir los efectos centrales de los déficits inducidos por sintomatología periférica. Sin embargo, la relativamente corta duración de las tareas de comportamiento estándar limita el cobro revertidoion de la información relativa a las medidas funcionales básicos, como el olfato, el descanso, el sueño, la alimentación / consumo de agua, o episodios epilépticos. La inclusión de estas medidas de mejora de perfiles de comportamiento y permite una mejor interpretación de los resultados en las tareas de actividad exigente.
Los refinamientos en el fenotipo conductual de los ratones enfermos
Las deficiencias en la evaluación del perfil de comportamiento de los ratones enfermos han hecho necesario el monitoreo continuo de los ratones que viven solos por PC-rápido procesamiento. Aunque diversas baterías de comportamiento pueden ser diseñados 4, 5, se enumeran a continuación son los procedimientos que se han utilizado para establecer con éxito un modelo animal de lupus neuropsiquiátrico 6. Esta batería se aplica repetidamente en ambos modelos sub-crónicas y crónicas de la enfermedad (Figura 1), tales como deterioro cognitivo leve y la enfermedad de Alzheimer 7. Tras una serie de pruebas neurológicas 8-10, acaparatos ustom hecha, diseñado para satisfacer las demandas anteriores mediante la utilización de la monitorización continua de múltiples salidas de comportamiento en un ambiente en el hogar-jaula-como enriquecido, puede ser empleado. Tal enfoque etológico-a la evaluación de la actividad exploratoria espontánea y la conducta motivada proporciona una comprensión más completa de los déficits de rendimiento en otros paradigmas, tales como los reflectante del aprendizaje y la memoria.
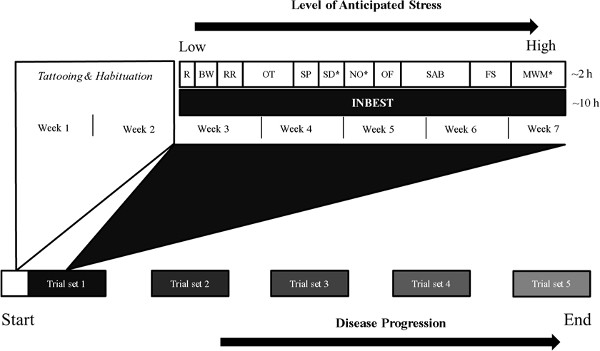
Figura 1. Representación esquemática de fenotipado conductual longitudinal en nuestro laboratorio. La batería de comportamiento está diseñado para evolucionar de menos- hacia más- tareas estresantes, que se repiten en diferentes momentos de la hora de evaluar los efectos de los factores sostenidos, como la progresión de la enfermedad, el tratamiento farmacológico o respuestas inmunológicas. Pruebas InBest e individuales se llevan a cabo durante el p oscurohase, a menudo más de 10 y 2 horas, respectivamente Abreviaturas:. R – reflejos; BW – Manga Corta prueba; RR – rotarod; OT – pruebas olfativas; SP – Prueba de Preferencia sacarosa; SD – De bajada de prueba; NO – prueba objeto de Novela; DE – prueba en campo abierto; SAB – Comportamiento alternancia espontánea; FS – prueba de natación forzada; MWM – laberinto acuático de Morris. * – Aspectos de la prueba (por ejemplo, la ubicación, el contexto, color, forma) que necesitan ser alterados en los ensayos posteriores a lo largo curso de experimento.
Continua la grabación en vídeo y análisis de comportamiento en un ambiente en el hogar-jaula-como se informó por primera vez en 2007 11. Un aparato automático más complejo que integra las pruebas de comportamiento utilizados en estudios con ratones autoinmune fue presentado en el 'Comportamiento de medición' cumplir un año más tarde 12. La estación de Behavioral integrado (InBest, Figura 2A) es un sistema modular, que comprises de un estímulo luminoso refugio, controlado por ordenador, dos lickometers fotocélulas controladas (uno para el agua, uno para una solución de interés), un dispensador automático de comida, una rueda para correr computarizado, y una malla de escalada digitalizada. Latencias, frecuencias y duraciones de comportamientos específicos son examinados usando software personalizado. Locomotor y la actividad exploratoria (por ejemplo, de un objeto de novela o una misma especie desconocida) se puede evaluar con el software de vídeo-seguimiento (Lista de Materiales / Equipo), durante el sueño y los patrones de comportamiento menos frecuentes, como el comportamiento y las convulsiones de auto-lesión, puede se marcarán manualmente con el software de vídeo de seguimiento de paquetes o evento de grabación dedicados. Se utilizan ocho ajustes InBest / vídeo completas, permitiendo así la supervisión concurrente de 4 animales control experimentales y 4 (Figura 2B).
<img alt="Figura 2" src="/files/ftp_upload/51524/51524fig2.jpg" />
Figura 2. Estación Conductual Integrada. (A) Representación esquemática de hardware, y el software utilizado en el diseño de una caja InBest (L = 39 x W x H = 53 = 50 cm). (B) Ocho cajas InBest completas proporcionan una oportunidad para vigilancia de la casa-jaula concurrente de cuatro ratones experimentales y cuatro de control. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Las variables dependientes incluyen mediciones de la ingesta de alimentos / agua, la capacidad de respuesta a la estimulación agradable al paladar, la actividad ambulatoria espontánea, escalada, carrera voluntaria, los comportamientos relacionados con la ansiedad (por ejemplo, la exploración de la novela objeto), el aseo, la incautación y el dormir. Además, los estímulos visuales pueden ser presentados para el acondicionamiento y de aprendizaje paradigmas. Las ventajas de InBest más de las pruebas de comportamiento estándar incluyen la eliminación de induc efectos de confusióned por el estrés del transporte, así como continua colección, automatizado de medidas reflectantes de actividad nocturna, exploración, relacionado con la ansiedad y comportamientos depresivo-como. La integración de los componentes de hardware sensibles con un paquete de vídeo-seguimiento produce una gran cantidad de información, lo que permite una mejor evaluación de la conducta en relación con la progresión de la enfermedad crónica en diversos modelos animales. InBest se puede utilizar para estudiar otros trastornos crónicos del SNC (por ejemplo, autismo, depresión mayor, esquizofrenia), así como en estudios longitudinales centrados en el desarrollo neurológico, efectos conductuales de trastornos sistémicos / neoplásica, y la farmacoterapia prolongada.
Protocol
Representative Results
Discussion
La detección de los efectos funcionales en animales depende en gran medida de la capacidad del investigador para limitar la variabilidad inherente a los estudios de comportamiento. Por lo tanto, es importante meticulosamente control y minimizar los posibles factores de confusión que pueden reducir la fiabilidad y reproducibilidad de los datos de comportamiento. Al mismo tiempo, es importante reconocer que ninguna prueba refleja un único dominio de la conducta, que el conocimiento de la función neurológica es obligatoria, y que el comportamiento es muy sensible a los factores de estrés externos. Si se aprecian los postulados anteriores, se puede concluir que el análisis del comportamiento integral debe incluir la evolución temporal de la respuesta medida, así como, involucrar a los rasgos y paradigmas que aprovechan los aspectos conductuales específicas funcionales básicos. Muchos de estos criterios pueden cumplirse mediante la evaluación informatizada de los movimientos y actos de comportamiento en un ambiente en el hogar-jaulas acondicionadas.
Hasta el momento, ha sido emphasized fenotipificación que la conducta de los modelos murinos de enfermedad justifica humanos Consideraciones adicionales. Esta idea se basa en la premisa de que la homeostasis funcional es desafiado por factores estresantes internos y externos durante la aparición de la enfermedad. Aunque todos los factores de confusión potenciales no pueden ser eliminados por la introducción de automatizado, el fenotipo casa-jaula, las cuestiones relativas a los ajustes inconsistentes ambientales, el estrés del transporte y la manipulación repetida se reducen al mínimo. Esto mejora significativamente la consistencia y precisión en todos los estudios; incluso pequeñas reducciones en la variabilidad puede mejorar la detección de los efectos inducidos por una enfermedad incipiente. De hecho, InBest proporciona una gran cantidad de información, que permite una evaluación más precisa de la aparición, la cinética, y la gravedad de los cambios de comportamiento, así como las relaciones importantes entre los diversos déficit de comportamiento inducida por la enfermedad. Fiable vídeo-seguimiento depende de dos condiciones de iluminación. En primer lugar, es necesaria la luz difusa en la sala de pruebas para prevenirartefactos de objetos cercanos que reflejan. En segundo lugar, el contraste de color alta se puede lograr mediante la elección de un color del piso apropiado para diferir de la de color sujetos tanto como sea posible. En nuestro laboratorio, esto se logra mediante el uso de inundación luces situadas debajo de las cajas y bandejas InBest suelo negro en el seguimiento de los ratones albino (fondo blanco o gris sería adecuado si las pruebas cepas pigmentadas). Con respecto al aspecto de grabación de eventos de InBest, la configuración de hardware actual (1 tarjeta de vídeo Piccolo con 4 entradas) limita 4 cajas para ser utilizados simultáneamente por PC. Esto es más bien un pequeño número de cajas, mientras que una más conveniente set-up requeriría 8 o incluso 16 jaulas, y por lo tanto 2 o 4 PCs, respectivamente. Preferiblemente, InBest puede usarse continuamente durante 24 horas como la casa-jaula. Esto permitiría que los animales se habitúan a plenamente al entorno y establecen, patrones de comportamiento circadiano estables, que pueden ser analizados de una manera imparcial. Para evitar la pérdida de datos de la computadora debido a un corte de energía, una energía continua Doplicar (o al menos una fuente de alimentación ininterrumpida) deben estar asegurados. Por último, para asegurar la correcta evaluación de la ingesta diaria de alimentos, debe tenerse en cuenta que el tamaño de gránulos de comida no debe exceder el tamaño de los agujeros en el dispensador de comida (el tamaño recomendado de una sola bola de comida es 20 mg).
No se debe pasarse por alto, sin embargo, que este análisis debe incorporar también la forma en diferentes medidas InBest pueden interactuar entre sí. Por ejemplo, los ratones que pasan más tiempo en la rueda para correr son propensos a ingerir mayores cantidades de alimentos y agua para satisfacer sus crecientes demandas calóricas. De manera similar, los ratones que ingieren más solución de sacarosa pueden disminuir la ingesta de alimentos. La interpretación de estos resultados puede además ser complicado por la mejora general del rendimiento en el tiempo, sobre todo en lo que respecta a la actividad de ingestión rueda comportamiento y funcionamiento. Dadas sus incentivos-propiedades, los experimentadores pueden también considerar que limita el acceso a la solución de sacarosa ytque se ejecuta la rueda para contrarrestar la probabilidad de efectos post-ingestivas y pérdida excesiva de peso, respectivamente. Sin embargo, estas preocupaciones pueden ser más relevantes en algunas cepas que otros debido a que diferentes cepas de ratones tienen perfiles de comportamiento diferentes. Aunque funciona tanto basal y controles de evaluación experimentales para muchos de los aspectos mencionados anteriormente, los experimentadores tienen que reconocer que estas variables deben tenerse en cuenta al interpretar los datos InBest. Al mismo tiempo, algunos aspectos de la conducta no pueden ser estudiados en el entorno familiar de jaula, y necesitan de una combinación con las pruebas estándar para completar el perfil de comportamiento de los sujetos.
Monitoreo electrónico en un plazo estándar, pero los entornos flexibles parece ser el siguiente paso lógico en el análisis del comportamiento contemporáneo. Este enfoque no invasivo, etológico-permitirá a los investigadores observar el repertorio completo de las respuestas de comportamiento durante un período prolongado de tiempo. Laoretically, esto se puede lograr mediante el estudio de comportamiento en un "virtual", ambiente enriquecido que se asemeja a un hábitat natural. Varios grupos de investigación han descrito las herramientas de seguimiento basados en la visión que apoyan el fenotipo conductual de los ratones en su casa 22-25-jaula, en díadas 26, 27, o en el contexto de los grandes grupos sociales 28. De alta precisión y resolución espacial se puede lograr mediante la integración de vídeo de seguimiento con la tecnología de microchip para la recogida simultánea y sincronizada de los datos de comportamiento en un grupo de ratones 28. Cámaras termográficas capaz de detectar las firmas de calor se pueden combinar con microchips o transpondedores implantables para proporcionar la ubicación relativa y las funciones fisiológicas básicas de cada ratón (por ejemplo, la temperatura del cuerpo, corazón / tasa de respiración). Además, un sistema de seguimiento 3D avanzada produciría un reconocimiento más preciso y cuantitativa de los actos de comportamiento. Con el fin de ejecutar repetidamente una variso- de pruebas, un sistema de este tipo debe ser automatizado, controlado de forma remota, y modular. Por ejemplo, la memoria espacial puede estudiarse en entornos más grandes mediante la programación de la aparición de señales distales en las paredes de LCD, o mediante la presentación / ocultar dispensadores de comida sabrosa de fondos móviles. De una manera similar, nuevos objetos podrían ser presentados / escondido en momentos específicos durante todo el estudio. Tal fenotipificación computarizada puede ayudar en el esclarecimiento de los determinantes genéticos de la conducta, los mecanismos patogénicos modelos de enfermedades subyacentes, y el desarrollo de nuevas estrategias terapéuticas. Si se llega a un consenso con respecto a las condiciones de las pruebas, de los ensayos, así como el hardware y el software utilizado, se puede esperar que la normalización esperada sería mejorar la reproducibilidad de los estudios de comportamiento y elevar la psicometría experimentales a un nuevo nivel.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by an Ontario Mental Health Foundation grant to B.S, and an Ontario Graduate Scholarship to M.K.
Materials
| Power control interface operating package | Med Associates Inc. | MED-SYST-8 | Interface box and PCI card that manage all A/D data inputs and outputs |
| Stimulus light | Med Associates Inc. | ENV-221M | 28 V DC, 100 mA, 2.5 cm diameter light (for presentation of a conditioned stimulus) |
| Head entry detector | Med Associates Inc. | ENV-254-CB | Permits head entry detection into the pellet receptacle |
| Photobeam lickometer | Med Associates Inc. | ENV-351W | Infrared sensor system for detecting beam interception by snout |
| Food pellets | Bio-Serv | F0163 | Dustless precisions food pellets (20 mg rodent grain-based diet) |
| Food dispenser | Med Associates Inc. | ENV-203-20 | Automated food dispensing system consisting of elevated plastic container and dispensing tube |
| Food receptacle | Med Associates Inc. | ENV-303R2W | Infrared sensitive base to signal when food pellet is dispensed or collected |
| Climbing mesh | Med Associates Inc. | CT-Climbing mesh | Durable metal rungs, dimensions |
| Med PC IV software | Med Associates Inc. | SOF-735 | Integrates data acquisition from all electronic devices |
| MPC2XL v1.4 | Med Associates Inc. | SOF-731 | Raw data transfer utility |
| Soft CR Pro v1.05 | Med Associates Inc. | SOF-722 | Remote online monitoring software |
| Running wheel | Med Associates Inc. | CT-MSUB-ENV-3042-X1 | Activity wheel for mice |
| Digital counter | Med Associates Inc. | ESUB-ENV-3000 | LCD counter (4 counts = 1 revolution = 54.6 cm length) |
| Picolo Diligent frame grabber | Euresys | High-resolution PCI video capture card | |
| Ethovision XT 8.5 | Noldus Information Technology | Video-tracking software | |
| Camera | Panasonic | WV-BP334 | Digital, low-lux video camera suspended from a custom-made metal stand |
| Video Splitter | American Dynamics | ADQUAD87 | Integrates and digitizes inputs from 4 video cameras |
References
- Henn, F. A., McKinney, W. T., Meltzer, H. Y. Ch. 67. Psychopharmacology: The Third Generation of Progress . , 687-695 (1987).
- Hart, B. L. The behavior of sick animals. Vet. Clin. North Am. Small Anim. Pract. 21, 225-237 (1991).
- Kapadia, M., Sakic, B. Autoimmune and inflammatory mechanisms of CNS damage. Prog. Neurobiol. 95, 301-333 (2011).
- Rogers, D. C. Behavioral and functional analysis of mouse phenotype: SHIRPA, a proposed protocol for comprehensive phenotype assessment. Mamm. Genome. 8, 711-713 (1997).
- Moy, S. S. Mouse behavioral tasks relevant to autism: phenotypes of 10 inbred strains. Behav. Brain Res. 176, 4-20 (2007).
- Gulinello, M., Putterman, C. The MRL/lpr mouse strain as a model for neuropsychiatric systemic lupus erythematosus. J. Biomed. Biotechnol. 2011, 207504 (2011).
- Marchese, M. Autoimmune manifestations in the 3xTg-AD model of Alzheimer’s disease. J. Alzheimers. Dis. 39, 191-210 (2014).
- Sakic, B. A behavioral profile of autoimmune lupus-prone MRL mice. Brain Behav. Immun. 6, 265-285 (1992).
- Sakic, B., Szechtman, H., Denburg, S. D., Carbotte, R. M., Denburg, J. A. Spatial learning during the course of autoimmune disease in MRL mice. Behav. Brain Res. 54, 57-66 (1993).
- Sakic, B. Disturbed emotionality in autoimmune MRL-lpr mice. Physiol. Behav. 56, 609-617 (1994).
- Visser, L., van den Bos, R., Kuurman, W. W., Kas, M. J., Spruijt, B. M. Novel approach to the behavioural characterization of inbred mice: automated home cage observations. Genes Brain Behav. 5, 458-466 (2006).
- Sakic, B. The use of integrated behavioral station in chronic behavioral studies. Measuring Behavior. , 328 (2008).
- Shinzawa, K. Neuroaxonal dystrophy caused by group VIA phospholipase A2 deficiency in mice: a model of human neurodegenerative disease. J. Neurosci. 28, 2212-2220 (2008).
- Quintana, A., Kruse, S. E., Kapur, R. P., Sanz, E., Palmiter, R. D. Complex I deficiency due to loss of Ndufs4 in the brain results in progressive encephalopathy resembling Leigh syndrome. Proc. Natl. Acad. Sci. U. S. A. 107, 10996-11001 (2010).
- Irwin, S. Comprehensive observational assessment: Ia. A systematic, quantitative procedure for assessing the behavioral and physiologic state of the mouse. Psychopharmacologia. 13, 222-257 (1968).
- Crawley, J. N. . What’s Wrong With My Mouse?: Behavioral Phenotyping of Transgenic and Knockout Mice. , (2007).
- Feeney, D. M., Gonzales, A., Law, W. A. Amphetamine, haloperidol and experience interact to affect rate of recovery after motor cortex injury. Science. 217, 855-857 (1982).
- Stanley, J. L. The mouse beam walking assay offers improved sensitivity over the mouse rotarod in determining motor coordination deficits induced by benzodiazepines. J. Psychopharmacol. 19, 221-227 (2005).
- Gulinello, M., Chen, F., Dobrenis, K. Early deficits in motor coordination and cognitive dysfunction in a mouse model of the neurodegenerative lysosomal storage disorder, Sandhoff disease. Behav. Brain Res. 193, 315-319 (2008).
- Rustay, N. R., Wahlsten, D., Crabbe, J. C. Influence of task parameters on rotarod performance and sensitivity to ethanol in mice. Behav. Brain Res. 141, 237-249 (2003).
- Kapadia, M. Altered olfactory function in the MRL model of CNS lupus. Behav. Brain Res. 234, 303-311 (2012).
- Jhuang, H. Automated home-cage behavioural phenotyping of mice. Nat. Commun. 1, 68 (2010).
- Steele, A. D., Jackson, W. S., King, O. D., Lindquist, S. The power of automated high-resolution behavior analysis revealed by its application to mouse models of Huntington’s and prion. Proc. Natl. Acad. Sci. U. S. A. 104, 1983-1988 (2007).
- Zarringhalam, K. An open system for automatic home-cage behavioral analysis and its application to male and female mouse models of Huntington’s disease. Behav. Brain Res. 229, 216-225 (2012).
- Chaumont, F. Computerized video analysis of social interactions in mice. Nat. Methods. 9, 410-417 (2012).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: interactive machine learning for automatic annotation of animal behavior. Nat. Methods. 10, 64-67 (2013).
- Weissbrod, A. Automated long-term tracking and social behavioural phenotyping of animal colonies within a semi-natural environment. Nat. Commun. 4, 2018 (2013).

