Détection glycogène dans les cellules mononucléaires du sang périphérique avec l'acide périodique Schiff coloration
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
L'acide périodique Schiff (PAS) est une technique de coloration immunohistochimique qui est largement utilisé dans la recherche et le diagnostic musculaire. Il est également utilisé comme outil de diagnostic dans des échantillons de sang. La technique fonctionne en appliquant une solution d'acide périodique à l'échantillon, qui se oxyde à l'intérieur des unités de polysaccharide créer des groupes aldéhyde qui réagissent avec le réactif de Schiff l'incolore pour produire ainsi un produit de magenta foncé. Les étapes de cette procédure sont représentées sur la figure 1. La tache tourne avec quoi que ce soit, y compris des polysaccharides magenta glycogène, les glycoprotéines, les glycolipides, les mucines, ou d'autres molécules ayant des groupements polysaccharidiques.
Coloration PAS est souvent utilisé pour mesurer les niveaux de glycogène dans les fibres musculaires. Muscles sections de tissus sont idéales pour la technique qu'ils attachent fermement à la diapositive et résister à de multiples étapes de lavage et de coloration. Le glycogène est plus présent dans contraction rapide de type II fibres musculaires, qui ont une forte demandepour la production d'ATP rapide nécessitant glycogène pour 1,2 de performance maximale. Le glycogène est un polymère ramifié du glucose qui peut être divisé en glucose libre par l'action d'enzymes de la glycogène Phosphorylase. Dans les temps de repos et de suffisance nutritionnelle, le glycogène est reconstitué par le processus de glycogenèse, tandis qu'en temps de l'insuffisance ou de haute énergie nutritionnelle la demande; glycogène est décomposé en glucose par glycogénolyse. De dès les années 1950, les cliniciens-chercheurs ont exploré la coloration PAS sur des échantillons de sang pour analyser le contenu de glycogène dans diverses maladies 3-7. Par exemple, dans la maladie de Pompe, une glycogénose de bonne foi globules blancs aux maladies accumulent de grandes quantités de glycogène qui diffère sensiblement de 8 témoins sains.
Cet article explique-vidéo d'une version adaptée de coloration PAS pour une utilisation sur des cellules périphériques mononucléaires de sang périphérique (PBMC) des échantillons de sang veineux de sujets humains en bonne santé. PBMCs contient essentiellement des lymphocytes du lymphocyte T et les familles de lymphocytes B, ainsi que d'autres cellules du système immunitaire telles que des cellules et des monocytes tueurs naturels. La première étape de purification élimine les erythrocytes, les neutrophiles, les granulocytes et d'autres. Cette technique fournit des données sur une partie de concentré pour la numération des lymphocytes permettant plus robuste de cellules de PAS-positif par rapport à l'aide de frottis de sang total.
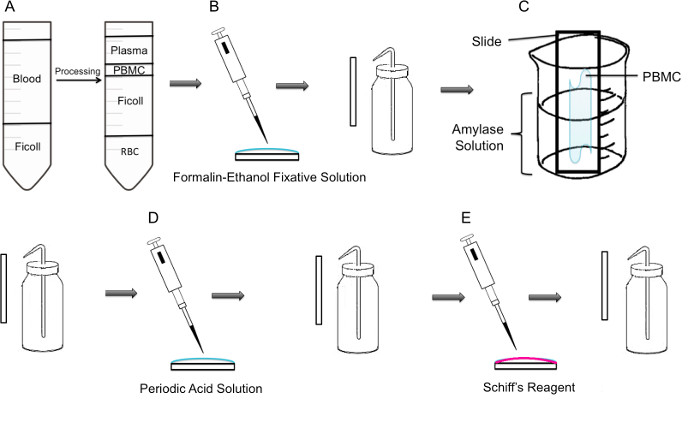
Figure 1:. Étape par la méthodologie de l'étape de la coloration PAS sur CMSP (A) d'abord, l'isolement des PBMC est réalisé par gradient de ficoll, le panneau de gauche montre la préparation avant la centrifugation, le panneau de droite montre après centrifugation où la couche leucocytaire contenant les PBMC On observe dans le centre du tube. (B) PBMC isolées sont fixées sur la lame à l'aide de formol-éthanol solu fixantstion. La lame est doucement rincé avec de l'eau distillée dans une bouteille de lavage en matière plastique. (C) La lame est ensuite placé dans un bécher de 100 ml rempli à mi-chemin avec une solution d'amylase, qui dissoudra glycogène. La lame est rincée doucement. (D) La lame est traité avec une solution d'acide périodique, où l'oxydation des saccharides a lieu. Les lames sont rincés doucement; cela va enlever l'excès de l'acide périodique et arrêter l'étape d'oxydation. (E) Lorsque le réactif de Schiff est ajouté aux lames, il va réagir avec des aldéhydes créés au cours de l'étape d'oxydation. Ce réactif incolore va alors donner un produit magenta rouge profond. Les lames sont doucement rincées pour éliminer le réactif Schiff excès.
Protocol
Representative Results
Discussion
Les étapes essentielles du présent article vidéo étaient au cours du lavage et de l'amylase traitement des cellules. Alors que le lavage des lames, l'étape clé utilisait une bouteille de lavage compressible plastique et laisser couler l'eau doucement à travers l'échantillon sur la lame et ne visant pas directement sur les échantillons. Même la pression d'eau directe moindre causerait les cellules à venir de la lame. Une autre étape clé était d'utiliser la même diapositive pendant ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
References
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). 생화학. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

