Ex Situ Normotérmica máquina de perfusão de fígados doados
Summary
Aqui apresentamos um protocolo descrevendo ex oxigenado máquina de perfusão in situ de enxertos de doadores de fígado. Este artigo contém um passo a passo protocolo de adquirir e preparar o enxerto de fígado para a máquina de perfusão, preparar o líquido de perfusão, privilegiada a máquina de perfusão e executar oxigenado máquina de perfusão normotérmica do enxerto de fígado.
Abstract
Em contraste com a preservação frio estática convencional (0-4 ° C), à saída da máquina de perfusão in situ pode proporcionar uma melhor preservação dos fígados de doadores. Perfusão contínua de órgãos proporciona a oportunidade para melhorar a qualidade de órgãos e permite a avaliação de viabilidade ex situ de fígados de doadores antes do transplante. Este artigo de vídeo fornece um protocolo passo-a-passo por ex situ máquina de perfusão normotérmica (37 ° C) de fígados de dadores humanos utilizando um dispositivo que fornece uma pressão e temperatura controlada pulsátil de perfusão da artéria hepática e perfusão contínua da veia porta. O fluido de perfusão é oxigenado pelo oxigenador de membrana de fibra duas ocas e a temperatura pode ser regulada entre 10 ° C e 37 ° C. Durante a perfusão, a actividade metabólica do fígado, bem como o grau de lesão pode ser avaliada através de análises bioquímicas de amostras colhidas a partir do fluido de perfusão. Máquina de perfusão é uma ferramenta muito promissorapara aumentar o número de fígados que são adequados para transplantação.
Introduction
O actual método de preservação de órgãos em transplante de fígado é lavar com e posterior armazenamento de fígados de doadores no frio (0-4 ° C) fluido de conservação (como University of Wisconsin solução ou solução de histidina-triptofano-Ketoglutarate). Este método é conhecido como armazenamento a frio estático (SCS). Embora a taxa metabólica de fígado a 0-4 ° C é muito baixo, existe ainda a procura de / min / g de tecido de fígado de 0,27 umol de oxigénio, o que não pode ser fornecida durante uma SCS. O método convencional de SCS, portanto, resulta em algum grau de lesão (adicional) de fígados de doadores. Embora este montante do prejuízo preservação não é um problema em fígados de doadores de boa qualidade, ele pode se tornar um fator crítico e limitando em fígados sub�timas que já sofreram algum grau de lesão no doador. Por esta razão, fígados com qualidade abaixo do ideal ou chamados critérios estendida doadoras (ECD) fígados são freqüentemente rejeitados para transplante como o rei de riscof falha precoce do enxerto é considerado demasiado elevado. Altas taxas de função retardada do enxerto, não-função primária, e estenose biliar não-anastomóticas (NAS) foram descritos nos receptores de fígados de doação após a morte circulatório (DCD), os doadores mais velhos ou beneficiários de enxertos esteatóticos 2. NAS são uma das principais causas de morbidade e mortalidade após transplante de fígado. NAS pode ocorrer em ambos os canais biliares extra-doador e intra-hepáticos e pode ser acompanhada pela lama biliar intraductal e formação de fundido de 3,4. Embora a etiologia da NAS é pensado para ser multifactorial, lesão de isquemia / reperfusão dos ductos biliares durante a preservação do enxerto e transplante tem sido identificada como um importante mecanismo subjacente 2,5. O transplante de um enxerto DCD foi identificada como um dos factores de risco mais fortes para o desenvolvimento do NAS. A combinação de um período de isquemia quente em um doador DCD, isquemia fria durante preservação de órgãos, e reperfusão subsequentelesão no receptor é pensado para ser responsável pela lesão irreversível das vias biliares, o que, em combinação com uma baixa capacidade de regeneração dos ductos biliares, resulta em cicatrização fibrótica e estreitamento das vias biliares, após o transplante de fígado 2,5. NAS têm sido relatados em até 30% dos pacientes que receberam um fígado DCD 6-8. Tornou-se claro que o método actual de SCS de enxertos para transplantação de fígado é insuficiente para fígados de DPI preinjured tais como aqueles a partir de doadores de DCD. Os métodos alternativos são necessários para aumentar e otimizar a utilização de fígados de DPI para transplante.
Máquina de perfusão (MP) é um método de conservação de órgãos que podem proporcionar uma melhor preservação de órgãos de dadores, em comparação com SCS. MP pode ser especialmente relevante para a preservação dos enxertos de DPI. Uma vantagem importante da MP é a possibilidade de fornecer oxigénio ao enxerto durante o período de conservação. MP pode ser realizado a várias temperaturas,que tenham sido classificadas como hipotérmica (0-10 ° C), subnormothermic (10-36 ° C) e normotérmica (36-37 ° C) Ponto de fusão (NMP). Dependendo da temperatura utilizada para o MP, o tipo de líquido de perfusão tem de ser ajustado e com o aumento da temperatura mais oxigénio deve ser fornecido. A primeira aplicação clínica de MP no transplante de fígado humano foi baseado em perfusão hipotérmica sem oxigenação activa do fluido de perfusão 9,10. Em modelos animais, MP oxigenado hipotérmico (0-10 ° C) tem mostrado ter efeitos protectores contra a isquemia / reperfusão do fígado enxertos 11 e para proporcionar uma melhor preservação do plexo vascular peribiliary da bílis condutas 12. Subnormothermic MP oxigenada a 20 ° C ou 30 ° C também tem sido estudado em modelos animais e foi mostrado para fornecer recuperação anterior da função do enxerto de fígado de DCD, em comparação com 13,14 SCS. A viabilidade de subnormothermic MP oxigenado de fígados humanos foi rectemente relatada numa série de sete doadores descartados fígados humanos 15. NMP (37 ° C) permite a avaliação da viabilidade do enxerto e funcionalidade antes do transplante 16,17. Além disso, permite a MP reaquecimento gradual do enxerto antes da transplantação de fígado, o que foi demonstrado para facilitar a recuperação e reanimação do enxerto 18.
O dispositivo de perfusão utilizado no protocolo de corrente para máquina de perfusão hepática dupla permite a perfusão (através da veia porta e da artéria hepática) utilizando duas bombas centrífugas, que proporcionam um fluxo portal contínuo e um fluxo arterial pulsátil. O sistema é controlado por pressão, permitindo a auto-regulação do fluxo através do fígado, dependendo da resistência intra-hepática. Dois oxigenadores de membranas de fibras ocas para permitir a oxigenação do enxerto de fígado, bem como para a remoção de CO 2. A temperatura pode ser regulada com base no tipo pretendido de MP (temperat mínimo ure de 10 ° C). Fluxo, pressão e temperatura são exibidas no dispositivo em tempo real, permitindo um controlo contínuo do processo de perfusão. Um novo conjunto descartável estéril de tubos, reservatório e oxigenadores está disponível para a perfusão de cada enxerto (Figura 1).
O objetivo deste artigo de vídeo é fornecer um passo a passo para o protocolo ex situ máquina de perfusão normotérmica dos fígados de doadores humanos usando esta máquina de perfusão de fígado recém-desenvolvido.
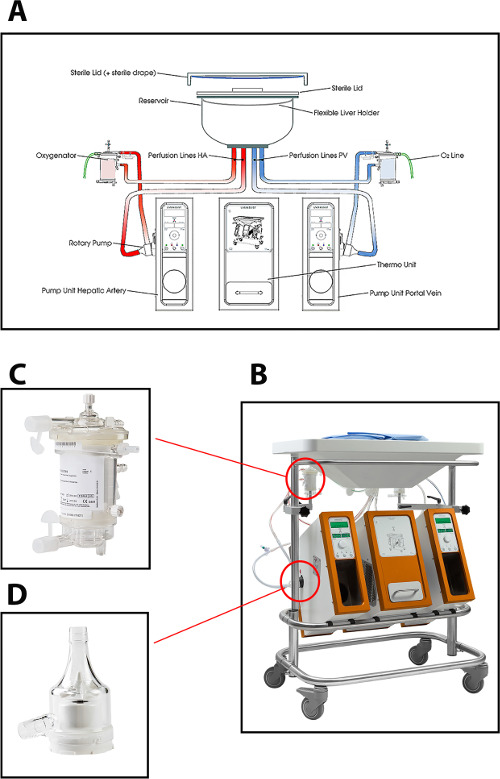
Figura 1: (A) Um desenho esquemático, (B) uma foto da máquina de perfusão, (C) uma visão mais próxima do oxigenador, e (D) da bomba centrífuga usada para a perfusão normotérmica dos fígados de doadores humanos.obter = "_ blank"> Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Este vídeo fornece um passo a passo para o protocolo máquina de perfusão normotérmica dos fígados de doadores humanos usando um dispositivo que permite a pressão controlada dupla perfusão através da veia artéria e porta hepática. Ao seguir este protocolo, as falhas técnicas da máquina de perfusão não ocorreu e todos os enxertos foram bem perfundidos e bem oxigenado. Os fígados perfundidos ex situ tinha hemodinamicamente estáveis e foram metabolicamente activo, tal como definido pela produ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho de pesquisa foi financiada por doações fornecidos por Innovatief Actieprogramma Groningen (IAG-3), Jan Kornelis de Cock Stichting e Tekke Huizingafonds, todos na Holanda. Estamos agradecidos a todos os coordenadores de transplante holandeses para identificar os potenciais descartado fígados e obtenção de consentimento informado.
Materials
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Meredith No.8 | Vygon Nederlands B.V. | 1362082 | Bile duct cannula |
| Human albumin 200g/l / ALBUMAN | Sanquin | 15522598 | 100 ml |
| Modified parenteral nutrition | Baxter Nederland B.V. | N14G30E | 7.35 ml |
| Multivitamins for infusion / CERNEVIT | Baxter International Inc. | 9800927 | 7 ul |
| Concentrated trace elements for infusion / NUTRITRACE | B. Braun Melsungen AG | 14811332 | 7.35 ml |
| Metronidazole 5mg/ml | Baxter Nederland B.V. | 98181882 | 40 ml |
| Cefazoline / SERVAZOLIN | Sandoz B.V. | 15611337 | 2 ml |
| Fast acting insulin | various vendors | 20 ml | |
| Calcium glubionate, intravenous solution 10%, 137.5 mg/mL | Sandoz | 97038695 | 40 ml |
| Sterile H2O | Fresenius Kabi Nederland B.V. | 98084453 | 51.3 ml |
| NaCl 0.9% | Baxter Nederland B.V. | 15262510 | 160 ml |
| Heparin 5000 IE/ml for i.v. administration | LEO Pharma B.V. | 98026178 | 4 ml |
| Sodium bicarbonate 8,4% | B. Braun Melsungen AG | 97973874 | The amount depends on the pH |
| Packed red blood cell (in SAGM) | Blood bank (Sanquin) | N0012000 | 750 ml |
| Fresh frozen plasma | Blood bank (Sanquin) | N04030A0/N04030B0 | 900 ml |
References
- Plaats, A., et al. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann. Biomed. Eng. 32 (4), 623-631 (2004).
- op den Dries, S., Sutton, M. E., Lisman, Y., Porte, R. J. Protection of bile ducts in liver transplantation: Looking beyond ischemia. Transplantation. 92 (4), 373-379 (2011).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary complications after liver transplantation: Old problems and new challenges. Am. J. Transplant. 13 (2), 253-265 (2013).
- Buis, C. I., et al. Nonanastomotic biliary strictures after liver transplantation, part 1: Radiological features and risk factors for early vs. late presentation. Liver. Transpl. 13 (5), 708-718 (2007).
- Karimian, N., op den Dries, S., Porte, R. J. The origin of biliary strictures after liver transplantation: Is it the amount of epithelial injury or insufficient regeneration that counts. J. Hepatol. 58 (6), 1065-1067 (2013).
- Gastaca, M. Biliary complications after orthotopic liver transplantation: A review of incidence and risk factors. Transplant. Proc. 44 (6), 1545-1549 (2012).
- Sanchez-Urdazpal, L., et al. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology. 16 (1), 49-53 (1992).
- Dubbeld, J., et al. Similar liver transplantation survival with selected cardiac death donors and brain death donors. Br. J. Surg. 97 (5), 744-753 (2010).
- Guarrera, J. V., et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am. J. Transplant. 10 (2), 372-381 (2010).
- Henry, S. D., et al. Hypothermic machine preservation reduces molecular markers of ischemia/reperfusion injury in human liver transplantation. Am. J. Transplant. 12 (9), 2477-2486 (2012).
- Schlegel, A., Rougemont, O., Graf, R., Clavien, P. A., Dutkowski, P. Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts. J. Hepatol. 58 (2), 278-286 (2013).
- op den Dries, S., et al. Hypothermic oxygenated machine perfusion prevents arteriolonecrosis of the peribiliary plexus in pig livers donated after circulatory death. PLoS. One. 9 (2), e88521 (2014).
- Tolboom, H., et al. Subnormothermic machine perfusion at both 20 degrees C and 30 degrees C recovers ischemic rat livers for successful transplantation. J. Surg. Res. 175 (1), 149-156 (2012).
- Gringeri, E., et al. Subnormothermic machine perfusion for non-heart-beating donor liver grafts preservation in a swine model: A new strategy to increase the donor pool? Transplant. Proc. 44 (7), 2026-2028 (2012).
- Bruinsma, B. G., et al. Subnormothermic machine perfusion for ex vivo preservation and recovery of the human liver for transplantation. Am. J. Transplant. 14 (6), 1400-1409 (2014).
- op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am. J. Transplant. 13 (5), 1327-1335 (2013).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS. One. 9 (11), (2014).
- Minor, T., Efferz, P., Fox, M., Wohlschlaeger, J., Luer, B. Controlled oxygenated rewarming of cold stored liver grafts by thermally graduated machine perfusion prior to reperfusion. Am. J. Transplant. 13 (6), 1450-1460 (2013).
- Makowka, L., et al. Surgical technique of orthotopic liver transplantation. Gastroenterol. Clin. North. Am. 17 (1), 33-51 (1988).
- Hansen, T., et al. Histological examination and evaluation of donor bile ducts received during orthotopic liver transplantation–a morphological clue to ischemic-type biliary lesion?. Virchows Arch. 461 (1), 41-48 (2012).
- Monbaliu, D., Brassil, J. Machine perfusion of the liver: Past, present and future. Curr. Opin. Organ. Transplant. 15 (2), 160-166 (2010).
- Oldani, G., et al. Pre-retrieval reperfusion decreases cancer recurrence after rat ischemic liver graft transplantation. J. Hepatol. 61 (2), 278-285 (2014).
- Tromans, D. Temperature and pressure dependent solubility of oxygen in water: A thermodynamic analysis. Hydrometallurgy. 48 (3), 327-342 (1998).

