מוצקים שומנים חלקיקים (SLNs) אפליקציות לתאיות מיקוד
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
כלי רכב המבוסס על ננו-חלקיקי משלוח הראו הבטחה גדולה עבור יישומי מיקוד תאיים, מתן מנגנון לשנות איתות תאית וביטוי גנים ספציפי. ניתן לטעון כלי רכב אלה עם סמים, חלבונים, וחומצות גרעין נועדו להשפיע תגובות הסלולר ולהשיג אפקט רצוי ברקמות יעד. סוגים רבים של nanocarriers נחקרו לתועלת טיפולית ואבחון כוללים שומנים, פולימרים, סיליקון, וחומרים מגנטיים. מערכות אלו הן אטרקטיביות בשל הפוטנציאל שלהם למשלוח סמים מקומיים, גדל ריכוז טיפולי ברקמות יעד, והפחתה של רעילות מערכתית.
חלקיקים מוצקים שומנים (SLNs) הם דוגמא למדה היטב של מערכת מסירת ננו-חלקיקים שנוצר ככלי להעברת תרופות מבטיח בשנים האחרונות. SLNs אפשר לנסח בקלות ליישומים רבים, כולל 1 חישת ביו, קוסמטיקה 2, ולאמשלוח herapeutic 3-7. השירות שלהם נובע מהעובדה שהם מורכבים כולו משומני resorbable, רעילים, וכתוצאה מכך ההתאמה ביולוגית משופרת. במהלך סינתזה, ניתן לשלב תרופות lipophilic לכלי רכב בלוטת זקיף, ובכך להגדיל את מסיסות תרופה והתאמת לממשל parenteral. כלי רכב בלוטת זקיף גם לעזור לייצב תרופות כמוסות, הפחתת השפלה ואישורם, ולמקסם את הפעולה טיפולית. כלי רכב אלה הם גם מתאימים במיוחד למשחק ארוך, הכנות שחרור מבוקר בשל היציבות שלהם ב3,4,8,9 טמפרטורת גוף. חשוב לציין, אנקפסולציה של תרופות בחלקיקי שומנים משנה את פרופילי pharmacokinetic הפנימיים של מולקולות התרופה. זה מספק יתרון פוטנציאלי על ידי המאפשר שחרור המבוקר של תרופות עם מדד טיפולי צר. שיעור השחרור של תרופות-התאגד בלוטת זקיף יכול להיות מכוון המבוסס על קצב פירוק שומנים או שיעור דיפוזיה התרופה במטריצת שומנים.
SLNs לעתים קרובות מהונדס להצטבר ברקמות יעד ספציפיות. לדוגמא, בגודל שלהם (בדרך כלל יותר מ -10 ננומטר) מגביר שייר במחזור, שבו כלי הדם הדולפים של רקמת גידול מקל בתצהיר. בנוסף, המסלול של ממשל חלקיקים הוכח לשנות biodistribution עם הפוטנציאל למקד מבנים פיסיולוגיים ספציפיים כגון בלוטות לימפה 10,11. על התצהיר ברקמות יעד, השיג אינטראקציות הסלולר מתאימות והפנמה סופית של חלקיקים הוא מאתגר בשל היכולת של קרום תא לשלוט באופן סלקטיבי את הזרימה של יונים ומולקולות לתוך ומחוץ לתא 12. כדי להקל על ספיגה תאית, ניתן לשנות nanocarriers עם ligands הספציפי כוללים פפטידים, מולקולות קטנות, ונוגדנים חד-שבטיים 13,14. מספר מנגנונים כוללים שתי חדירה פסיבית ותחבורה פעילה של חלקיקיםעל פני קרום התא תוארו בעבר 3,12,15. באופן כללי, זה כבר הוכיח כי אינטראקציות תא-ננו-חלקיקים מושפעות ממאפייני physicochemical של חלקיקים כולל גודל, צורה, תשלום פני השטח וכימיה של פני השטח, בנוסף לפרמטרי תא ספציפי כגון סוג תא או שלב מחזור תא 12.
חקירה קודמת הדגימה את הסינתזה של תת-10 SLNs ננומטר עבור יישומי זיהוי אקטואליים 16 וסמן ביולוגי 1 בשיטת טמפרטורת היפוך השלב (PIT) 17. זוהי שיטת סינתזה עדינה שבו 2 הרכב נשאר קבוע בעוד הטמפרטורה משתנה בהדרגה. ערבוב רציף של הפתרון המחומם, כפי שהוא מתקרר לתוצאות RT בnanoemulsion. תוצאות תהליך זה בסינתזה של SLNs עם גודל חלקיקים קטן יותר 1 מזה שדווחו בעבר תוך שימוש בשיטות שונות לסינתזה של השומנים נאןoparticles 17-22. הגודל בקנה מידה וכתוצאה מכך, פחות מ -20 ננומטר, מספק יתרון עבור יישומי מיקוד תאיים בשל הגדלת שטח פנים ואת הפוטנציאל לאינטראקציות סלולריות משופרות.
סכמטי של SLNs, נועד לספק צבע ניאון או טיפולי, מוצג באיור 1. SLNs מורכב (למשל, האלקאן ליניארי) מאפשר שילוב של תרכובות lipophilic (למשל, צבעים או הרפוי) וחיצוני פעילי שטח פנים שומנים (פעילי שטח לדוגמא, ליניארי nonionic) מוקף במים. במחקר זה, SLNs היו עמוס בצבע ניאון ומשמש כמודל לחקור אינטראקציות חלקיקי תאים. fibroblasts העיקרי אדם עור ותאים דנדריטים עכבר נחשפו לצבוע טעונים בלוטת זקיף לאורך זמן כדי לאפיין אינטראקציות ביחס לרעילות וספיגת חלקיקים. Assay 3 רומיד -2,5-diphenylphenyltetrazolium (4,5-dimethylthiazol-2-י.ל.) (MTT) היה utilized כדי להקים רמות מינון מתאימות. מיקרוסקופ פלואורסצנטי וcytometry זרימה היו שתי שיטות מועסקות לבחון ספיגת חלקיקים במבחנה.
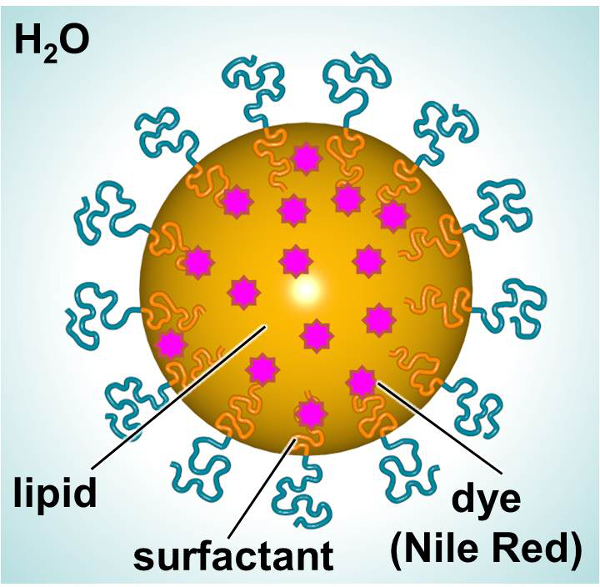
איור 1. סכמטי של בלוטת הזקיף מראה את המרכיבים העיקריים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
במחקר זה, הסינתזה של SLNs ותחולתם ליישומי מיקוד תאיים נחקרו. חלקיקים ביולוגית אלה הראו הבטחה ככלי רכב משלוח עבור יישומים רבים, כולל משלוח סמים, השתקת גנים, וטכנולוגיות חיסון 25-30. SLNs קטן במיוחד היו מסונתז באמצעות תהליך קליל, ויחסי הגומלין שלהם עם תאי עור עיקריים ותא…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
References
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

