Solid lipidenanodeeltjes (SLN) voor intracellulaire targeting Toepassingen
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
Nanodeeltjes gebaseerde bestelauto's hebben aangetoond grote belofte voor intracellulaire targeting toepassingen, een mechanisme om specifiek te veranderen cellulaire signalering en genexpressie. Deze voertuigen kunnen worden beladen met geneesmiddelen, eiwitten en nucleïnezuren ontworpen om cellulaire reacties effect en een gewenst effect in doelweefsels bereiken. Veel soorten nanocarriers zijn onderzocht voor therapeutische en diagnostische nut waaronder lipiden, polymeren, silicium en magnetische materialen. Deze systemen zijn aantrekkelijk vanwege hun potentieel voor lokale afgifte van geneesmiddelen, verhoogde de therapeutische concentratie in doelweefsels, en vermindering van systemische toxiciteit.
Vaste lipidenanodeeltjes (SLN) zijn een goed bestudeerde voorbeeld van een nanodeeltje afgiftesysteem dat is ontstaan als een veelbelovend geneesmiddel afgiftevehikel afgelopen jaren. SLN kunnen gemakkelijk worden geformuleerd voor meerdere toepassingen zoals biologische sensing 1, cosmetica 2 en therapeutic levering 3-7. Hun nut voort uit het feit dat zij volledig bestaan uit resorbeerbare, toxische lipiden, resulterend in verhoogde biocompatibiliteit. Tijdens synthese kunnen lipofiele geneesmiddelen in LIN.AFSCHR voertuigen worden ingebouwd, waardoor de oplosbaarheid en geschiktheid geneesmiddelen verhogen voor parenterale toediening. SLN voertuigen helpen ook om ingekapseld therapieën te stabiliseren, het verminderen van hun afbraak en klaring, en het maximaliseren van therapeutische werking. Deze voertuigen zijn bijzonder geschikt voor langwerkende, gereguleerde afgifte preparaten vanwege hun stabiliteit bij lichaamstemperatuur 3,4,8,9. Belangrijk inkapseling van geneesmiddelen in lipidenanodeeltjes verandert de intrinsieke farmacokinetische profielen van de geneesmiddelmoleculen. Dit levert een potentieel voordeel doordat de gecontroleerde afgifte van geneesmiddelen met een nauwe therapeutische index. De afgiftesnelheid van SLN opgenomen geneeswijze kan worden afgestemd op basis van de lipide afbraaksnelheid of het geneesmiddel diffusiesnelheid in delipide matrix.
SLN zijn vaak ontworpen om te accumuleren op bepaalde doelweefsels. Bijvoorbeeld, de grootte (typisch groter dan 10 nm) versterkt retentie in de bloedsomloop, waar lekkende vasculatuur tumorweefsel vergemakkelijkt depositie. Bovendien heeft de wijze van toediening deeltje bleek te veranderen biologische verdeling met de potentie om specifieke fysiologische structuren te richten zoals lymfeknopen 10,11. Bij afzetting in doelweefsels, de gepaste cellulaire interacties en eventuele internalisatie van nanodeeltjes uitdaging omdat het vermogen van celmembranen om selectief de stroom van ionen en moleculen in en uit de cel 12. Om cellulaire opname te vergemakkelijken, is het mogelijk nanocarriers specifieke liganden zoals peptiden, kleine moleculen en monoklonale antilichamen 13,14 wijzigen. Verscheidene mechanismen waaronder zowel passieve penetratie en actieve transport van nanodeeltjesover het celmembraan zijn eerder beschreven 3,12,15. In het algemeen is aangetoond dat cellen nanodeeltjes interacties worden beïnvloed door de fysisch-chemische eigenschappen van de nanodeeltjes zoals grootte, vorm, oppervlaktelading en oppervlaktechemie, naast celspecifieke parameters zoals celtype of celcyclusfase 12.
Een eerder onderzoek aangetoond dat de synthese van sub-10 nm SLN voor plaatselijk 16 en biomarker detectie toepassingen 1 met behulp van de methode 17 fase-inversie temperatuur (PIT). Dit is een zachte synthesemethode 2 waarbij de samenstelling blijft constant terwijl de temperatuur geleidelijk wordt gewijzigd. Continu roeren van de verwarmde oplossing bij afkoeling tot KT leidt tot een nano-emulsie. Dit leidt tot de synthese van SLN met kleinere deeltjesgrootte 1 dan eerder gerapporteerd met behulp van verschillende werkwijzen voor de synthese van lipiden nanoparticles 17-22. De resulterende maat schaal kleiner dan 20 nm, een voordeel voor intracellulaire targeting toepassingen vanwege grotere oppervlak en de mogelijkheid van verhoogde cellulaire interacties.
Een schema van SLN, die een fluorescerende kleurstof of therapeutisch te leveren, wordt in figuur 1. De SLN bestaan uit een lipide inrichting (bijvoorbeeld lineair alkaan) waardoor de opname van lipofiele stoffen (bijvoorbeeld kleurstoffen of therapeutica) en een oppervlakte exterior (bijvoorbeeld lineaire ionische surfactant), omgeven door water. In deze studie werden SLN beladen met een fluorescerende kleurstof en gebruikt als een model voor deeltjes-cel interacties te onderzoeken. Primaire menselijke dermale fibroblasten en muis dendritische cellen werden blootgesteld aan kleurstof-geladen SLN na verloop van tijd om interacties te karakteriseren met betrekking tot toxiciteit en deeltjes opname. A 3- (4,5-dimethyl-2-yl) -2,5-diphenylphenyltetrazolium bromide (MTT) bepaling werd utilized om de juiste dosering niveaus vast te stellen. Fluorescentie microscopie en flowcytometrie werden twee methoden toegepast om deeltjes opname in vitro onderzocht.
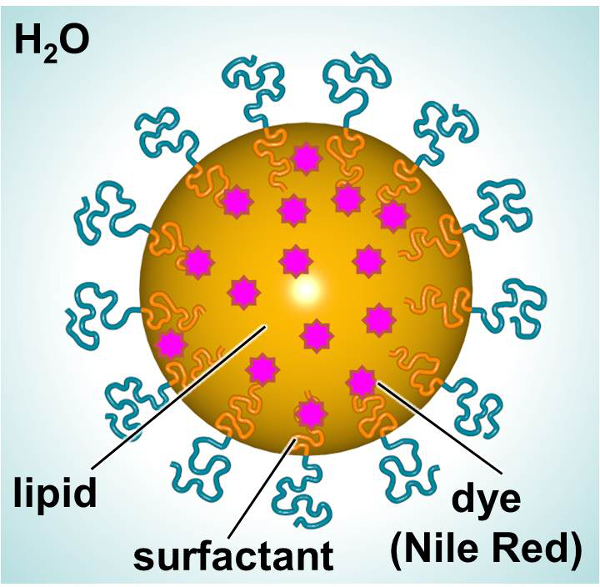
Figuur 1. Schematische voorstelling van SLN tonen de belangrijkste bestanddelen. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
In deze studie, de synthese van SLN en hun toepasbaarheid voor intracellulaire targeting aanvragen onderzocht. Deze biocompatibele nanodeeltjes hebben aangetoond belofte als levering voertuigen voor verschillende toepassingen, waaronder drug delivery, gene silencing, en vaccin technologieën 25-30. Ultraklein SLN werden gesynthetiseerd met behulp van een gemakkelijk proces en hun interacties met primaire huidcellen en primaire immune cellen werden onderzocht. SLN werden ontworpen om inkapseling van een fluore…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
References
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

