İnsan Subcortex yüksek çözünürlüklü yapısal Manyetik Rezonans Görüntüleme<I> İn Vivo</I> Ve Postmortem
Summary
Here we present a protocol to determine the minimum number images that needed to be registered and averaged to resolve subcortical structures and test whether the individual layers of the LGN could be resolved in the absence of physiological noise.
Abstract
Bu çalışmanın odak noktası, insan beynini canlı kıyasla postmortem beyin yapısal MRG çözünürlüğü sınırlarını test etmek oldu. In vivo yapısal MR çözünürlüğü sonuçta nabız, solunum ve baş hareketi de dahil olmak üzere fizyolojik gürültü ile sınırlıdır. Görüntüleme donanımı geliştirmeye devam etmekle birlikte, bu milimetre ölçeğinde yapıları çözmek için hala zor. Örneğin, lateral genikulat nükleus primer görsel duyu yolları sinaps (LGN), normalde altı içe geçmiş tek gözlü katmanlar halinde organize talamus görsel röle ve kontrol çekirdeği. Beyin görüntüleme çalışmaları güvenilir az 1 mm kalınlığında olan kendi küçük boyutu nedeniyle bu katmanları ayırt etmek mümkün olmamıştır.
Bir otopsi beyinde yapısal MR çözme limiti kullanarak birden çok görüntü bir uzun süreli (~ 24 saat) üzerinde ortalama test edildi. Amaç bireysel l çözmek mümkün olup olmadığını test etmek olduFizyolojik gürültü yokluğunda LGN ve ayers. Bir proton dansite (PD) 1 ağırlıklı darbe dizisi kayıtlı olması gereken görüntülerin asgari sayısını belirlemek için çözünürlük ve diğer parametreler değişen kullanılan ve güvenilir LGN ve diğer subkortikal bölgeler ayırt etmek ortalaması alındı. Sonuçlar ayrıca insan beyni canlı edinilen görüntüler karşılaştırıldı. In vivo konular klinik uygulamalarda yararlı subkortikal yapıları, ayırt etmek için gerekli PD taramaları minimum sayıda fizyolojik gürültü ek etkilerini belirlemek amacıyla tarandı.
Introduction
Bu araştırmanın amacı, fizyolojik gürültü yokluğunda yapısal MR çözünürlüğü sınırlarını test etmek oldu. Proton dansite (PD) ağırlıklı görüntüler kayıtlı olması gereken görüntülerin asgari sayısını belirlemek için bir uzun süreli (iki ~ 24 saat oturumları) üzerinden bir postmortem beyin edinilen ve subkortikal yapıları çözmek için ortalaması alınmıştır. Karşılaştırma için, PD ağırlıklı görüntüler de seans bir dizi üzerinden insanları yaşayan elde edilmiştir. Özellikle, amaç yaklaşık 1 mm kalınlığında (Şekil 1) insan LGN tüm altı ayrı katmanları, çözmek için en iyi senaryo mümkün olup olmayacağını anlamak için oldu.
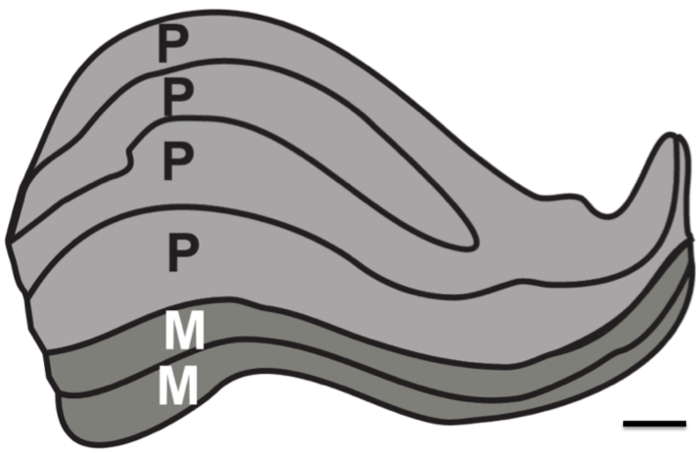
Şekil 1. İnsan lateral genikulat Nucleus katmanları. LGN laminer yapısının şematik. Magnoselüler (M) tabakaları daha büyük bir nöronal oluşmaktadır(koyu gri tasvir katmanlar 1-2) Hareket ve ders hatlarını çözmekle sorumludur hücre boyutu ve küçük hücre yoğunluğu. Parvoselüler tabakalar (P) (açık gri olarak tasvir tabakalar 4-6) ince formu ve renk giderme sorumlu olan küçük nöronal hücre boyutuna ve daha büyük hücre yoğunluğunda oluşmaktadır. Ölçek çubuğu 1 mm. Lekeli insan LGN 12 dayanan Şekil.
Matris boyutu arttığında MRI Mekansal çözünürlük artırıldı ve görüş alanı-(FOV) ve dilim kalınlığı azaldığı zaman. Ancak, artan çözünürlük voksel hacmi ile orantılıdır gürültü oranı (SNR), sinyali azaltmaktadır. SNR de ölçümlerin sayısının kare kökü ile orantılıdır. Birden fazla görüntü ayrı görüntüleme oturumları bir dizi üzerinden elde edilebilir, ancak yaşayan insanlarda, nihai çözünürlük gibi solunum, dolaşım pulsasyonu ve baş hareketi gibi, fizyolojik gürültü ile sınırlıdır.
Yüksek-resolution (0.35 mm düzlem vokseller) ağırlıklı taramalar elde edildi PD. PD taramaları talamus 1 gri ve beyaz kontrastı geliştirmek ve T 1 ve T 2 etkilerini en aza indirmek görüntüleri sonuçlanır. Bu görüntü, görüntü hacminin protein ve yağ olarak, su ve makro moleküllerin şeklinde proton yoğunluğuna bağlıdır. Nedeniyle mıknatıslanma 2 yüksek boyuna bileşeni için resmin üzerine parlak bir sinyalde bir doku sonuçlarında protonların sayısının artması.
Onlar doku çevreleyen subkortikal yapıların daha yüksek bir kontrast sağlar çünkü PD ağırlıklı taramalar toplanmıştır. Böyle T1 ve T2 ağırlıklı görüntülerde gibi diğer zıtlıklar, 1,3 ƒ belirlenen nedeniyle küçük kontrast-gürültü oranları LGN gibi subkortikal yapılar ortaya koymaya zorluk neden olur.
Aynı şekilde, daha önceki çalışmalarda formalin o PD ağırlıklı görüntüler otopsi beyin resulte sabit bulundugri ve beyaz madde arasındaki daha yüksek kontrast farklılıkları d T1 ve benzeri gri ve beyaz cevher görüntü yoğunluklarını 3,4 vardı T2 ağırlıklı görüntüler karşılaştırıldığında. Altta yatan biyofizik belirleyicileri bu farklılıkları açıklayabilir. Hidrojen protonların (boyuna) T1 ve T2 (enine) gevşeme süreleri doku içinde nasıl su hamle bağlıdır. Bu tür çapraz bağlama proteinleri, formalin çalışma gibi sabitleyiciler. Fiksatifler kullanıldığında su hareketlilik arasındaki farklar, farklı doku tiplerinin arasında azalır. Azaltılmış T1 doku kontrast, fiksasyon sonra görülmüştür iyi kontrast farklılaşma 3, 4 sağlayan tespit ile artan beyin dokularının içindeki protonların görece yoğunluğu farklılıkları, oysa.
Önceki çalışmalar 1.5 T 5,6,7 kullanarak PD ağırlıklı taramalar LGN tespit ve 3 T tarayıcı 8,9 de var. Bu tam kapsamını ana hatlarıyla muktedir bu taramaları elde etmek önemlidirLGN. Subkortikal çekirdekler tam kapsama korumak için, 18 PD ağırlıklı dilimler talamus içinde elde edildi. Her birim, iki çözünürlüğü 1024 matrisin yeniden örneklenmiş (0,15 mm düzlem voksel boyutu), Zincirleme, hareket düzeltilir ve subkortikal yapıların yüksek çözünürlüklü 3 boyutlu görüntü üretmek için ortalama edildi. Aşağıdaki dilim reçete için gerekli olan PD görüntülerin optimum sayıda yaşayan insanlar daha az 15 dakika tarama zamanı azaltarak, 5 oldu. Sadece 1 PD görüntüsü az 3 dakika tarama süresini azaltmak, açık bir şekilde ölüm sonrası beyinde subkortikal bölgeleri ayırmak için gerekli olan (Şekil 2 ve 3).
Bütün bir formalin ile fikse postmortem beyin numunesi 82 yıl yaşta kardiyopulmoner arrest ölmüştü bir kadının tarandı. Tıbbi kayıtların gözden ortaya o vardı: kronik obstrüktif akciğer hastalığı, anjin, üçlü bypass cerrahisi 8 yıl önce ölüm, rahim kanseri histerektomi ile tedavi7 yıl ölüm, hiperlipidemi, glokom, katarakt ve ameliyat öncesinde. Ölüm sonrası beyin numunesi aynı görüntüleme protokolü ile hem de görüntü kalitesi karşılaştırmaları için pek çok saat boyunca, diğer parametreler gibi taranmış, 4 ° C gibi ölüm sonrası beyin en az 3 hafta boyunca% 10 nötr tamponlu formalin içinde sabitlendi daldırma . Sadece optimize parametreler protokol için tarif edilecektir.
Protocol
Representative Results
Discussion
Bu çalışma subkortikal bölgelerin yüksek çözünürlüklü PD ağırlıklı görüntüler elde etmek için satın alma ve analiz tekniğinde optimize edilmiş bir protokol tanımlamaktadır. Tarama parametrelerinin bir dizi test edilmiş ve SNR artırmak ve satın almalar sayısını yüksek çözünürlüklü subkortikal yapıları belirlemek için güçlü olmak önemli bir adım azaltmak için matris boyutu, voksel boyutu ve bant genişliği ile ilgili en önemli olanları ile modifiye edilmiştir. Yaşayan ins…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge the following funding sources, the Natural Sciences and Engineering Research Council of Canada (NSERC), the Dorothy Pitts Research Fund (NG), and the Nicky and Thor Eaton Research Fund. The authors acknowledge Kevin DeSimone, and Aman Goyal and for their knowledge in MRI acquisition and analysis expertise.
Materials
| Magnetom Trio 3T MRI | Siemens (Erlangen, Germany). | ||
| Vacuum cushion hand | Siemens | Mat No: 4765454 | Manufactured by: Johannes-Stark-Stk. 8 D-92224 Amberg |
References
- Devlin, J. T., et al. Reliable identification of the auditory thalamus using multi-modal structural analyses. NeuroImage. 30 (4), 1112-1120 (2006).
- Fellner, F., et al. True proton density and T2-weighted turbo spin-echo sequences for routine MRI of the brain. Neuroradiology. 36 (8), 591-597 (1994).
- Schumann, C. M., Buonocore, M. H., Amaral, D. G. Magnetic resonance imaging of the post-mortem autistic brain. J Autism Dev Disord. 31 (6), 561-568 (2001).
- Tovi, M., Ericsson, A. Measurements of T1 and T2 over time in formalin-fixed human whole-brain specimens. Acta Radiol. 33 (5), 400-404 (1992).
- Fujita, N., et al. Lateral geniculate nucleus: anatomic and functional identification by use of MR imaging. Am J Neuroradiol. 22 (9), 1719-1726 (2001).
- Bridge, H., Thomas, O., Jbabdi, S., Cowey, A. Changes in connectivity after visual cortical brain damage underlie altered visual function. Brain. 131 (6), 1433-1444 (2008).
- Gupta, N., et al. Atrophy of the lateral geniculate nucleus in human glaucoma detected by magnetic resonance imaging. Br J Opthalmol. 93 (1), 56-60 (2009).
- Dai, H., et al. Assessment of lateral geniculate nucleus atrophy with 3T MR imaging and correlation with clinical stage of glaucoma. Am J Neuroradiol. 32 (7), 1347-1353 (2011).
- McKetton, L., Kelly, K. R., Schneider, K. A. Abnormal lateral geniculate nucleus and optic chiasm in human albinism. J Comp Neurol. 522 (11), 2680-2687 (2014).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Dietrich, O., Raya, J. G., Reeder, S. B., Reiser, M. F., Schoenberg, S. O. Measurement of signal-to-noise ratios in MR images: influence of multichannel coils, parallel imaging, and reconstruction filters. J Magn Reson Imaging. 26 (2), 375-385 (2007).
- Andrews, T. J., Halpern, S. D., Purves, D. Correlated size variations in human visual cortex, lateral geniculate nucleus, and optic tract. J Neurosci. 17 (8), 2859-2868 (1997).
- Pfefferbaum, A., Sullivan, E. V., Adalsteinsson, E., Garrick, T., Harper, C. Postmortem MR imaging of formalin-fixed human brain. NeuroImage. 21 (4), 1585-1595 (2004).

