Høj opløsning Strukturel Magnetic Resonance Imaging af Human subcortex<I> In vivo</I> Og Postmortem
Summary
Here we present a protocol to determine the minimum number images that needed to be registered and averaged to resolve subcortical structures and test whether the individual layers of the LGN could be resolved in the absence of physiological noise.
Abstract
Fokus for denne undersøgelse var at afprøve grænserne for strukturelle MR-scanning af en post mortem hjerne opløsning i forhold til levende menneskelige hjerne. Løsningen af strukturel MRI in vivo i sidste ende begrænset af fysiologisk støj, herunder pulsering, åndedræt og hoved bevægelse. Selvom billedbehandling hardware fortsætter med at forbedre, er det stadig vanskeligt at løse strukturer på millimeter skala. For eksempel vil den primære visuelle sensoriske pathways synapse ved den laterale geniculate nucleus (LGN), en visuel relæ og kontrol kernen i thalamus, der normalt er organiseret i seks indflettede monokulære lag. Neuroimaging undersøgelser har ikke været i stand til pålideligt at skelne disse lag på grund af deres lille størrelse, der er mindre end 1 mm.
Opløsningsevnen grænse for strukturel MRI, i en post mortem hjerne blev testet ved hjælp af flere billeder i gennemsnit over en lang varighed (~ 24 timer). Formålet var at teste, om det var muligt at løse enkelte lAyers af LGN i mangel af fysiologiske støj. En proton densitet (PD) 1 vægtet puls sekvens blev anvendt med varierende opløsning og andre parametre til at bestemme det mindste antal billeder, der er nødvendige for at blive registreret og gennemsnit til pålideligt skelne LGN og andre subcorticale regioner. Resultaterne blev også sammenlignet med billeder optaget i levende menneskelige hjerne. In vivo forsøgspersoner blev scannet for at bestemme de yderligere virkninger af fysiologisk støj på det minimale antal PD scanninger er nødvendige for at skelne subkortikale strukturer, der er nyttige i kliniske anvendelser.
Introduction
Formålet med denne forskning var at teste grænserne for strukturelle MR opløsning i fravær af fysiologiske støj. Proton densitet (PD) vægtede billeder blev erhvervet i et post mortem hjerne over en lang periode (to ~ 24 timers sessioner) for at bestemme det mindste antal billeder, der er nødvendige for at blive registreret og gennemsnittet til at løse de subkortikale strukturer. Til sammenligning blev PD vægtede billeder også erhvervet i levende mennesker over flere sessioner. Især målet var at undersøge, om det ville være muligt i en bedste fald at løse alle seks individuelle lag af den menneskelige LGN, som er ca. 1 mm tyk (figur 1).
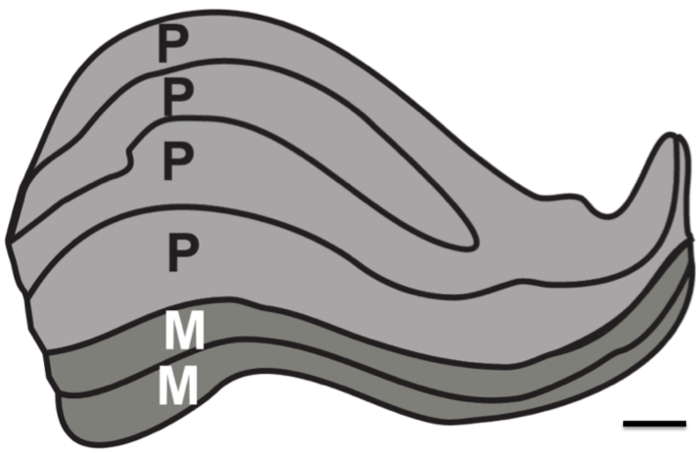
Figur 1. Humant Lateral geniculate Nucleus lag. Skematisk af laminar struktur LGN. Magnocellulære (M) lag består af større neuronalcellestørrelse og mindre celledensitet, der er ansvarlige for at løse motion og kursus konturer (lag 1-2, afbildet som mørkegrå). Parvocellulære lag (P) er sammensat af mindre neuronal cellestørrelse og større celledensitet, der er ansvarlige for at løse fine-formen og farve (lag 4-6, afbildet som lysegrå). Målestok 1 mm. Tal baseret på farvede menneske LGN 12.
Rumlig opløsning ved MRI forbedres, når matrixen størrelse øges, og når field-of-view (FOV) og snittykkelse er faldet. Men forøget opløsning nedsætter signal-støjforholdet (SNR), som er proportional med den voxel volumen til. SNR er også proportional med kvadratroden af antallet af målinger. I levende mennesker, selvom flere billeder kan erhverves over en række separate billeddiagnostiske sessioner, er den ultimative løsning begrænset af fysiologisk støj, såsom respiration, kredsløbssygdomme pulseringer og hoved bevægelse.
Høj-Opløsning (0,35 mm i-plane voxels) PD vægtede scanninger blev erhvervet. PD scanninger forbedre grå og hvid kontrast i thalamus 1, og resultere i billeder, der minimerer T 1 og T 2 effekter. Sit image er afhængig af massefylden af protoner i form af vand og makromolekyler, såsom proteiner og fedt i den billeddannende mængde. Det øgede antal af protoner i et væv resulterer i en lysere signal på billedet på grund af den højere langsgående element i magnetisering 2.
PD-vægtede scanninger blev indsamlet, da de giver en højere kontrast af subkortikale strukturer med omgivende væv. Andre kontraster, såsom T1- og T2-vægtede billeder medfører vanskeligheder i afgrænse subkortikale strukturer som LGN grund mindre kontrast-støj-forhold, som bestemt ƒ 1,3.
Ligeledes fandt tidligere undersøgelser, at PD-vægtede billeder af formalin faste hjerner post mortem resulted i højere forskelle kontrast mellem grå og hvid substans i forhold til T1 og T2-vægtede billeder, der havde lignende grå og hvid substans billedstyrker 3,4. De underliggende biofysiske determinanter kan forklare disse forskelle. T1 (langsgående) og T2 (tværgående) afslapning tider af brint protoner afhænge af, hvor vandet bevæger sig i vævet. Fikseringsmidler såsom formalin arbejde ved tværbindende proteiner. Reduceres forskellene mellem vand mobilitet mellem forskellige vævstyper, når der anvendes fikseringsmidler. Reduceret T1 væv kontrast er blevet observeret efter fiksering, mens forskellene i den relative tæthed af protoner i hjernevæv steg med fiksering, hvilket giver bedre kontrast differentiering 3, 4.
Tidligere undersøgelser har identificeret LGN i PD-vægtede scanninger ved hjælp af en 1,5 T 5,6,7, og ved 3 T-scanner 8,9. Det er afgørende at opnå disse scanninger for at være i stand til præcist skitsere omfanget afLGN. For at opretholde fuld dækning af de subkortikale kerner blev 18 PD-vægtede skiver opnået i thalamus. Hvert bind blev re-samplet til det dobbelte af resolution 1024 matrix (0,15 mm-planet voxel størrelse), sammenkædet, bevægelse rettet og gennemsnit til at producere en høj opløsning 3D billede af subcorticale strukturer. Det optimale antal PD billeder for følgende skive recept var 5, hvilket reducerer scanningstiden til mindre end 15 min i levende mennesker. Kun 1 PD billedet var forpligtet til klart afgrænse subkortikale regioner i postmortem hjernen, hvilket reducerer scanningstiden til mindre end 3 min (figur 2 og 3).
En hel formalin-fikseret postmortem hjerne prøve blev scannet fra en kvinde, der var død af hjertestop i en alder 82 år. Gennemgang af journaler viste, at hun havde: kronisk obstruktiv lungesygdom, angina, tredobbelt bypass-operation 8 år forud for dødsfaldet, livmoderkræft behandlet med hysterektomi7 år før døden, hyperlipidæmi, glaukom og katarakt kirurgi. Postmortem hjernen prøve blev i 10% neutral pufret formalin immersionsfikseret i mindst 3 uger ved 4 ° c.The postmortem hjerne blev scannet med samme billedoptagningsprotokol samt med andre parametre i løbet af mange timer for sammenligninger billedkvalitet . Kun de optimerede parametre vil blive beskrevet for protokollen.
Protocol
Representative Results
Discussion
Denne undersøgelse beskriver en optimeret protokol erhvervelse og analyseteknik med henblik på at opnå høj opløsning PD-vægtede billeder af subcorticale regioner. En række scanningsparametre blev testet og modificeret med de væsentligste dem vedrørende matrix størrelse, voxelstørrelsen og båndbredde til at øge SNR og formindske antallet af erhvervelser, et kritisk trin i at kunne bestemme høj opløsning subkortikale strukturer. I forbindelse med at finde den optimale parametre inden for levende mennesker, …
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge the following funding sources, the Natural Sciences and Engineering Research Council of Canada (NSERC), the Dorothy Pitts Research Fund (NG), and the Nicky and Thor Eaton Research Fund. The authors acknowledge Kevin DeSimone, and Aman Goyal and for their knowledge in MRI acquisition and analysis expertise.
Materials
| Magnetom Trio 3T MRI | Siemens (Erlangen, Germany). | ||
| Vacuum cushion hand | Siemens | Mat No: 4765454 | Manufactured by: Johannes-Stark-Stk. 8 D-92224 Amberg |
References
- Devlin, J. T., et al. Reliable identification of the auditory thalamus using multi-modal structural analyses. NeuroImage. 30 (4), 1112-1120 (2006).
- Fellner, F., et al. True proton density and T2-weighted turbo spin-echo sequences for routine MRI of the brain. Neuroradiology. 36 (8), 591-597 (1994).
- Schumann, C. M., Buonocore, M. H., Amaral, D. G. Magnetic resonance imaging of the post-mortem autistic brain. J Autism Dev Disord. 31 (6), 561-568 (2001).
- Tovi, M., Ericsson, A. Measurements of T1 and T2 over time in formalin-fixed human whole-brain specimens. Acta Radiol. 33 (5), 400-404 (1992).
- Fujita, N., et al. Lateral geniculate nucleus: anatomic and functional identification by use of MR imaging. Am J Neuroradiol. 22 (9), 1719-1726 (2001).
- Bridge, H., Thomas, O., Jbabdi, S., Cowey, A. Changes in connectivity after visual cortical brain damage underlie altered visual function. Brain. 131 (6), 1433-1444 (2008).
- Gupta, N., et al. Atrophy of the lateral geniculate nucleus in human glaucoma detected by magnetic resonance imaging. Br J Opthalmol. 93 (1), 56-60 (2009).
- Dai, H., et al. Assessment of lateral geniculate nucleus atrophy with 3T MR imaging and correlation with clinical stage of glaucoma. Am J Neuroradiol. 32 (7), 1347-1353 (2011).
- McKetton, L., Kelly, K. R., Schneider, K. A. Abnormal lateral geniculate nucleus and optic chiasm in human albinism. J Comp Neurol. 522 (11), 2680-2687 (2014).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Dietrich, O., Raya, J. G., Reeder, S. B., Reiser, M. F., Schoenberg, S. O. Measurement of signal-to-noise ratios in MR images: influence of multichannel coils, parallel imaging, and reconstruction filters. J Magn Reson Imaging. 26 (2), 375-385 (2007).
- Andrews, T. J., Halpern, S. D., Purves, D. Correlated size variations in human visual cortex, lateral geniculate nucleus, and optic tract. J Neurosci. 17 (8), 2859-2868 (1997).
- Pfefferbaum, A., Sullivan, E. V., Adalsteinsson, E., Garrick, T., Harper, C. Postmortem MR imaging of formalin-fixed human brain. NeuroImage. 21 (4), 1585-1595 (2004).

