Høyoppløselig Structural Magnetic Resonance Imaging of Human subcortex<I> I Vivo</I> Og Post mortem
Summary
Here we present a protocol to determine the minimum number images that needed to be registered and averaged to resolve subcortical structures and test whether the individual layers of the LGN could be resolved in the absence of physiological noise.
Abstract
Fokus for denne studien var å teste oppløsning grensene for strukturell MR av en postmortem hjerne i forhold til levende menneskelige hjerne. Oppløsningen på strukturell MRI in vivo er slutt begrenset av fysiologiske støy, inkludert pulse, respirasjon og hodebevegelser. Selv om bilde maskinvare fortsetter å øke, er det fortsatt vanskelig å løse strukturer på millimeterskala. For eksempel, den primære visuelle sensoriske baner synapse i lateral geniculate nucleus (LGN), en visuell kontroll relé og kjernen i thalamus som normalt er organisert i seks innfelte monokulære lag. Bildediagnostiske undersøkelser har ikke vært i stand til å pålitelig skille disse lagene på grunn av sin lille størrelse som er mindre enn 1 mm tykk.
Den løse grensen for strukturell MR, i en postmortem hjernen ble testet ved hjelp av flere bilder i gjennomsnitt over en lang varighet (~ 24 h). Hensikten var å teste om det var mulig å løse den enkelte lAyers av LGN i fravær av fysiologiske støy. En protontetthet (PD) en vektet pulssekvens ble anvendt med varierende oppløsning og andre parametere for å bestemme minimum antall bilder som er nødvendige for å bli registrert og i gjennomsnitt for pålitelig å skille LGN og andre subkortikale regioner. Resultatene ble også sammenlignet med bilder ervervet i levende menneskelige hjerne. In vivo forsøkspersonene ble skannet for å bestemme de ekstra effekten av fysiologiske støy på minimum antall PD-skanninger for å skille subkortikale strukturer, nyttige i kliniske applikasjoner.
Introduction
Formålet med denne undersøkelsen var å teste for oppløsning grensene for strukturell MRI i fravær av fysiologisk støy. Proton tetthet (PD) vektede bilder ble kjøpt i en postmortem hjernen over en lang varighet (to ~ 24-timers økter) å bestemme minimum antall bilder som trengs for å bli registrert og i gjennomsnitt for å løse de subkortikale strukturer. Til sammenligning ble PD vektede bilder også kjøpt i levende mennesker over flere økter. Spesielt var målet å finne ut om det vil være mulig i et best-case scenario for å løse alle de seks individuelle lag av den menneskelige LGN, som er ca 1 mm tykk (figur 1).
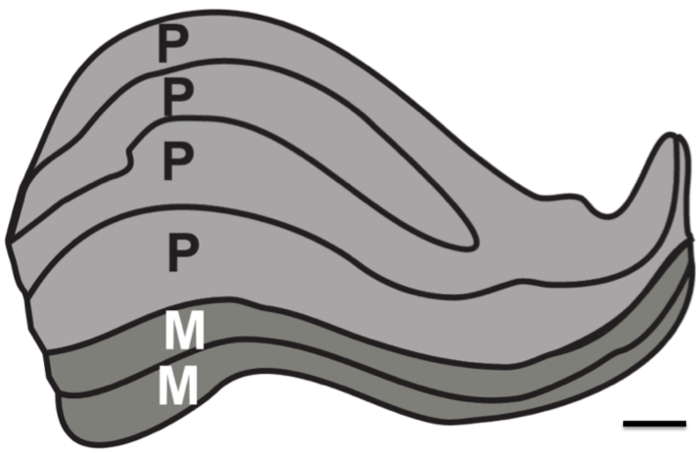
Figur 1. Humant Lateral geniculate kjernen lag. Skjematisk av den laminære strukturen i LGN. Magnocellular (M) lag består av større neuronalcellestørrelse og mindre celletetthet som er ansvarlig for å løse bevegelses og kurs skisserer (lag 1-2, avbildet som mørk grå). Parvocellular lag (P) utgjøres av mindre neuronal cellestørrelse og større celletetthet som er ansvarlig for å løse fin-form og farge (lag 4-6, avbildet som lysegrå). Målestokk 1 mm. Figur basert på farget menneskelig LGN 12.
Romlig oppløsning i MR er forbedret når matrisestørrelse er økt, og når felt-of view (FOV) og skive tykkelse er redusert. Imidlertid økt oppløsning reduserer signal-til-støy-forhold (SNR), som er proporsjonal med volumelement volum. SNR er også proporsjonal med kvadratroten av antall målinger. I levende mennesker, selv om flere bilder kan bli kjøpt over en rekke separate bilde økter, er den ultimate oppløsningen begrenset av fysiologiske støy, slik som respirasjon, sirkulasjonspulseringer og hodebevegelser.
Høy-Oppløsning (0,35 mm i-planet voxel) PD vektede skanninger ble kjøpt. PD skanner forbedre grå og hvit kontrast i thalamus en, og resultere i bilder som minimerer T 1 og T 2 effekter. Dens bilde er avhengig av tettheten av protoner i form av vann og makromolekyler slik som proteiner og fett i avbildningsvolum. Det økte antall protoner i et vev resulterer i en sterkere signal om bildet på grunn av den høyere langsgående komponent av magnetisering 2.
PD-vektet MR ble samlet siden de gir en høyere kontrast av subkortikale strukturer med omkringliggende vev. Andre kontraster, for eksempel T1 og T2-vektede bilder føre til vanskeligheter med å kartlegge subkortikale strukturer som LGN grunnet mindre kontrast-til-støy-forhold, som bestemmes ƒ 1,3.
På samme måte tidligere studier fant at PD-vektet bilder av formalin fast post mortem hjerner resulted i høyere kontrast forskjeller mellom grå og hvit substans i forhold til T1 og T2-vektede bilder som hadde lignende grå og hvit materie bilde intensiteter 3,4. De underliggende biofysiske determinants kan forklare disse forskjellene. T1 (langsgående) og T2 (tverrgående) relaksasjonstider av hydrogen protoner avhenge av hvor vannet beveger seg i vevet. Fiksativ slik som formalin arbeid av kryssbindingsproteiner. Forskjellene mellom vann mobilitet er redusert mellom ulike vevstyper når fiksativ brukes. Redusert T1 vev kontrast har blitt observert etter fiksering, mens forskjellene i den relative tettheten av protoner i hjernevev økte med fiksering, noe som gir bedre kontrast differensiering 3, 4.
Tidligere studier har identifisert LGN i PD-vektet skanner ved hjelp av en 1,5 T 5,6,7, og på tre T scanner 8,9. Det er kritisk for å oppnå samme formål å være i stand til nøyaktig å skissere den utstrekningLGN. For å opprettholde full dekning av de subkortikale kjerner ble 18 PD-vektet snitt oppnådd i thalamus. Hvert volum ble re-samplet til dobbelt så høy oppløsning 1024 matrise, (0,15 mm in-plane voxel størrelse), sammensatt, bevegelse korrigert og i gjennomsnitt å produsere en høyoppløselig 3D-bilde av subkortikale strukturer. Det optimale antall PD-bildene som kreves for følgende skive resepten var fem, noe som reduserer søketiden til mindre enn 15 min i levende mennesker. Bare en PD bilde var nødvendig for å avgrense tydelig subkortikale regioner i postmortem hjernen, redusere søketiden til mindre enn 3 min (figur 2 og 3).
En hel formalinfiksert postmortem hjernen prøven ble skannet fra en kvinne som hadde dødd av hjertestans i en alder av 82 år. Gjennomgang av journaler viste at hun hadde: kronisk obstruktiv lungesykdom, angina, trippel bypass operasjon 8 år før dødsfallet, livmorkreft behandles med hysterektomi7 år før dødsfallet, hyperlipidemi, glaukom og katarakt kirurgi. Den post mortem hjerne Prøven ble nedsenking-fiksert i 10% nøytral bufret formalin i minst 3 uker ved 4 ° C. Den post mortem hjerne ble skannet med den samme avbildningsprotokoll, så vel som med andre parametre i løpet av mange timer for sammenligninger med bildekvaliteten . Bare de optimaliserte parametere vil bli beskrevet for protokollen.
Protocol
Representative Results
Discussion
Denne studien beskriver en optimalisert protokoll i innsamling og analyse teknikk for å oppnå høy oppløsning PD vektede bilder av subkortikale regioner. Et antall skanningsparametere ble testet og modifisert med de vesentligste knyttet til matrisestørrelse, voxel størrelse, og båndbredde for å øke SNR og redusere antall kjøp, er viktig for å være i stand til å bestemme høy oppløsning subkortikale strukturer. I forbindelse med å finne de optimale parametrene innen levende mennesker, denne forskningen test…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge the following funding sources, the Natural Sciences and Engineering Research Council of Canada (NSERC), the Dorothy Pitts Research Fund (NG), and the Nicky and Thor Eaton Research Fund. The authors acknowledge Kevin DeSimone, and Aman Goyal and for their knowledge in MRI acquisition and analysis expertise.
Materials
| Magnetom Trio 3T MRI | Siemens (Erlangen, Germany). | ||
| Vacuum cushion hand | Siemens | Mat No: 4765454 | Manufactured by: Johannes-Stark-Stk. 8 D-92224 Amberg |
References
- Devlin, J. T., et al. Reliable identification of the auditory thalamus using multi-modal structural analyses. NeuroImage. 30 (4), 1112-1120 (2006).
- Fellner, F., et al. True proton density and T2-weighted turbo spin-echo sequences for routine MRI of the brain. Neuroradiology. 36 (8), 591-597 (1994).
- Schumann, C. M., Buonocore, M. H., Amaral, D. G. Magnetic resonance imaging of the post-mortem autistic brain. J Autism Dev Disord. 31 (6), 561-568 (2001).
- Tovi, M., Ericsson, A. Measurements of T1 and T2 over time in formalin-fixed human whole-brain specimens. Acta Radiol. 33 (5), 400-404 (1992).
- Fujita, N., et al. Lateral geniculate nucleus: anatomic and functional identification by use of MR imaging. Am J Neuroradiol. 22 (9), 1719-1726 (2001).
- Bridge, H., Thomas, O., Jbabdi, S., Cowey, A. Changes in connectivity after visual cortical brain damage underlie altered visual function. Brain. 131 (6), 1433-1444 (2008).
- Gupta, N., et al. Atrophy of the lateral geniculate nucleus in human glaucoma detected by magnetic resonance imaging. Br J Opthalmol. 93 (1), 56-60 (2009).
- Dai, H., et al. Assessment of lateral geniculate nucleus atrophy with 3T MR imaging and correlation with clinical stage of glaucoma. Am J Neuroradiol. 32 (7), 1347-1353 (2011).
- McKetton, L., Kelly, K. R., Schneider, K. A. Abnormal lateral geniculate nucleus and optic chiasm in human albinism. J Comp Neurol. 522 (11), 2680-2687 (2014).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Dietrich, O., Raya, J. G., Reeder, S. B., Reiser, M. F., Schoenberg, S. O. Measurement of signal-to-noise ratios in MR images: influence of multichannel coils, parallel imaging, and reconstruction filters. J Magn Reson Imaging. 26 (2), 375-385 (2007).
- Andrews, T. J., Halpern, S. D., Purves, D. Correlated size variations in human visual cortex, lateral geniculate nucleus, and optic tract. J Neurosci. 17 (8), 2859-2868 (1997).
- Pfefferbaum, A., Sullivan, E. V., Adalsteinsson, E., Garrick, T., Harper, C. Postmortem MR imaging of formalin-fixed human brain. NeuroImage. 21 (4), 1585-1595 (2004).

