Disolución dinámica de polarización nuclear Instrumentación para el tiempo real enzimática reacción de la tasa mediciones realizadas por RMN
Summary
The sensitivity enhancement provided by dissolution dynamic nuclear polarization (DNP) enables following metabolic processes in real time by NMR and MRI. The characteristics and performances of a dedicated dissolution DNP setup designed for study enzymatic reactions are discussed.
Abstract
La principal limitación de las investigaciones basados en RMN es baja sensibilidad. Esto incita para largos tiempos de adquisición, evitando así que las mediciones de RMN en tiempo real de las transformaciones metabólicas. Hiperpolarización mediante la disolución DNP elude parte de la sensibilidad emite gracias a la gran magnetización nuclear fuera de equilibrio resultante de la transferencia de espín polarización de electrones al núcleo. La señal de RMN de alta obtenida puede ser utilizada para controlar las reacciones químicas en tiempo real. La desventaja de hiperpolarizado NMR reside en la ventana de tiempo limitado disponible para la adquisición de señales, que es generalmente del orden de la constante de tiempo de relajación longitudinal de espín nuclear, T 1, o, en casos favorables, en el orden de la constante de tiempo de relajación asociado con el singlete de estado de los núcleos acoplados, T LLS. La captación celular de moléculas endógenas y las tasas metabólicas puede proporcionar información esencial sobre el desarrollo tumoral y la respuesta al fármaco. Nurosos estudios de RMN hiperpolarizados anteriores han demostrado la relevancia de piruvato como sustrato metabólico para monitorizar la actividad enzimática in vivo. Este trabajo proporciona una descripción detallada de la configuración experimental y métodos necesarios para el estudio de las reacciones enzimáticas, en particular, la tasa de conversión de piruvato a lactato en presencia de lactato deshidrogenasa (LDH), por RMN hiperpolarizado.
Introduction
La polarización nuclear dinámica (DNP), 1,2 una técnica diseñada para mejorar la polarización de espín nuclear, es decir, el desequilibrio entre "arriba" y las poblaciones de espín "abajo" (P = [N ↑ – N ↓] / [N + N ↑ ↓]), fue presentado por primera vez en la década de 1950. Espines nucleares tales como 13 C pueden ser polarizados hasta P = 10 -1 en condiciones favorables, típicamente a una temperatura del orden de 1 K y en un campo magnético de 3,357 T. 3,4 Un gran avance para aplicaciones biológicas se produjo en el principios de los años 2000 con el desarrollo de disolución DNP que consiste en la disolución de muestras polarizado congelado en agua sobrecalentada, manteniendo el alto nivel de polarización nuclear obtenido a baja temperatura. 5 la señal de RMN en estado líquido es mejorada por un factor de 10 3 -10 4 en comparación con comúntérmicamente polarizado condiciones RT RMN. Por lo tanto Disolución DNP proporciona una manera de medir bioquímica velocidades de reacción no invasiva in situ en tiempo real, lo que permite la dinámica de seguimiento por RMN con una resolución temporal de 1 seg o menos 6 -. 10 También se hizo posible detectar analitos en concentraciones muy bajas 11.
Entre las modalidades de formación de imágenes moleculares no invasivas, hiperpolarizado RMN es la única técnica que permite medir simultáneamente un sustrato y sus productos metabólicos, en tiempo real. DNP disolución fue recibido con entusiasmo en diversas áreas científicas que van desde in vitro RMN de MRI clínica 12 y las aplicaciones más prometedoras están relacionados con la supervisión in situ del metabolismo. 13,14 La principal limitación de la disolución DNP es que, después de un tiempo de del orden de cinco veces el tiempo de relajación longitudinal T constante 1, la mejora polarzación se pierde. Por tanto, es necesario el uso de moléculas que llevan espines nucleares exhiben relativamente larga T 1. Para prolongar el tiempo útil de la mejora de la polarización, lentamente-relajante estados de espín nuclear, conocidos como estados de larga vida (LLS), puede ser usado 15 -. 17 LLS son insensibles a la intra-par interacción dipolo-dipolo, por lo que su tiempo de relajación característico constante, T LLS, puede ser mucho más largo que T1. 18 Toda una vida magnetización de decenas de minutos y por lo tanto hasta 1 hora se pudo obtener, 19,20 y se han propuesto LLS tanto para la espectroscopia de resonancia magnética (MRS) y la RM. 21
Los principales puntos que deben ser cuidadosamente optimizado para el estudio de las tasas de reacción enzimática por hiperpolarizado RMN son las siguientes: (i) maximizar la polarización en estado sólido y (ii) reducir al mínimo la pérdida de polarización durante la transferencia de la solución de la hiperpolarizadopolarizador al espectrómetro de RMN. En este artículo se describe la adaptación de un aparato y un sistema de inyección de DNP disolución a medida para estudiar las reacciones enzimáticas. Las características y el rendimiento de la instalación se demostrará con el sustrato hiperpolarizado bien conocido y ampliamente utilizado [1- 13 C] piruvato. Las principales razones de esta elección son, en primer lugar, su forma natural a largo 13C tiempo de relajación longitudinal (T1> 50 seg a campos magnéticos elevados y temperaturas superiores a 293 K), que permite reacciones de seguimiento durante varios minutos, y, en segundo lugar, su papel central en cáncer de metabolismo. 13,14 Utilizando la disolución DNP RMN y un sistema de inyección desarrollada a medida, la oxidación de piruvato catalizada por la lactato deshidrogenasa (LDH) se puede controlar en presencia de un grupo inicial de lactato sin marcar 9,22 o sin lactato no marcado añadido , como se muestra aquí. Se ha demostrado que la señal de lactato [1- 13 C] mide en vivo (incluyendo en las células) después de la inyección de piruvato hiperpolarizado [1- 13 C] se debe principalmente a un cambio de etiqueta rápida entre piruvato y lactato en lugar de a la producción de lactato. 6
Nosotros presentamos en este documento la producción en tiempo real de lactato [1- 13 C] a partir de piruvato hiperpolarizado [1- 13 C] se inyecta en un tubo de RMN que contiene LDH pero inicialmente no lactato.
Descripción del sistema
Hay dos partes principales en una configuración de disolución DNP (Figura 1): El polarizador DNP y el espectrómetro de RMN. El elemento principal del polarizador DNP es un criostato para el enfriamiento de la muestra a alrededor de 1 K en un baño de helio bombeado. El criostato se inserta en un imán superconductor 3,35 T y tiene una geometría que garantiza la entrega de la muestra de polarización en el isocentro del imán (Figura 1). En el interior del criostato, la muestra (a) está rodeado por una bobina RMN (b), para medir la polarización buildup, contenida en una cavidad de microondas overmoded (c). Toda la muestra se mantiene a baja temperatura en un baño de helio bombeado (d) y se irradió con microondas a través de la guía de ondas. Todo el sistema está gestionado por un software hecho a medida (Figura 2D).
El hardware y el equipo criogénico necesario para realizar el DNP y la posterior disolución siguen siendo un reto tecnológico. Un nuevo criostato DNP 23,24 fue desarrollado y probado para determinar sus actuaciones y criogénicos y optimizado para su rápido enfriamiento, helio atraco tiempo y el consumo total de helio mínima durante la operación.
El criostato consta de dos partes. La primera parte del criostato es el dewar de aislamiento (Figura 2A) que se puede separar más o menos en la parte superior la parte (a) de la cola, o el espacio de muestra (b), y la cámara de vacío exterior (OVC) mantienen a alto vacío y el alojamiento del pantallas de radiación (c). La segunda parte del criostato es el principalsert (Figura 2B), colocado en el dewar de aislamiento, en donde se controlan todos los reglamentos de flujo. El helio líquido procedente del dewar de almacenamiento externo a través de la línea de transferencia (a), se encuentra en la primera fase condensada en el separador (b), una cámara intermedia utiliza tanto para mantener la parte superior de la criostato frío y para eliminar el helio se evaporó durante la transferencia. La presión del separador es bajado por bombeo a través de un capilar (c) envuelto alrededor de la parte superior de la criostato; el flujo de helio frío en este capilar se utiliza para enfriar los deflectores (d) y las pantallas de radiación en el dewar de aislamiento (OVC). La muestra se coloca y polarizada en el espacio de muestra. El espacio de muestra está conectado al separador a través de otro capilar (e), envuelto alrededor de la cola del inserto principal criostato. Este capilar puede ser abierta o cerrada a través de una válvula de aguja accionada manualmente desde el exterior.
Para lograr la baja temperatura utilizada durante el pr DNPoceso, helio líquido debe ser recogido en el espacio muestral criostato y su presión baja a la gama mbar. Las operaciones necesarias para la operación del criostato se realizan a través de un sistema de bombeo más bien compleja con tres conjuntos de bombas, supervisados y operados en diferentes puntos con los instrumentos electrónicos y electromecánicos (Figura 2C). La OVC criostato necesita ser bombeado a alto vacío por el primer sistema de bombeo. Este sistema se compone de una bomba turbo molecular respaldada por una bomba rotatoria (a). El helio líquido se transfiere desde el dewar de almacenamiento (b) a través de la línea de transferencia de criostato de entrada al separador de criostato. El separador tiene una salida conectada al segundo conjunto de bombeo. Este conjunto se compone de una bomba de membrana / h 35 m 3 (c). Esta línea permite eliminar el gas de helio hervida durante el traslado desde el Dewar y durante el enfriamiento separador. El helio líquido recogido en el separador puede ser transferido al espacio de muestra a través de la tapaIllary tubos descritos anteriormente. Para transferir helio líquido desde el separador al espacio de la muestra y, posteriormente, a la menor presión de espacio de muestra a mbar gama, un tercer sistema de bombeo compuesto por una de 250 m 3 / hr Raíces bomba de respaldo de un hr bomba de 65 m3 / rotatorio (d) está conectado al criostato a través de una válvula de mariposa manual (e).
Todas las operaciones del sistema de vacío son controlados y regulados por un producto a medida electroneumática (f). Este dispositivo controla las conexiones de línea de vacío entre el separador de criostato (g) y el espacio de muestra (h) puntos de venta, el segundo sistemas de bombeo / terceros (c, d), una botella de helio comprimido (i) y el exterior. La comunicación entre (f) y el exterior pasa a través de una válvula de una vía (j). El dispositivo electro-neumático (f), así como todos los parámetros del sistema y el hardware de disolución son controlados y operados por un dispositivo USB interfaz electrónica a la medida con un PC común. Finalmente todo el sistema, a través de la electrónicadispositivo, es administrado por software independiente o hechos a medida (Figura 2D), donde se ponen en marcha las operaciones relevantes a través de una interfaz de software utilizando los botones.
Para gestionar la muestra y medir la señal de RMN acumulación en el estado sólido se utilizan una serie de inserciones (Figura 3A). Para preparar el criostato para la polarización, colocar el inserto muestra principal (a), en el criostato. El inserto muestra principal está provisto de una bobina de RMN (b) colocado dentro de una cavidad de microondas chapado en oro overmoded. Pre-congelación de la solución que contiene substrato a ser polarizada (solución de polarización) a temperatura de nitrógeno líquido en un recipiente de muestra adecuada y colocarlo en la parte inferior final del soporte de la muestra de fibra de vidrio (c). Deslice el soporte de la muestra en el inserto muestra principal para alcanzar el isocentro del imán. Inserte la guía de ondas chapado en oro (d) en el soporte de la muestra. La guía de ondas permite que el horno de microondas generada a partir de una fuente externa de microondas para viajar con pérdidas mínimas to la muestra.
El software hecho a medida para la gestión de criostato maneja de forma automática, al hacer clic en el botón correspondiente interfaz, diferentes operaciones como tiempo de reutilización (la temperatura del criostato se baja cercana a la temperatura del helio líquido), relleno (el criostato está lleno de helio líquido a un nivel predeterminado ), una etapa adicional de enfriamiento a T ≈ 1 K (el baño de helio líquido se bombea a alcanzar la temperatura más baja posible), presurización (el criostato se presuriza ligeramente por encima de la presión ambiente a P = 10 a 30 mbar para permitir la apertura criostato sin riesgos de contaminación del criostato por el aire) y disolución (procedimiento automático para disolver la muestra DNP y pasar la solución resultante a la hiperpolarizado lugar de medición, es decir, el espectrómetro de NMR).
La polarización se lleva a cabo la irradiación de la muestra con microondas a 94 GHz (en un campo de polarización B 0 </sub> = 3,35 T). Una muestra se considera completamente polarizada después de 3 T DNP, donde T es el tiempo de DNP acumulación de polarización. T DNP es del mismo orden de magnitud que el tiempo de relajación longitudinal de los núcleos de destino en estado sólido en el campo y temperatura dada. En todos nuestros experimentos la muestra se polarizó durante más de 5 T DNP.
Al final del tiempo de polarización, la muestra tiene que ser disuelto en una solución a TA con el fin de ser utilizado para la medición de la actividad enzimática. Durante el proceso de disolución, 5 ml de sobrecalentado D 2 O de la caldera de la inserción de la disolución (Figura 3B) son empujadas por el gas de helio comprimido (P = 6-8 bar) para llegar a la muestra mejorada-DNP y disolverla. La solución resultante hiperpolarizado es empujado fuera del inserto de disolución por el gas de helio comprimido, a través de la salida de disolución de inserción (Figura 3C-b </strong>), un tubo de transferencia de teflón diámetro interno 2 mm. El tiempo necesario para el proceso de disolución es de 300 mseg. 23 El tiempo necesario para la transferencia de muestra desde el polarizador DNP al sitio espectrómetro de RMN es de aproximadamente 3 seg.
El proceso de disolución se realiza utilizando un inserto de disolución (Figura 3B). El inserto de la disolución se compone de un conjunto electrónico-neumático (a), un palo de fibra de carbono (b) que contiene tubos de conexión entre la caldera en el conjunto neumático y el armario recipiente de la muestra (c), que permite el acoplamiento a prueba de fugas con la muestra contenedor, y de vuelta a la salida. El conjunto de electro-neumático (Figura 3C) se utiliza para producir y conducir sobrecalentado D 2 O a través de la palanca de fibra de carbono para el recipiente de muestra y, a continuación para extraer la solución hiperpolarizado del criostato. El conjunto de electro-neumático se compone de válvulas neumáticas (A) que controlan las conexiones entre el cohelio mpressed (P = 6-8 bar) línea (b), la caldera (c) en el que el D 2 O se inyecta a través de la válvula (d), y la salida (e) a través de la barra de fibra de carbono (f). El sistema se completa con un G presión, un termómetro y un hilo resistivo de calentamiento en la caldera (c), un gatillo (h) y una caja de conexión (i) que se utiliza para interconectar el sistema con el dispositivo de gestión electrónica.
El criostato DNP y el espectrómetro de RMN están conectados por una línea de transferencia, es decir, un tubo de PTFE de 2 mm de diámetro interior dentro de la cual la solución hiperpolarizado es empujado por helio a presión (P = 6-8 bar) cuando se activa la disolución.
La secuencia disolución se compone de las siguientes operaciones: en los primeros 300 mseg, sobrecalentado D 2 O es empujado al recipiente de la muestra con el fin de fundir y disolver la solución congelada hiperpolarizado. Después, la solución hiperpolarizado se extrae del criostato por medio de pressurized (P = 6-8 bar) de gas helio y empujado a través del tubo de PTFE diámetro interno 2 mm (Figura 3C-e) a la zona de medición, donde la inyección se lleva a cabo con cualquiera de los procedimientos descritos en la etapa 6.2.1 o Paso 6.2 0.2.
El segundo componente de la disolución de configuración DNP NMR es el espectrómetro de RMN. En la configuración que se describe en este documento, el espectrómetro de RMN funciona a un campo B0 = 11,7 Tesla. Una sonda de RMN 5 mm se utiliza para medir la señal hiperpolarizado después de la disolución. El espectrómetro de RMN es operado a través de la consola de RMN, que se utiliza para las mediciones de RMN, tanto de estado sólido y el líquido por el estado, y la firma de software XWINNMR-proporcionada. Una medición típica se compone de un pulso duro de bajo ángulo de flip (ya sea calibrado, para liquidstate o no calibrado, para las mediciones de estado sólido), seguido de adquisiciones de señal.
Las mediciones de la polarización de la señal térmica de estado sólido y derivadas SI-DNPgnal acumulación se realizó a través de la bobina a medida 13 C en el sitio del polarizador DNP (Figura 3AB) acoplado al espectrómetro de RMN. En esta situación particular, el espectrómetro de RMN no realiza de bloqueo de señal. Cuando las mediciones de estado sólido se llevan a cabo, para evitar perturbaciones significativas a la polarización, el retardo de tiempo entre las adquisiciones debe ser lo suficientemente largo, más o menos largo que 0,5 T DNP.
La mejora en estado sólido se define como 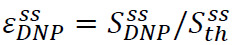 dónde
dónde ![]() es la señal hiperpolarizado (obtenido en el Paso 3.3) y
es la señal hiperpolarizado (obtenido en el Paso 3.3) y ![]() es la señal de estado sólido (obtenido en el equilibrio térmico a la temperatura del helio líquido bombeado en el paso 3.2) (Figura 4A). Este parámetro drecisa la polarización máxima disponible para los experimentos de RMN, antes de pérdidas inevitables durante la transferencia de la solución hiperpolarizado. La medición se realiza con una simple secuencia de pulsos-adquieren mediante un impulso de ángulo bajo flip no calibrado. calibración de pulso se omite comúnmente para mediciones Solidstate.
es la señal de estado sólido (obtenido en el equilibrio térmico a la temperatura del helio líquido bombeado en el paso 3.2) (Figura 4A). Este parámetro drecisa la polarización máxima disponible para los experimentos de RMN, antes de pérdidas inevitables durante la transferencia de la solución hiperpolarizado. La medición se realiza con una simple secuencia de pulsos-adquieren mediante un impulso de ángulo bajo flip no calibrado. calibración de pulso se omite comúnmente para mediciones Solidstate.
Un procedimiento análogo se puede utilizar para determinar la mejora de la señal hiperpolarizado en el estado líquido. En este caso, la muestra se coloca en el tubo del espectrómetro antes de la inyección (paso 6.2) se compone de 500 l de D 2 O. Después de la disolución e inyección, hay dos parámetros importantes para vigilar. El primero es la mejora hiperpolarizado en el sitio de espectrómetro de RMN, 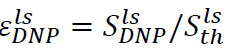 (Figura 4B), donde
(Figura 4B), donde ![]() es la señal justo después de la inyección de la hiper solución polarizada (obtenido en el paso 7.1) y
es la señal justo después de la inyección de la hiper solución polarizada (obtenido en el paso 7.1) y ![]() es la señal de polarización térmica (obtenido en la Etapa 7.2). El segundo es el tiempo de relajación longitudinal, T 1 (Figura 4B, recuadro), asociado con el sustrato y cada producto metabólico (obtenido por medio de señales de ajuste exponencial obtenido en la etapa 7.1). Estos dos parámetros definen la concentración mínima sustrato necesario para obtener una relación suficiente de señal a ruido (SNR) y la ventana de tiempo disponible para la medición de las transformaciones metabólicas. La relación entre la polarización de estado sólido
es la señal de polarización térmica (obtenido en la Etapa 7.2). El segundo es el tiempo de relajación longitudinal, T 1 (Figura 4B, recuadro), asociado con el sustrato y cada producto metabólico (obtenido por medio de señales de ajuste exponencial obtenido en la etapa 7.1). Estos dos parámetros definen la concentración mínima sustrato necesario para obtener una relación suficiente de señal a ruido (SNR) y la ventana de tiempo disponible para la medición de las transformaciones metabólicas. La relación entre la polarización de estado sólido ![]() y la polarización liquidstate
y la polarización liquidstate ![]() da una estimación de las pérdidas de polarización debido a la relajación durante la transferencia solución hiperpolarizado. Un valoration12 "src =" / files / ftp_upload / 53548 / 53548equation12.jpg "width =" 80 "/> debe ser observado en ausencia de pérdidas por relajación.
da una estimación de las pérdidas de polarización debido a la relajación durante la transferencia solución hiperpolarizado. Un valoration12 "src =" / files / ftp_upload / 53548 / 53548equation12.jpg "width =" 80 "/> debe ser observado en ausencia de pérdidas por relajación.
Protocol
Representative Results
Discussion
Los puntos críticos de la disolución experimento DNP RMN son: (i) el nivel de polarización conseguido por el sustrato, que determina la concentración de producto más baja necesaria para los experimentos, así como el número de adquisiciones de señal que se pueden realizar y (ii) los tiempos de vida de magnetización, en comparación con la duración de la transferencia entre la polarización y los sitios de detección y de la tasa de transformación de sustrato. El sistema de inyección de la configuración de DN…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores agradecen al Dr. JJ van der Klink para la asistencia en la elección y el montaje de los equipos, así como el Dr. F. Kateb y el Dr. G. Bertho útil para los debates. CA fue apoyado por la Fundación Nacional de Ciencia de Suiza (subvención PPOOP2_157547). Reconocemos la financiación de Paris Sorbonne Cité (RMN @ Com, DIM Analytics, Ville de París, la Fundación de la Investigación Médica (FRM ING20130526708), y el Parteneriat Hubert Curien Brancusi 32662QK. Nuestro equipo es parte de los programas Equipex Paris-en-RESONANCIA y CACSICE.
Materials
| DNP polarizer | Vanderklink s.a.r.l (Switzerland) | /// | Cryostat and electronic equipment for sample polarization |
| Vacuum system components | Edwards vacuum (France) | Various |
– turbomolecular pumping setup – membrane pumping setup – high capacity roots pumping system – vacuum fittings and components |
| DNP 3.35T Magnet | Bruker (France) | ||
| 500MHz NMR Spectrometer | Bruker (France) | ||
| Origin 8.0 | OriginLab (US) | Data analysis software | |
| Chemicals | |||
| SODIUM PYRUVATE-1-13C, 99 ATOM % 13C | Sigma Aldrich (France) | 490709 | |
| ETHANOL-D6, ANHYDROUS, 99.5 ATOM % D | Sigma Aldrich (France) | 186414 | |
| 4-Hydroxy-TEMPO 97% | Sigma Aldrich (France) | 176141 | |
| Deuterium oxide | Sigma Aldrich (France) | 151882 | |
| reduced nicotinamide adenine dinucleotide (NADH) | Sigma Aldrich (France) | ||
| ethylene-diaminetetraacetic acid (EDTA) | Sigma Aldrich (France) | ||
| dithiothreitol (DTT) | Sigma Aldrich (France) | ||
| phosphate buffer, pH = 7.0 | Sigma Aldrich (France) | ||
| LDH enzyme in | Sigma Aldrich (France) | L-2500 | |
| bovine serum albumin, BSA | Sigma Aldrich (France) |
References
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Abragam, A., Goldman, M. Principles of dynamic nuclear polarisation. Rep. Prog. Phys. 41 (3), 395 (1978).
- Wolber, J., Ellner, F., et al. Generating highly polarized nuclear spins in solution using dynamic nuclear polarization. Nuc. Inst. Met. Phys. Res. Sec. A. 526 (1-2), 173-181 (2004).
- Cheng, T., Capozzi, A., Takado, Y., Balzan, R., Comment, A. Over 35% liquid-state 13C polarization obtained via dissolution dynamic nuclear polarization at 7 T and 1 K using ubiquitous nitroxyl radicals. PCCP. 15 (48), 20819-20822 (2013).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. PNAS. 100 (18), 10158-10163 (2003).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Keshari, K. R., Wilson, D. M., et al. Hyperpolarized [2-13C]-Fructose: A Hemiketal DNP Substrate for In Vivo Metabolic Imaging. JACS. 131 (48), 17591-17596 (2009).
- Zeng, H., Lee, Y., Hilty, C. Quantitative Rate Determination by Dynamic Nuclear Polarization Enhanced NMR of a Diels−Alder Reaction. An. Chem. 82 (21), 8897-8902 (2010).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13C NMR. NMR in Biom. 25 (11), 1286-1294 (2012).
- Allouche-Arnon, H., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. In vitro visualization of betaine aldehyde synthesis and oxidation using hyperpolarized magnetic resonance spectroscopy. Chem. Comm. 49 (63), 7076-7078 (2013).
- Lerche, M. H., Meier, S., et al. Quantitative dynamic nuclear polarization-NMR on blood plasma for assays of drug metabolism. NMR in Biom. 24 (1), 96-103 (2011).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Trans. Med. 5 (198), 198ra108 (2013).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of Cancer Metabolism by Imaging Hyperpolarized Nuclei: Prospects for Translation to Clinical Research. Neoplasia. 13 (2), 81-97 (2011).
- Comment, A., Merritt, M. E. Hyperpolarized Magnetic Resonance as a Sensitive Detector of Metabolic Function. Biochem. 53 (47), 7333-7357 (2014).
- Carravetta, M., Johannessen, O. G., Levitt, M. H. Beyond the T-1 limit: Singlet nuclear spin states in low magnetic fields. PRL. 92 (15), 153003 (2004).
- Carravetta, M., Levitt, M. H. Theory of long-lived nuclear spin states in solution nuclear magnetic resonance. I. Singlet states in low magnetic field. J. Chem. Phys. 122 (21), 214505 (2005).
- Vasos, P. R., Comment, A., et al. Long-lived states to sustain hyperpolarized magnetization. PNAS. 106 (44), 18469-18473 (2009).
- Claytor, K., Theis, T., Feng, Y., Warren, W. Measuring long-lived 13C2 state lifetimes at natural abundance. JMR. 239, 81-86 (2014).
- Pileio, G., Carravetta, M., Hughes, E., Levitt, M. H. The long-lived nuclear singlet state of N-15-nitrous oxide in solution. JACS. 130 (38), 12582-12583 (2008).
- Stevanato, G., Hill-Cousins, J. T., et al. A Nuclear Singlet Lifetime of More than One Hour in Room-Temperature Solution. Ange. Chem. Int. Ed. 54 (12), 3740-3743 (2015).
- Ghosh, R. K., Kadlecek, S. J., et al. Measurements of the Persistent Singlet State of N(2)O in Blood and Other Solvents-Potential as a Magnetic Tracer. MRM. 66 (4), 1177-1180 (2011).
- Harris, T., Eliyahu, G., Frydman, L., Degani, H. Kinetics of hyperpolarized 13C1-pyruvate transport and metabolism in living human breast cancer cells. PNAS. 106 (43), 18131-18136 (2009).
- Comment, A., van den Brandt, B., et al. Design and performance of a DNP prepolarizer coupled to a rodent MRI scanner. Conc. Mag. Res. B. 31 (4), 255-269 (2007).
- Balzan, R. . Methods for Molecular Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy using Hyperpolarized Nuclei. 5966, 1-140 (2013).
- Bornet, A., Melzi, R., et al. Boosting Dissolution Dynamic Nuclear Polarization by Cross Polarization. JPC Letters. 4 (1), 111-114 (2013).
- Bowen, S., Hilty, C. Rapid sample injection for hyperpolarized NMR spectroscopy. PCCP. 12 (22), 5766-5770 (2010).
- Cavadini, S., Vasos, P. R. Singlet states open the way to longer time-scales in the measurement of diffusion by NMR spectroscopy. Conc. Mag. Res. A. 32 (1), 68-78 (2008).
- Ahuja, P., Sarkar, R., Vasos, P. R., Bodenhausen, G. Long-lived States in Multiple-Spin Systems. Chem. Phys. Chem. 10 (13), 2217-2220 (2009).
- Ahuja, P., Sarkar, R., Jannin, S., Vasos, P. R., Bodenhausen, G. Proton hyperpolarisation preserved in long-lived states. Chem. Comm. 46 (43), 8192-8194 (2010).
- Sarkar, R., Comment, A., et al. Proton NMR of 15N-Choline Metabolites Enhanced by Dynamic Nuclear Polarization. JACS. 131 (44), 16014-16015 (2009).

