Bruke Saccadometry med dyp hjernestimulering for å studere normal og patologisk hjernefunksjon
Summary
This paper describes the use of quantitative measurement of eye movements in conjunction with stimulation of focal areas of the deep brain in order to study physiology, pathophysiology, and the mechanisms of deep brain stimulation.
Abstract
The oculomotor system involves a large number of brain areas including parts of the basal ganglia, and various neurodegenerative diseases including Parkinson’s and Huntington’s can disrupt it. People with Parkinson’s disease, for example, tend to have increased saccadic latencies. Consequently, the quantitative measurement of saccadic eye movements has received considerable attention as a potential biomarker for neurodegenerative conditions. A lot more can be learned about the brain in both health and disease by observing what happens to eye movements when the function of specific brain areas is perturbed. Deep brain stimulation is a surgical intervention used for the management of a range of neurological conditions including Parkinson’s disease, in which stimulating electrodes are placed in specific brain areas including several sites in the basal ganglia. Eye movement measurements can then be made with the stimulator systems both off and on and the results compared. With suitable experimental design, this approach can be used to study the pathophysiology of the disease being treated, the mechanism by which DBS exerts it beneficial effects, and even aspects of normal neurophysiology.
Introduction
I de senere årene har det vært økende interesse for bruk av målinger av reaksjonstider som en kvantitativ og ikke-invasiv måte å få informasjon om det høye nivået mekanismene for nevral beslutnings en. En type av reaksjonstiden som har blitt studert i stor utstrekning er den tid det tar å sette i gang en saccade mot fremvisning av en visuell stimulus, kjent som rykningsamplituden ventetid. Rykninger er de raske øyebevegelser som oppstår når vi raskt skifte blikket fra ett sted til et annet. De er den vanligste typen av øyebevegelser vi gjøre, som forekommer ved en frekvens på vanligvis to eller tre per sekund. Hver saccade er i realiteten en beslutning om å se på en kø i den visuelle verden i stedet for en annen to.
Nervebaner som styrer øyebevegelser har blitt studert og er ganske godt dokumentert tre. Ved hjelp av følsomt elektronisk utstyr, kan aspekter av oculomotor funksjon være nøyaktig og objectively kvantifisert. Dette letter detaljert studie av øyebevegelser i seg selv, men også gjør det mulig for dem å bli brukt som et verktøy for å undersøke andre områder av nevrofysiologi og patofysiologi.
Øyebevegelser måling kan gi nyttig informasjon om sykdomstilstander. Rykke øyebevegelser har nylig, for eksempel, fikk mye oppmerksomhet som potensielle biomarkører i nevrodegenerative lidelser, inkludert Huntingtons 4,5 og Parkinsons sykdom 6,7, og det er godt etablert at rykke reaksjonstider pleier å være tregere enn normalt i disse forholdene. Potensielle anvendelser av rykningsamplituden målingen inkluderer hjelpemidler til diagnose og sykdom sporing. Rykke oppgaver spenner fra det enkle prosaccade (ser så raskt som mulig mot en plutselig vises visuell stimulans til venstre eller høyre) til mer komplekse oppgaver som antisaccade (ser så raskt som mulig til motsatt side til en visuell stimulans) eller minne- guidet saccade (sermot husket plasseringen av et mål som ikke lenger er der).
Dyp hjernestimulering er en effektiv behandling for mange nevrologiske tilstander. Det er mest vanlig å behandle de motoriske symptomer på Parkinsons sykdom inkludert tremor, rigiditet, bradykinesi, og dyskinesi. Det er også brukt for andre bevegelsesforstyrrelser inkludert dystoni og essensiell tremor, og mindre vanlig for nevropatisk smerte, epilepsi og psykiatriske tilstander som tvangslidelser. Det er den eneste innstillingen som forskerne har direkte elektrisk tilgang til dype strukturene i den menneskelige hjerne in vivo, og tilbyr dermed en verdifull mulighet for eksperimentell nevrologi. En rekke mål er stimulert, avhengig av tilstanden som behandles, inkludert flere steder i de basale ganglier, hvorav mange er involvert i oculomotor veier. Dette betyr at en lang rekke undersøkelser kan gjennomføres ved bruk av DBS-systemet for å levere stimuleringtil en gitt hjerne beliggenhet og en eye tracking-enhet for å registrere og analysere dens effekter. Avhengig av den eksperimentelle paradigmet, kan slike undersøkelser gi informasjon om fysiologien av regionen som blir stimulert, effektene av sykdommen eller den mekanismen som DBS arbeider i det aktuelle miljø. Denne artikkelen beskriver en generell tilnærming til rykningsamplituden øyebevegelser testing i dyp hjernestimulering pasienter.
Flere forskjellige typer eye tracking utstyr er tilgjengelig. For forskningen er beskrevet i denne protokollen en bærbar saccadometer ble brukt til å ta opp horisontale rykke øyebevegelser. Bærbare saccadometers har fordelen av ikke å kreve hodestøtten (se figur 1), noe som betyr at økter er mer behagelig for pasienter med Parkinsons sykdom, spesielt for dem som lider med alvorlig dyskinesi. Den saccadometer brukt her er lett og ca 5 cm bred og 10 cm høy. Den saccadometer måleres øyebevegelser ved bruk av direkte infrarød okulografi: en infrarød kilde og sensor plassert foran den mediale canthus bruk lys som reflekteres fra hornhinnen for å etablere dreiestilling av øyeeplet ved millisekunders intervaller. For å skaffe gode data for analyse saccadometer bør prøve med en hastighet på minst 1 kHz med minst 12 bits oppløsning. I saccadometer anvendt her de visuelle stimuli var tre røde 13 cd m -2 flekker av lys som produseres av bygget i laveffektslasere, hver flekk strakte enkelte 0,1 grader, med en base i midtlinjen og de to andre på ± 10 grader (dvs. , til høyre og venstre).
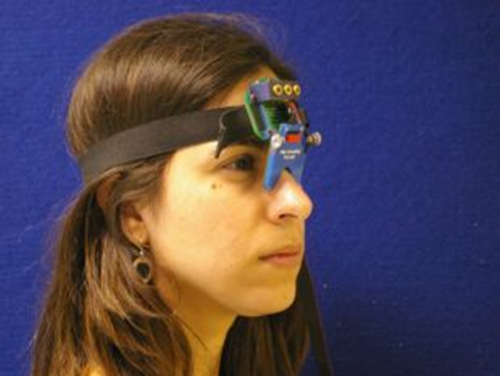
Figur 1. Saccadometer. Hodet montert saccadometer festet til en strikk og hviler på neseryggen. Fire miniatyr lasere prosjektet visuelle måls på en matt overflate, og deltakerens øyebevegelser er målt ved differensial infrarøde refleksjon transdusere på nese siden av hvert øye. Som laser mål flytte med hodet, hodestøtter er ikke nødvendig. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Den mest kritiske faktoren i å skaffe god kvalitet rykningsamplituden data er å sikre at instruksene til deltakeren er klare og presise. For eksempel, hvis instruksjonene for antisaccadic oppgave er ikke helt klart, er deltakeren sannsynlig å utføre prosaccades stedet. Opptak kan også være bortskjemt hvis deltakeren ikke kan tydelig se stimuli eller saccadometer kan ikke nøyaktig måle øye posisjon. Således hvis dataene ser ut til å være av lav kvalitet eksperimentator bør sjekke at lys fra omgivelsene ikke …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dr. Antoniades was supported by the National Institute of Health Research (NIHR) and by the Dementias and Neurodegenerative Diseases Research Network (DENDRON) and by the Wellcome Trust. Dr FitzGerald was supported by the National Institute for Health Research (NIHR) Oxford Biomedical Research Centre.
Materials
| Saccadometer device ( Ober Consulting Poland) |
| Computer with Windows environment |
| Software, Latency Meter for downloading the raw data from the saccadometer. |
References
- Leigh, R. J., & Kennard, C. Using saccades as a research tool in the clinical neurosciences. Brain. 127, 460-477 (2004).
- Carpenter, R. H. The neural control of looking. Curr Biol. 10, R291-293 (2000).
- Leigh, R. J., & Zee, D. S. The Neurology of Eye Movements. New York: Oxford University Press, (2006).
- Antoniades, C. A., Xu, Z., Mason, S. L., Carpenter, R. H., & Barker, R. A. Huntington's disease: changes in saccades and hand-tapping over 3 years. Journal of Neurology. 257, 1890-1898 (2010).
- Blekher, T.M., Yee, RD., Kirkwood, SC., Hake, AM., Stout, JC., Weaver, MR., Foroud, TM. Oculomotor control in asymptomatic and recently diagnosed individuals with the genetic marker for Huntington's disease. in Vision Research. Vol. 44 2729-2736 (2004).
- Chan, F., Armstrong, I. T., Pari, G., Riopelle, R. J., & Munoz, D. P. Deficits in saccadic eye-movement control in Parkinson's disease. Neuropsychologia. 43, 784-796 (2005).
- Antoniades, C. A., Demeyere, N., Kennard, C., Humphreys, G. W., & Hu, M. T. Antisaccades and executive dysfunction in early drug-naive Parkinson's disease: The discovery study. Mov Disord. (2015).
- Antoniades, C. et al. An internationally standardised antisaccade protocol. Vision Res. 84, 1-5 (2013).
- Ober, J. K. et al. Hand-Held system for ambulatory measurement of saccadic durations of neurological patients. . In: Modelling and Measurement in Medicine. (2003).
- Temperli, P. et al. How do parkinsonian signs return after discontinuation of subthalamic DBS? Neurology. 60, 78-81 (2003).
- Antoniades, C. A. et al. Deep brain stimulation: eye movements reveal anomalous effects of electrode placement and stimulation. PLoS ONE. 7, e32830 (2012).
- Yugeta, A. et al. Effects of STN stimulation on the initiation and inhibition of saccade in Parkinson disease. Neurology. 74, 743-748 (2010).
- Terao, Y., Fukuda, H., Ugawa, Y., & Hikosaka, O. New perspectives on the pathophysiology of Parkinson's disease as assessed by saccade performance: a clinical review. Clin Neurophysiol. 124, 1491-1506 (2013).
- Temel, Y., Visser-Vandewalle, V., & Carpenter, R. H. Saccadic latency during electrical stimulation of the human subthalamic nucleus. Curr Biol. 18, R412-414 (2008).
- Antoniades, C. A. et al. Deep brain stimulation abolishes slowing of reactions to unlikely stimuli. J Neurosci. 34, 10844-10852 1065-14.2014(2014).
- Rivaud-Pechoux, S. et al. Improvement of memory guided saccades in parkinsonian patients by high frequency subthalamic nucleus stimulation. J Neurol Neurosurg Psychiatry. 68, 381-384 (2000).
- Takikawa, Y., Kawagoe, R., Itoh, H., Nakahara, H., & Hikosaka, O. Modulation of saccadic eye movements by predicted reward outcome. Experimental brain research. Experimentelle Hirnforschung. 142, 284-291 (2002).
- Dorris, M. C., & Munoz, D. P. A neural correlate for the gap effect on saccadic reaction times in monkey. Journal of Neurophysiology. 73, 2558-2562, (1995).
- Hanes, D. P., & Schall, J. D. Countermanding saccades in macaque. Visual Neuroscience. 12, 929-937, (1995).
- Opris, I., Barborica, A., & Ferrera, V. P. On the gap effect for saccades evoked by electrical microstimulation of frontal eye fields in monkeys. Experimental brain research. Experimentelle Hirnforschung. 138, 1-7 (2001).
- Takagi, M., Frohman, E. M., & Zee, D. S. Gap-overlap effects on latencies of saccades, vergence and combined vergence-saccades in humans. Vision Res. 35, 3373-3388 (1995).
- Schall, J. D. Neuronal activity related to visually guided saccades in the frontal eye fields of rhesus monkeys: comparison with supplementary eye fields. Journal of Neurophysiology. 66, 559-579 (1991).
- Pare, M., & Hanes, D. P. Controlled movement processing: superior colliculus activity associated with countermanded saccades. J Neurosci. 23, 6480-6489 (2003).

