הכנה וניתוח של<em> במבחנה</em> שלושה שד ממדי המחליפים קרצינומה
Summary
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Abstract
תלת ממד תרבות (3D) היא שיטה רלוונטית יותר מבחינה פיזיולוגיה מודל התנהגות תאי במבחנה משני תרבות ממדים. קרצינומות, כולל קרצינומות השד, הן רקמות 3D מורכבים מורכב מתאי אפיתל סרטן ורכיבים סטרומה, כולל fibroblasts ו תאי מטריקס (ECM). עם זאת, רוב במבחנת מודלים של סרטן שד פולשני מורכבים רק תאי אפיתל סרטן, השמטת stroma, ולכן ארכיטקטורת 3D של גידול in vivo. המודלים של קרצינומה 3D מתאימים חשובים הבנה מדויקת של ביולוגית גידול, התנהגות, ואת תגובה לטיפול. עם זאת, משך תרבות ונפח של מודלי 3D הוא מוגבל על ידי הזמינות של חמצן וחומרים מזינים בתוך התרבות. בזאת, אנחנו מדגימים שיטה שבה שד קרצינומה תאי אפיתל פיברובלסטים סטרומה ישולבו ECM כדי ליצור פונדקאי סרטן שד 3D הכולל stroma ויכול להיות מתורבתת כמומבנה 3D מוצק או באמצעות מערכת bioreactor זלוף לספק חמצן וחומרים מזינים. בעקבות התקנת תקופת צמיחה ראשונית, פונדקאיים יכול לשמש לבדיקות סמים פרה-קליניות. לחלופין, המרכיבים הסלולר מטריצה של פונדקאי יכולים להיות שונים כדי לענות על מגוון של שאלות ביולוגיות. לאחר בתרבות, פונדקאיות הם קבועים ומעובדים כדי פרפין, באופן דומה את הטיפול דגימות קרצינומה שד קלינית, להערכת הפרמטרים של עניין. ההערכה של פרמטר אחד כזה, את הצפיפות של תאים הנמצאים, מוסבר, שבו מערכות תוכנה ניתוח התמונה ImageJ ו CellProfiler מוחלים photomicrographs סעיפים היסטולוגית של פונדקאיות לכמת את מספר התאים בעלי הגרעין ליחידת שטח. זה יכול לשמש כאינדיקטור של שינוי מספר תאים לאורך זמן או שינוי מספר התא וכתוצאה מתנאים וטיפולים צמיחה שונים.
Introduction
תלת ממד (3D) מודלי תרבות שיותר במדויק לחקות את אדריכלות גידול microenvironment in vivo חשובים מחקרים שמטרתם לנתח את יחסי הגומלין המורכבים בין תאי microenvironment שלהם כדי לבחון את היעילות של טיפולים מועמדים. חמצן גידול משפיע ממדי והדרגות מזינות, אחידות חשיפה לסמים, זרימת לחץ / דם ביניים, ו 3D אדריכלות 1-4. הנוכחות של המיקרו-סביבת סטרומה המתאימה תורמת השפעות ממדיות גידול איתות תא ECM ואיתות paracrine בין תאי סטרומה ותאי אפיתל ממאירים. ההשפעות של ממדיות גידול ואת microenvironment על תפקוד הסלולר מבוססות היטב, עם שני גורמי שינוי תרופה בתגובה 1,3,5-8. בנוסף, קינטיקה צמיחה הסלולר, קצב חילוף חומרים, ואיתות תא שונה בין שני ממדיים (2D) תרבות ותרבות 3D, עם גורמים אלה affecting תגובה תאית 1,3,8-10.
במבחנה, במיקרו-סביבה של פונדקאית הגידול יכול להיות מווסתת על ידי כולל מרכיבים ECM יציגים ונוגעים אוכלוסיות תאים סטרומה. תאי אפיתל ממאירים מושפעים ECM ותאי סטרומה הסרטן קשור או באופן סינרגיסטי / מגן לקדם התקדמות גידול או באופן מדכא לעכב 5,6,10 התפשטות גידול נוספת. בשני ההקשר, stroma יכול להשפיע על תגובה טיפולית משלוח סמים באמצעות איתות paracrine ו / או על ידי הגדלת לחץ ביניים בגידול הדבר שגרם לפגיעת משלוח סמים 1,6. לכן, התוספת של ECM ותאי סטרומה לתוך במודלים פרה תעזור לשחזר היבטים של הגידול כי לא יכול להיות מודל היטב בתרבות 2D.
בזאת שיטת להקים פונדקאיות סרטן השד משלב microenvironment מסכם, כולל מרכיבי ECM ו- sתאי tromal, בנפח 3D מתואר. בשנת סרטן השד, אוכלוסיית תאי סטרומה מורכבת ברובה של פיברובלסטים הסרטן קשור (CAF) ואת ECM סטרומה מורכב ברובה מסוג קולגן אני עם שיעור נמוך יותר של רכיבים מטריקס המצויים קרום המרתף, כולל laminin וסוג קולגן IV 1,4,11-13. לכן, רכיבים אלה של microenvironment סרטן שד (כלומר, CAF, אני קולגן, ואת קרום במרתף) שולבו את התחליפים. שיטה זו יכולה לשמש כדי ליצור פונדקאיות 3D מוצק, בלתי-perfused (איור 1 א) או יכול להיות מותאם לכלול זלוף של המדיום דרך פונדקאית באמצעות מערכת bioreactor (איור 1B). שתי הגישות המתוארות כאן. שיטה זו יכולה גם להיות שונה כדי לכלול אלמנטים סטרומה אחרים, כגון מקרופאגים גידולים הקשורים, או לבנות מודל גידולים מוצקים אחרים על ידי התאמת מרכיבים תאיים ו ECM, לפי העניין.
<pclass = "jove_content"> עבור הפונדקאית סרטן שד המתואר כאן, יש לנו מנוצל הקו הסלולרי מד"א- MB-231 (231) סרטן השד, CAF מבודדת בעבר מפני סרטן שד אנושי 14, ו ECM מורכב 90% קולגן אני ( 6 מ"ג / מ"ל) ו -10% חומר קרום במרתף מופחת גורם הגדילה (BM). הפונדקאי גם הוא גדל שקופית קאמרית 8 היטב (פונדקאית מוצקה) או מערכת bioreactor היא מנוצלת כדי לספק זלוף מזין רציף (פונדקאי perfused). כל מערכת bioreactor זלוף שיכול להכיל נפח של תאים המכילים ECM יכול לשמש 15. כדוגמא, אנו מתארים את הכנו את תחליפי רקמות במערכת bioreactor שלנו. מערכת זו פותחה ללא צורך במיקור חוץ אינו זמין מסחרי. בגלל ההתמקדות שלנו כאן היא על ההכנה והניתוח של פונדקאיות רקמת 3D, אנחנו לא נכנסנו בפירוט רב לגבי הפרטים של ייצור והרכבה של מערכת bioreactor שלנו. עם זאת, תיאור מפורט שלמערכת זו והתפתחותה פורסמו 16. במערכת bioreactor זה, ערוץ זרימה polydimethylsiloxane (PDMS) משמש כדי לשכן את פונדקאית, אשר נתמך על ידי קצף PDMS (נוצר באמצעות שיטות דומות לאלה שתוארו על ידי Calcagnile et al. 17). כרך זה הוא חדר 4 microchannels (כל 400 מיקרומטר קוטר) אשר perfused ברציפות על ידי מדיום באמצעות משאבת microphysiologic לספק חמצן וחומרים מזינים הפונדקאי.הניתוח מתאים של פונדקאיות הוא חיוני כדי לקבל מידע רלוונטי לגבי תפקוד הסלולר בתגובה לייחס או מניפולציות אחרות. מחליפים ניתן לנתח בשיטות שונות, כולל הדמיה ישירה של פונדקאיות שלמות באמצעות מיקרוסקופ confocal או אמצעים אחרים של הדמיה לא פולשנית, ניתוח הסלולר עקיף על ידי מנסה לאמוד תקשורת המותנה, או perfusate עבור מוצרים מופרשים, או ניתוח על סעיפים היסטולוגית לאחר קיבוע ועיבוד לפָּרָפִין. פרמטר אחד כזה שיכול להיות מוערך על סעיפים היסטולוגית הוא צפיפות תאים. אנו מציגים גישה אחת למדוד צפיפות התאים (כלומר, את מספר התאים בעלי הגרעין לכל אזור סעיף) באמצעות טכניקות עיבוד תמונה חצי אוטומטי להחיל photomicrographs סעיפים היסטולוגית פונדקאית מוכתם hematoxylin ו eosin (H & E). צפיפות התאים יכולים לשמש כאינדיקטור את השינוי היחסי מספר הסלולרי לאורך זמן או הנובע תנאים וטיפולים צמיחה שונים.
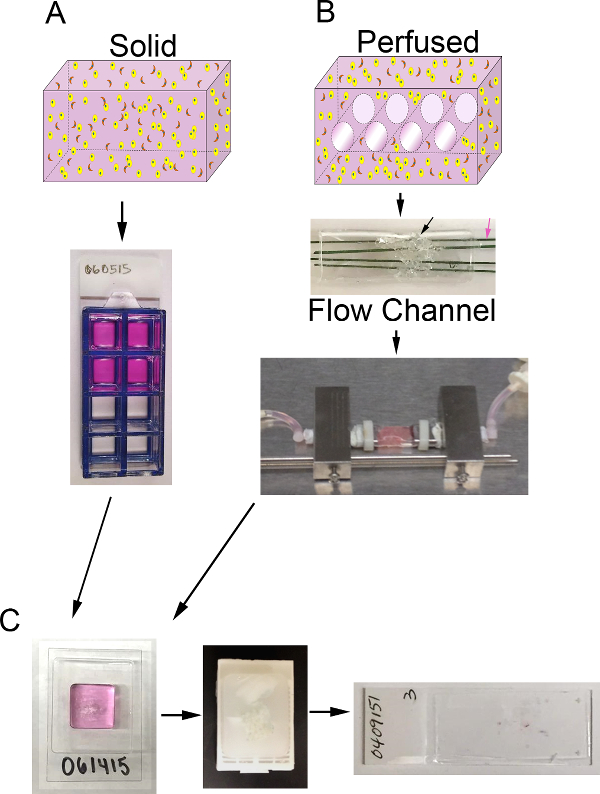
איור 1. נפח 3D ומערכת bioreactor. א) סכמטי של התהליך על מנת ליצור פונדקאיות 3D מוצקות. למעלה: קריקטורה של נפח 3D מוצק המכיל ECM (ורוד), קרצינומה של תאי אפיתל (צהובים), CAF (כתום); תחתון:. מבט מלמעלה של פונדקאיות המכילות שקופיות קאמריות 8-גם B) סכמטי של התהליך על מנת ליצור perfused פונדקאית 3D. למעלה: cartoon של נפח 3D עם ערוצים כדי לאפשר זלוף בינוני המכיל ECM (ורוד), קרצינומה של תאי אפיתל (צהוב), CAF (כתום); התיכון: תמונה של ערוץ זרימה PDMS המכיל קצף PDMS (חץ שחור) להיות מוזרק עם תא + ECM וחדרה ידי חוטי נירוסטה מצופה פולימר (חץ ורוד) מדידת 400 מיקרומטר קוטר; תחתונה:. תמונה של ערוץ הזרימה PDMS המכיל פונדקאית המחוברים למערכת bioreactor כדי לאפשר זלוף תווך רציף (משאבת peristaltic ואת המאגר התקשורת לא מוצג) C) תמונות של מדרגות עיבוד הן פונדקאיות מוצק perfused לאחר התרבות. משמאל: תמונה של cryomold המכיל דגימת עיבוד ג'ל פונדקאית; תיכון: תמונה של בלוק פרפין המכיל פונדקאי קבועה ומעובדים; מימין:. תמונה של זכוכית שקופית עם קטע היסטולוגית מוכתם E H & של פונדקאית אנא לחץ כאן כדי להציגגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
בזאת, שיטה של תרבות 3D תואר המשלבת רכיבים של microenvironment הרקמות, כוללים תאי מטריקס (ECM) ו פיברובלסטים סטרומה אדם, בנפח שיותר מקרוב מודלי סרטן השד אנושי כדי לאפשר התפתחות של מורפולוגיה 3D מסכמת . השיטה תרבות 3D תיאר מייצג בצורה טובה יותר של מחלות אנושיות מאשר תרבית תאים 2D ה?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Materials
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/mL |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Labtainer BPC Bag – 2 Ports, Luer Lock 50mL |
Thermo Scientific | SH3065711 | Example Media Reservoir |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
References
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip – A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).

