Préparation et analyse des<em> In vitro</em> Trois Breast Dimensional Carcinome Surrogates
Summary
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Abstract
Trois dimensions de la culture (3D) est une méthode plus physiologiquement pertinents pour modéliser le comportement des cellules in vitro que deux cultures dimensionnel. Les cancers, y compris les cancers du sein sont des tissus 3D complexes composées de cellules cancéreuses épithéliales et stromales de composants, y compris les fibroblastes et la matrice extracellulaire (ECM). Mais la plupart des modèles in vitro de cancer du sein sont constitués uniquement de cellules epitheliales cancéreuses, en omettant le stroma et, par conséquent, l'architecture en 3D d'une tumeur in vivo. modélisation 3D appropriée du cancer est important pour la compréhension précise de la biologie de la tumeur, le comportement et la réponse au traitement. Toutefois, la durée de la culture et le volume des modèles 3D est limitée par la disponibilité de l'oxygène et des nutriments dans la culture. Ici, nous démontrons une méthode dans laquelle les cellules de carcinome du sein épithéliales et les fibroblastes du stroma sont incorporés dans l'ECM pour générer une porteuse de cancer du sein en 3D qui comprend stroma et peuvent être cultivées en tant questructure 3D solide ou en utilisant un système de bioréacteur à perfusion pour délivrer de l'oxygène et de nutriments. Après l'installation et une période de croissance initiale, les substituts peuvent être utilisés pour le dépistage des drogues préclinique. En variante, les composants cellulaires et de la matrice de la mère porteuse peuvent être modifiés pour répondre à une variété de questions biologiques. Après la culture, les mères porteuses sont fixées et traitées à la paraffine, d'une manière similaire à la manipulation d'échantillons de carcinome du sein clinique pour l'évaluation des paramètres d'intérêt. L'évaluation de l'un de ces paramètres, la densité de cellules présentes, il est expliqué, le cas des systèmes logiciels d'analyse d'image et ImageJ CellProfiler sont appliqués à des photomicrographies des coupes histologiques de mères porteuses pour quantifier le nombre de cellules nucléées par zone. Ceci peut être utilisé comme un indicateur de la variation du nombre de cellules au cours du temps ou la variation du nombre de cellules résultant de différentes conditions de croissance et les traitements.
Introduction
Trois modèles (3D) de culture de dimensions qui imitent plus précisément l'architecture de la tumeur et microenvironnement in vivo sont importantes pour des études visant à disséquer les interactions complexes entre les cellules et leur microenvironnement et pour tester l'efficacité des thérapies candidates. Tumeur impacts dimensionnalité de l' oxygène et des gradients de nutriments, l'uniformité de l' exposition au médicament, interstitielle débit / pression sanguine, et de l' architecture 3D 1-4. La présence d'un micro-environnement stromal approprié contribue à la dimensionnalité des tumeurs et des influences de signalisation cellule-ECM et la signalisation entre paracrine des cellules stromales et les cellules épithéliales malignes. Les effets de la dimensionnalité de la tumeur et le microenvironnement sur la fonction cellulaire sont bien établis, avec les deux facteurs altérant la réponse aux médicaments 1,3,5-8. En outre, la cinétique cellulaire de croissance, les taux métaboliques, et la signalisation cellulaire diffèrent entre les deux (2D) la culture et de la culture dimensionnelle en 3D, avec ces facteurs affection réponse cellulaire 1,3,8-10.
In vitro, la tumeur microenvironnement porteuse peut être modulée en incluant des composantes représentatives de la MEC et les populations de cellules stromales. Les cellules épithéliales malignes sont influencées par l'ECM et les cellules stromales associées au cancer soit d'une manière synergique / protecteur pour favoriser la progression tumorale ou d'une manière suppressive pour inhiber la propagation ultérieure de la tumeur 5,6,10. Dans les deux contexte, le stroma peut affecter la réponse thérapeutique et la délivrance de médicaments par l' intermédiaire d'une signalisation paracrine et / ou en augmentant la pression interstitielle dans la tumeur , entraînant une diminution de l' administration de médicaments à 1,6. Par conséquent, l'ajout de l'ECM et les cellules stromales dans des modèles précliniques aidera récapituler les aspects de la tumeur qui ne peut pas être bien modélisé dans la culture 2D.
Ici une méthode pour établir des substituts du cancer du sein qui incorporent un microenvironnement récapitulatifs, y compris les composants et s ECMtromal cellules dans un volume 3D est décrit. Dans le cancer du sein, la population de cellules stromales est principalement constitué de fibroblastes associés au cancer (FAC) et l'ECM stromales se compose essentiellement de collagène de type I avec une faible proportion de composants de la matrice que l'on trouve dans la membrane basale, y compris la laminine et du collagène de type IV 1,4,11-13. Par conséquent, ces composants du microenvironnement de carcinome du sein (c. -à- CAF, le collagène I, et la membrane basale) ont été incorporés dans les mères porteuses. Cette méthode peut être utilisée pour générer des solides, des substituts de l' ONU 3D perfusé (figure 1A) ou peut être adapté pour inclure la perfusion du milieu à travers le substitut par l' intermédiaire d' un système de bioréacteur (figure 1B). Les deux approches sont décrites ici. Cette méthode peut également être modifiée pour inclure d'autres éléments du stroma, telles que les macrophages associés aux tumeurs, ou pour modéliser d'autres tumeurs solides en ajustant les composants cellulaires et ECM, le cas échéant.
<pclass = "jove_content"> Pour la substitution de carcinome du sein décrit ici, nous avons utilisé la MDA-MB-231 (231) , la lignée cellulaire de cancer du sein, CAF précédemment isolé du carcinome du sein humain 14, et un ECM composé de 90% de collagène I ( le facteur de croissance matériau 6 mg / ml) et 10% de sous-sol réduite membrane (BM). Le substitut est soit cultivé dans un 8 puits lame de chambre (substitut solide) ou un système de bioréacteur est utilisé pour fournir une perfusion de nutriment continue (substitution perfusé). Tout système de bioréacteur à perfusion qui peut accueillir un volume de cellules ECM contenant peut être utilisé 15. A titre d'exemple, nous décrivons la préparation des succédanés de tissus dans le système de bioréacteur. Ce système a été développé en interne et ne sont pas disponibles dans le commerce. Parce que notre accent est mis sur la préparation et l'analyse des substituts de tissu 3D, nous ne sommes pas allés dans de nombreux détails sur les spécificités de la fabrication et l'assemblage de notre système de bioréacteur. Toutefois, une description détailléece système et son développement a été publié le 16. Dans ce système de bioréacteur, un canal d'écoulement (PDMS) est utilisé pour loger la porteuse, qui est supporté par une mousse de PDMS (formé en utilisant des procédés similaires à ceux décrits par Calcagnile et al. 17). Ce volume est traversé par des microcanaux 4 (chacun de 400 um de diamètre) qui sont continuellement perfusées par du milieu par l'intermédiaire d'une pompe à microphysiologic pour fournir de l'oxygène et des nutriments à la substitution.Une analyse appropriée des mères porteuses est crucial d'obtenir des informations pertinentes concernant la fonction cellulaire en réponse à un traitement ou d'autres manipulations. Les substituts peuvent être analysés par différents procédés, y compris l'imagerie directe des mères porteuses intactes par microscopie confocale ou d'autres moyens d'imagerie non invasive, l'analyse cellulaire indirecte par dosage du milieu conditionné ou perfusé, pour les produits sécrétés, ou des analyses sur des coupes histologiques après la fixation et le traitement àparaffine. Un tel paramètre qui peut être évalué sur des coupes histologiques est la densité cellulaire. Nous présentons une approche pour mesurer la densité cellulaire ( à savoir, le nombre de cellules nucléées par section zone) en utilisant des techniques de traitement d' image semi-automatisés appliqués aux photomicrographies des coupes histologiques de substitution colorées à l' hématoxyline et l' éosine (H & E). La densité cellulaire peut être utilisée comme un indicateur de la variation relative du nombre de cellules au cours du temps ou qui résulte de différentes conditions de croissance et les traitements.
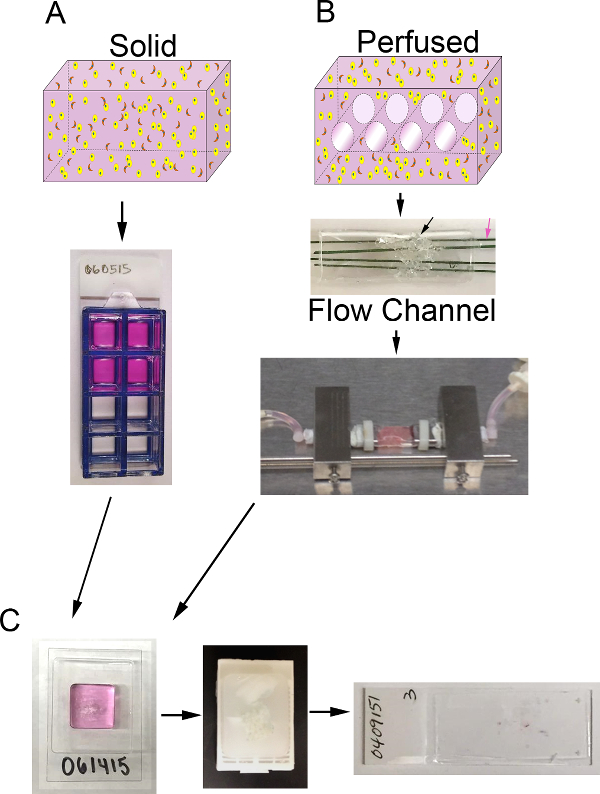
Figure 1. Volume 3D et système de bioréacteur. A) Schéma du processus pour produire des substituts 3D solides. Top: bande dessinée de volume 3D solide contenant ECM (rose), des cellules de carcinome épithéliales (jaune) et CAF (orange); Bottom:. Vue de dessus de 8 puits chambre diapositive contenant des substituts B) Schéma du processus pour générer perfusé mères porteuses 3D. Top: cartoon de volume 3D avec des canaux pour permettre perfusion de milieu et contenant ECM (rose), des cellules de carcinome épithéliales (jaune) et CAF (orange); Moyen: image de canal d'écoulement PDMS contenant de la mousse PDMS (flèche noire) à injecter avec la cellule + ECM et pénétrée par des fils d'acier inoxydable enduites de polymère (flèche rose) mesurant 400 m de diamètre; En bas:. L' image du canal d'écoulement de PDMS contenant une mère porteuse et connecté au système de bioréacteur pour permettre une perfusion de milieu continu (pompe péristaltique et le réservoir de support non représenté) , C) , les images des étapes de traitement pour les mères porteuses solides et perfusées après la culture. Gauche: image du cryomoule contenant l'échantillon de traitement du gel et de substitution; Moyen: l'image d'un bloc de paraffine contenant un substitut fixe et traité; A droite:. Image d'une lame de verre avec une coupe histologique H & E teinté d'un substitut S'il vous plaît cliquer ici pour voir uneune plus grande version de ce chiffre.
Protocol
Representative Results
Discussion
Ici, un procédé de culture en 3D a été décrite qui incorpore les composants du micro-environnement tissulaire, y compris la matrice extracellulaire (ECM) et les fibroblastes du stroma de l'homme, dans un volume plus près des modèles de cancer du sein humain pour permettre le développement d'une morphologie en 3D récapitulatif . Le procédé de culture en 3D décrit est plus représentatif de la maladie chez l'homme que la culture cellulaire traditionnelle 2D en ce que plusieurs types de cellules son…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Materials
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/mL |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Labtainer BPC Bag – 2 Ports, Luer Lock 50mL |
Thermo Scientific | SH3065711 | Example Media Reservoir |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
References
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip – A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).

