Tredimensjonal Kultur analysen til Explore Cancer Cell Invasivitet og satellitt tumordannelse
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
Pattedyrcellekultur i monolag er mye brukt til å studere forskjellige fysiologiske og molekylære prosesser. Men denne tilnærmingen til å studere voksende celler genererer ofte uønskede gjenstander. Derfor cellekultur i et tre-dimensjonalt (3D) miljø, ofte ved hjelp av ekstracellulære matriks-komponenter, dukket opp som et interessant alternativ på grunn av sin nære likhet med det native in vivo vev eller organ. Vi har utviklet en 3D-cellekultursystem med to avdelinger, nemlig (i) en sentral del som inneholder kreftceller innleiret i en kollagen-gel som virker som et pseudo-primær macrospherical tumor og (ii) en perifer cellefri kammer laget av et fibrin gel, det vil si et ekstracellulært matrisekomponent forskjellig fra den som anvendes i midten, hvor kreftceller kan migrere (invasjon foran) og / eller dannelse av mikrosfærisk tumorer som representerer sekundære eller satellitt tumorer. Dannelsen av satellitt tumorer i det perifere kammer erbemerkelsesverdig korrelert til den kjente aggressivitet eller metastatisk opprinnelse av de innfødte kreftceller, noe som gjør denne 3D kultur systemet unikt. Denne cellekultur tilnærming kan anses for å vurdere kreftcelle invasivitet og motilitet, celle-ekstracellulær matriks interaksjoner, og som en metode for å evaluere anti-kreft legemidler egenskaper.
Introduction
Gransker de grunnleggende og biomedisinske egenskaper ved kreftcelle invasjon / migrasjon og påfølgende metastase etablering er gjenstand for en intens forskning 1,2. Metastase er den ultimate stadium av kreft og dens kliniske behandlingen fortsatt ukjent. En bedre forståelse av metastaser på cellulære og molekylære nivåer vil muliggjøre utvikling av mer effektive behandlingsformer 3.
Flere egenskaper av metastatiske celler kan utforskes in vitro 4 inkludert deres stemness og potensial til å skaffe seg en overgang tilstand (f.eks epithelioid-mesenchymale overgang) for å migrere og invadere i og fra den primære svulsten 5. Imidlertid har den in vitro vurderingen av invasjons / metastaseprosesser vært en utfordring, siden det praktisk talt utelukker bidraget av blod / lymfatiske sirkulasjon. Organotypiske kulturer som embed tumorfragmenter i kollagen gels har previouslu blitt brukt til å overvåke kreft aggressivitet. Selv om kompleksiteten av tumorer er bevart (f.eks tilstedeværelsen av ikke-kreftceller), tumorfragmenter blir utsatt for begrenset diffusjon medium, for prøvetaking variasjon, og til en overvekst av stromale celler 6. En alternativ metode består i voksende kreftceller innenfor komponenter i den ekstracellulære matriks (ECM), som etterligner den tredimensjonale (3D) cellemiljøet. Spredning av brystkreftcellelinjer i en kollagen-gel og / eller en basalmembran-avledet matriks er blant de best karakteriserte eksempler på 3D-cellekultur. Ved å bruke spesielle 3D cellekultur miljøer, kan uorganisert montering observert for brystkreft celler dyrket under standardbetingelser reverseres i den spontane dannelsen av melke acini og rørformede strukturer 7-10. Videre er dannelsen av flercellede tumor sfæroider avledet fra adenokarsinom-cancerceller deltar ved hjelp av ulike teknikker (f.eks hengende dråper, flytende sfæroider, agar embedment) nå utgjør den mest brukte 3D-cellekultur-analyse 11-13. Imidlertid er denne analysen begrenset av den begrensede sett av kreftcellelinjer som kan danne sfæroider og ved den korte perioden tilgjengelig for å studere celler i disse tilstandene.
I denne visualisert teknikken, vi heri innføre en sofistikert 3D-cellekultur-analyse hvor kreftcellene av interesse er innleiret i en kollagen-gel for å tillate in vitro dannelse av en pseudo-primærtumor som kan alternativt belegges med en basalmembran-avledet matrise. En gang er dannet, blir den pseudo-primær tumor deretter klemt i en acellulær matrise (fibringel i det foreliggende tilfelle), noe som gjør at kreftceller til å krysse grenseflaten mellom de to kamrene matriks (se figur 1). Interessant, sekundær tumor-lignende strukturer som stammer fra den pseudo-primærtumor sammen med aggressive kreftceller vises ifibringel. Et slikt 3D kultursystem gir den fleksibilitet som kreves for å undersøke, for eksempel anticancer legemidler, genekspresjon og celle-celle og / eller celle-interaksjoner ECM 14-16.
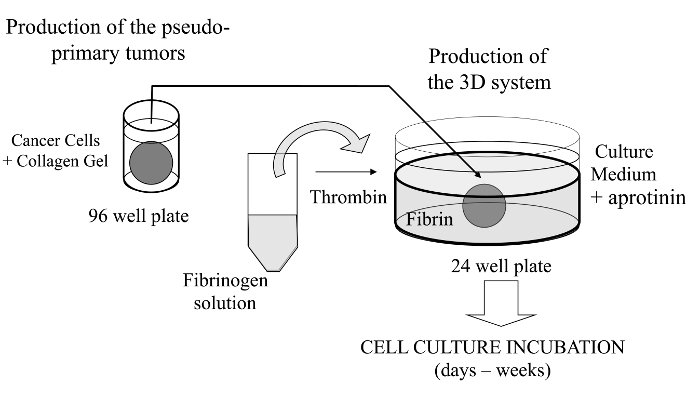
Figur 1:.. Oversikt over Method Skjematisk oppsummering av metode for å generere 3D cellekultur system som modell for kreftstudier Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Som et viktig teknisk fotnote, er det avgjørende at ikke i noe gap er til stede på grenseflaten mellom det sentrale og det perifere geler. Ellers kan det redusere kapasiteten av cellene for å migrere / invaderer fibringel. Et mellomrom mellom kollagen og fibrin-geler kan dannes i løpet av den første 24-timers kultur hvis trombin ikke er passende fortynnet. Det er også mulig at cellelinjen testet kunne føre kollagen gelen for å trekke seg sammen i løpet av kulturen, for derved å forårsake en forholdsvis stor p…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65-85% protein with ≥75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5-10TIU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).

