Синтез РГД-функционализированного гидрогелей в качестве инструмента для терапевтических применений
Summary
We present a protocol for the synthesis of RGD-functionalized hydrogels as devices for cell and drug delivery. The procedure involves copper catalyzed alkyne-azide cycloaddition (CuAAC) between alkyne-modified polyacrylic acid (PAA) and a RGD-azide derivative. The hydrogels are formed using microwave-assisted polycondensation and their physicochemical properties are investigated.
Abstract
The use of polymers as biomaterials has provided significant advantages in therapeutic applications. In particular, the possibility to modify and functionalize polymer chains with compounds that are able to improve biocompatibility, mechanical properties, or cell viability allows the design of novel materials to meet new challenges in the biomedical field. With the polymer functionalization strategies, click chemistry is a powerful tool to improve cell-compatibility and drug delivery properties of polymeric devices. Similarly, the fundamental need of biomedicine to use sterile tools to avoid potential adverse-side effects, such as toxicity or contamination of the biological environment, gives rise to increasing interest in the microwave-assisted strategy.
The combination of click chemistry and the microwave-assisted method is suitable to produce biocompatible hydrogels with desired functionalities and improved performances in biomedical applications. This work aims to synthesize RGD-functionalized hydrogels. RGD (arginylglycylaspartic acid) is a tripeptide that can mimic cell adhesion proteins and bind to cell-surface receptors, creating a hospitable microenvironment for cells within the 3D polymeric network of the hydrogels. RGD functionalization occurs through Huisgen 1,3-dipolar cycloaddition. Some PAA carboxyl groups are modified with an alkyne moiety, whereas RGD is functionalized with azido acid as the terminal residue of the peptide sequence. Finally, both products are used in a copper catalyzed click reaction to permanently link the peptide to PAA. This modified polymer is used with carbomer, agarose and polyethylene glycol (PEG) to synthesize a hydrogel matrix. The 3D structure is formed due to an esterification reaction involving carboxyl groups from PAA and carbomer and hydroxyl groups from agarose and PEG through microwave-assisted polycondensation. The efficiency of the gelation mechanism ensures a high degree of RGD functionalization. In addition, the procedure to load therapeutic compounds or biological tools within this functionalized network is very simple and reproducible.
Introduction
Гидрогели представляют собой трехмерные сетки, образованные гидрофильными сшитые полимеры, которые являются природными или синтетическими, и характеризуется отличительным трехмерной структурой. Эти устройства становятся все более привлекательными в биомедицинской области доставки лекарственных средств, тканевой инженерии, носителей генов и интеллектуальных датчиков 1,2. В самом деле, высокое содержание в них воды, а также их реологические и механические свойства делают их пригодными кандидатами для имитации микросреды мягких тканей и сделать их эффективными инструментами для водорастворимого цитокина или доставки фактора роста. Одним из наиболее перспективных является использование в качестве инъекционного биоматериала несущей клетки и биологически активных соединений. Гидрогели может улучшить выживаемость клеток и судьбу контроля стволовых клеток путем проведения и точно доставлять регуляторные сигналы стволовых клеток в физиологической соответствующим образом, как это наблюдалось в в пробирке и в экспериментах 3,4 в естественных условиях. Ведущее преимуществом этого является возможностьдля поддержания клеток в инъекционные зоне прививки (на месте), сводя к минимуму количество клеток , которое оставляет область и экстравазатов в кровеносную поток, мигрируя по всему телу и потери целевой цели 5. Устойчивость трехмерных гидрогелевых сетей обусловлено его сшивающих сайтов, образованных ковалентными связями или силами сцепления между полимерными цепями 6.
В этом контексте ортогональным селективной химии применительно к полимерной цепи является универсальным инструментом , способным улучшить гидрогелевые выступления 7. Действительно, модификация полимеров с подходящими химическими группами, может помочь обеспечить надлежащее химические, физические и механические свойства для повышения жизнеспособности клеток и их использования в процессе формирования ткани. Таким же образом, среди методов для загрузки клеток или факторов роста в гелевой матрице, использование RGD-пептида позволяет улучшения адгезии клеток и выживаемости. РГД является трипептид, состоящийаргинина, глицина и аспарагиновой кислоты, которая на сегодняшний день является наиболее эффективным и часто используется трипептид из – за его способности решать более одного рецептора клеточной адгезии и его биологического воздействия на клетки анкеровки, поведение и выживание 8,9. В этой работе, синтез РГД-функционализированный гидрогели изучается с целью проектирования сетей характеризуется достаточной биохимическими свойствами для гостеприимного клеток микроокружения.
Использование СВЧ – излучения в синтезе гидрогеля предлагает простую процедуру , чтобы свести к минимуму побочные реакции и получить более высокие скорости реакции и урожайности в течение более короткого периода времени по сравнению с обычными тепловыми процессами 10. Этот метод не требует стадий очистки и дает стерильные гидрогели из – за взаимодействия полимеров и отсутствие органического растворителя в реакционной системе 11. Таким образом, он обеспечивает высокий процент РГД, связанных с полимерной сети, так как не модаifications необходимы для химических групп полимеров, участвующих в образовании геля. Карбоксильные группы, из ПАА и карбомер, и гидроксильных групп, с ПЭГ и агарозы, вызывают гидрогель трехмерную структуру с помощью реакции поликонденсации. Указанные полимеры используются для синтеза гидрогелей в повреждении спинного мозга ремонта лечения 12. Эти устройства, как сообщалось в предыдущих работах 13,14, показывают высокую биосовместимость, а также механические и физико – химические свойства, напоминающие многих живых тканей и в тиксотропной природе. Более того, они остаются локализованными на месте, в зоне инъекции.
В этой работе, PAA карбоксильные группы модифицируют с алкина фрагментом (фиг.1), и РГД-азид синтезируется эксплуатируют реакционную способность концевой группы трипептида -NH 2 с подготовленной химического соединения со структурой (CH 2) N – N 3 (<сильный> Рисунок 2). Впоследствии модифицированный ПАА реагирует с производным РГД-азида через CuAAC щелчка реакции 15-17 (рисунок 3). Использование меди (I) в качестве катализатора, приводит к значительному улучшению как скорость реакции и региоселективностью. Реакцию CuAAC широко используется в органическом синтезе и в науке о полимерах. Он сочетает в себе высокую эффективность и высокую толерантность к функциональным группам, и это не зависит от применения органических растворителей. Высокая селективность, быстрое время реакции и простая процедура очистки позволяют Получение звездообразных полимеров, блок – сополимеров или цепей прививаемых желаемых фрагментов 18. Эта стратегия щелчок позволяет модифицировать полимеры, после полимеризации, чтобы настроить физико-химические свойства в зависимости от конечного применения биохимического. Условия CuAAC экспериментальные легко воспроизводимым (реакция не чувствительна к воде, в то время как окисление меди может происходить в минимальной степени), и характерформируется триазола обеспечивает стабильность продукта. Использование металлической меди можно считать критической точкой, из-за его потенциальной токсического эффекта в отношении клеток и в биологическом микросреду, но диализ используется в качестве метода очистки, чтобы позволить полное удаление каталитических остатков. Наконец, РАА модифицированный РГД используется в синтезе гидрогеля (рисунок 4) и физико – химических свойств полученных сетей исследованы, чтобы проверить потенциальную функциональность этих систем в качестве клеток или наркотиков носителей.
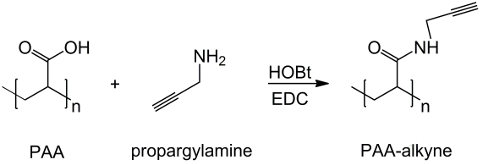
Рисунок 1: РАА модифицированный синтез алкиновой схему ПАА функционализации с алкиновой группой;. "п" означает , мономеры с карбоксильной группой взаимодействия с пропаргиламина. Пожалуйста , нажмите сюда , чтобы просмотретьувеличенная версия этой фигуры.
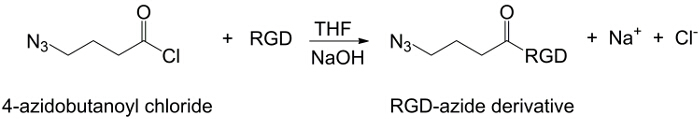
Рисунок 2:.. РГД-азид синтез Синтез РГД-азид производной Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
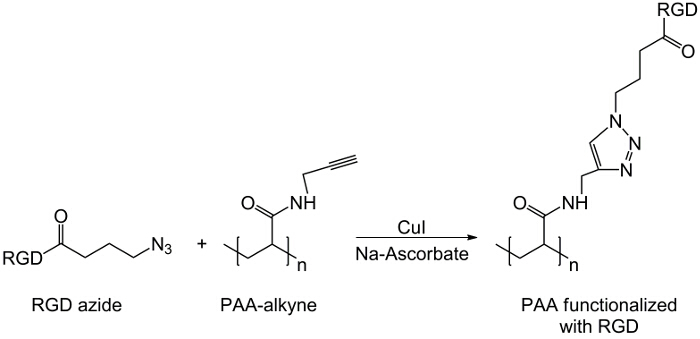
Рисунок 3: Нажмите реакции Схема реакции мыши между производным РГД-азида и алкинов-РАА.. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
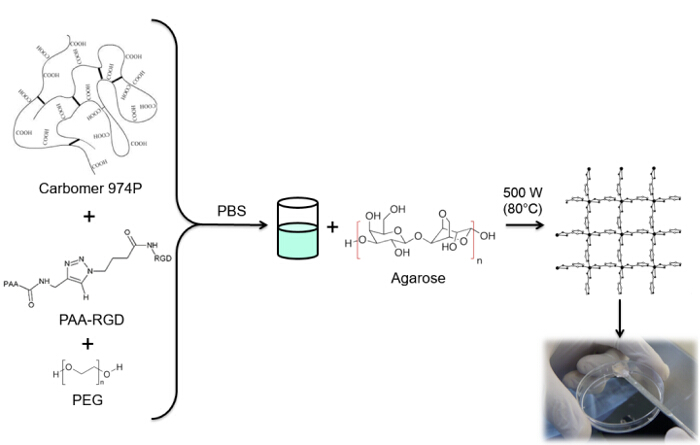
Рисунок 4: Гидрогель Synthesis. РГД функционализированный процедура синтеза гидрогеля. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Protocol
Representative Results
Discussion
The PAA post-polymerization modification with alkyne moieties and the RGD functionalization with the azide group guarantee the formation of a stable bond between the polymer and the peptide. Indeed, triazole serves as a rigid linking unit among the carbon atoms, attached to the 1,4 positions of the 1,2,3-triazole ring and it cannot be cleaved hydrolytically or otherwise. In addition, triazole is extremely difficult to oxidize and reduce, unlike other cyclic structures such as benzenoids and related aromatic heterocycles<…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы поблагодарить профессора Маурицио Мази для плодотворной дискуссии и мисс Chiara Allegretti для редактирования языка. Исследование авторов поддерживается Бандо Джовани Ricercatori 2010 (Ministero делла Салюте GR-2010- 2312573).
Materials
| Poly(acrylic acid) solution average Mw ~ 100,000, 35 wt % in H2O | Sigma Aldrich | 523925 | CAS 9003-01-4 |
| Poly(ethylene glycol) 2,000 | Sigma Aldrich | 84797 | CAS 25322-68-3 |
| Carbomeer 974P | Fagron | 1387083 | |
| Agarose | Invitrogen Corp. | 16500-500 | UltraPure Agarose |
| RGD peptide | abcam | ab142698 | |
| 4-azidobutanoic acid | Aurum Pharmatech | Z-2421 | CAS 54447-68-6 |
| Oxalyl chloride | Sigma Aldrich | O8801 | CAS 79-37-8 |
| Propargylamine hydrochloride 95% | Sigma Aldrich | P50919 | CAS 15430-52-1 |
| Copper(I) iodide | Sigma Aldrich | 3140 | CAS 7681-65-4 |
| Sodium ascorbate | Sigma Aldrich | Y0000039 | CAS 134-03-2 |
| Phosphate buffered saline | Sigma Aldrich | P4417 | |
| Dialysis Membrane | Spectrum Laboratories, Inc. | 132725 | Spectra/Por 3 Dialysis Membrane Standard RC Tubing MWCO: 3,5 kD |
References
- Slaughter, B. V., Khurshid, S. S., Fisher, O. Z., Khademhosseini, A., Peppas, N. A. Hydrogels in Regenerative Medicine. Adv. Mater. 21 (32-33), 3307-3329 (2009).
- Rossi, F., Perale, G., Papa, S., Forloni, G., Veglianese, P. Current options for drug delivery to the spinal cord. Expert Opin. Drug Deliv. 10 (3), 385-396 (2013).
- Huebsch, N., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Mothe, A. J., Tam, R. Y., Zahir, T., Tator, C. H., Shoichet, M. S. Repair of the injured spinal cord by transplantation of neural stem cells in a hyaluronan-based hydrogel. Biomaterials. 34 (15), 3775-3783 (2013).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat. Mater. 12 (5), 458-465 (2013).
- Ashley, G. W., Henise, J., Reid, R., Santi, D. V. Hydrogel drug delivery system with predictable and tunable drug release and degradation rates. Proc. Natl. Acad. Sci. U S A. 110 (6), 2318-2323 (2013).
- Rossi, F., van Griensven, M. Polymer Functionalization as a Powerful Tool to Improve Scaffold Performances. Tissue Eng. Part A. 20 (15-16), 2043-2051 (2014).
- Gould, S. T., Darling, N. J., Anseth, K. S. Small peptide functionalized thiol-ene hydrogels as culture substrates for understanding valvular interstitial cell activation and de novo tissue deposition. Acta Biomater. 8 (9), 3201-3209 (2012).
- Azagarsamy, M. A., Anseth, K. S. Wavelength-Controlled Photocleavage for the Orthogonal and Sequential Release of Multiple Proteins. Angew. Chem. Int. Edit. 52 (51), 13803-13807 (2013).
- Larrañeta, E., et al. Microwave-Assisted Preparation of Hydrogel-Forming Microneedle Arrays for Transdermal Drug Delivery Applications. Macromol. Mater. Eng. 300 (6), 586-595 (2015).
- Cook, J. P., Goodall, G. W., Khutoryanskaya, O. V., Khutoryanskiy, V. V. Microwave-Assisted Hydrogel Synthesis: A New Method for Crosslinking Polymers in Aqueous Solutions. Macromol. Rapid Comm. 33 (4), 332-336 (2012).
- Perale, G., et al. Multiple drug delivery hydrogel system for spinal cord injury repair strategies. J. Control. Release. 159 (2), 271-280 (2012).
- Rossi, F., Perale, G., Storti, G., Masi, M. A Library of Tunable Agarose Carbomer-Based Hydrogels for Tissue Engineering Applications: The Role of Cross-Linkers. J. Appl. Polym. Sci. 123 (4), 2211-2221 (2012).
- Frith, J. E., et al. An injectable hydrogel incorporating mesenchymal precursor cells and pentosan polysulphate for intervertebral disc regeneration. Biomaterials. 34 (37), 9430-9440 (2013).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click chemistry: Diverse chemical function from a few good reactions. Angew. Chem. Int. Edit. 40 (11), (2001).
- Sacchetti, A., Mauri, E., Sani, M., Masi, M., Rossi, F. Microwave-assisted synthesis and click chemistry as simple and efficient strategy for RGD functionalized hydrogels. Tetrahedron Lett. 55 (50), 6817-6820 (2014).
- Ossipov, D. A., Hilborn, J. Poly(vinyl alcohol)-based hydrogels formed by "click chemistry". Macromolecules. 39 (5), 1709-1718 (2006).
- Truong, V., Blakey, I., Whittaker, A. K. Hydrophilic and Amphiphilic Polyethylene Glycol-Based Hydrogels with Tunable Degradability Prepared by "Click" Chemistry. Biomacromolecules. 13 (12), 4012-4021 (2012).
- Hou, R. Z., et al. New synthetic route for RGD tripeptide. Prep. Biochem. Biotechnol. 36 (3), 243-252 (2006).
- Rossi, F., Chatzistavrou, X., Perale, G., Boccaccini, A. R. Synthesis and Degradation of Agar-Carbomer Based Hydrogels for Tissue Engineering Applications. J. Appl. Polym. Sci. 123 (1), 398-408 (2012).
- Mauri, E., Rossi, F., Sacchetti, A. Tunable drug delivery using chemoselective functionalization of hydrogels. Mater. Sci. Eng. C. 61, 851-857 (2016).
- Joaquin, A., Peppas, N. A., Zoldan, J. Hydrogel Polymer Library for Developing Induced Pluripotent Stem Cell Derived Cardiac Patches. Tissue Eng. Part A. 20, S55-S55 (2014).
- Rossi, F., et al. Tunable hydrogel-Nanoparticles release system for sustained combination therapies in the spinal cord. Colloids Surf. B Biointerfaces. 108, 169-177 (2013).
- Kolb, H. C., Sharpless, K. B. The growing impact of click chemistry on drug discovery. Drug Discov. Today. 8 (24), 1128-1137 (2003).
- Ossipov, D. A., Yang, X., Varghese, O., Kootala, S., Hilborn, J. Modular approach to functional hyaluronic acid hydrogels using orthogonal chemical reactions. Chem. Commun. 46 (44), 8368-8370 (2010).
- Anderson, S. B., Lin, C. C., Kuntzler, D. V., Anseth, K. S. The performance of human mesenchymal stem cells encapsulated in cell-degradable polymer-peptide hydrogels. Biomaterials. 32 (14), 3564-3574 (2011).
- Caron, I., et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 75, 135-147 (2016).
- Lee, J. W., Kim, H., Lee, K. Y. Effect of spacer arm length between adhesion ligand and alginate hydrogel on stem cell differentiation. Carbohyd. Polym. 139, 82-89 (2016).
- Liu, Y., Fan, Z., Wang, Y., Yu, L. Controlled Release of Low Molecular Protein Insulin-like Growth Factor-1 through Self-Assembling Peptide Hydrogel with Biotin Sandwich Approach. J.Biomed. Eng. 32 (2), 387-392 (2015).

