सापेक्ष कोशिका की सतह और संयोजक आयन चैनलों के कुल अभिव्यक्ति से फ्लो का उपयोग का निर्धारण
Summary
विरासत में मिला कार्डियक arrhythmias अक्सर परिवर्तन है कि एक या एक से अधिक आयन चैनल की सतह वितरण में परिवर्तन के कारण होता है। यहाँ, हम टीएसए-201 कोशिकाओं में व्यक्त पुनः संयोजक आयन चैनल के सापेक्ष कुल और कोशिका की सतह प्रोटीन अभिव्यक्ति का एक मात्रा का ठहराव प्रदान करने के लिए assays के प्रवाह cytometry लिए अनुकूल है।
Abstract
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Introduction
इस पत्र में इस तरह के मौजूदा प्रवाह cytometry प्रौद्योगिकी का उपयोग कर पुनः संयोजक कोशिकाओं में व्यक्त आयन चैनल के रूप में झिल्ली प्रोटीन के रिश्तेदार कोशिका की सतह अभिव्यक्ति रिपोर्ट करने के लिए एक विश्वसनीय परख प्रदान करता है। आयन चैनलों ताकना के गठन झिल्ली प्रोटीन है कि कोशिका झिल्ली भर आयनों के प्रवाह gating द्वारा विद्युत संकेतों को नियंत्रित करने के लिए जिम्मेदार हैं। वे सक्रियण तंत्र, प्रकृति, और ध्यान में लीन होना है, जहां वे स्थानीय कर रहे हैं के माध्यम से गुजर आयन प्रजातियों के चयनात्मकता द्वारा वर्गीकृत कर रहे हैं। सेलुलर और ऊतक के स्तर पर, आयन चैनलों के माध्यम से स्थूल आयन अपशिष्टों biophysical (gating और पारगमन), जैव रासायनिक (फोस्फोराइलेशन), और जीवजनन (संश्लेषण, ग्लाइकोसिलेशन, तस्करी, और गिरावट) गुण 1 के उत्पाद हैं। इन प्रक्रियाओं में से प्रत्येक के आयन चैनल के हर प्रकार के लिए अद्वितीय है और आयन चैनल के शारीरिक भूमिका को पूरा करने के लिए अनुकूलित है। नतीजतन, एक के माध्यम से इन ठीक-देखते प्रक्रियाओं में से किसी में परिवर्तनविरासत में मिला है या एक आनुवंशिक संशोधन, अक्सर "channelopathy" के रूप में भेजा, सेल homeostasis के लिए हानिकारक हो सकता है। यह तनाव है कि कोशिका की सतह पर आयन चैनल के "सही" राशि पहुंचाने सेल homeostasis के लिए महत्वपूर्ण है महत्वपूर्ण है। यहां तक कि छोटे बढ़ जाती है (लाभ के समारोह) और छोटे कम हो जाती है (हानि के समारोह) आयन चैनल गतिविधि में एक जीवनकाल में एक गंभीर विकृति पैदा करने की क्षमता है। परिपक्व आयन चैनल की कोशिका की सतह वितरण में दोष ऐसे सिस्टिक फाइब्रोसिस (CFTR आयन चैनल) 2 और लंबे क्यूटी सिंड्रोम फॉर्म (हृदय पोटेशियम चैनल) 3 के कार्डियक arrhythmias के रूप में कई channelopathies, में एक महत्वपूर्ण निर्धारक है।
Channelopathies हृदय अचानक मौत 4 के साथ जुड़े रहे हैं। सभी हृदय channelopathies की वर्तमान दुनिया भर में प्रसार कम से कम 1 माना जाता है: 2,000-1: अलग-अलग 5 प्रति 3000 और अचानक arrhythmic हृदय की मौत सीए के बारे में आधे के लिए जिम्मेदार हैंसत्र 6। हृदय वोल्टेज gated sodium-, potassium- में शिथिलता, और कैल्शियम आयन चैनल चयनात्मक इस प्रक्रिया में एक महत्वपूर्ण भूमिका निभाने के लिए जाना जाता है। एल प्रकार सीए वी 1.2 वोल्टेज gated कैल्शियम चैनल सिंक्रनाइज़ हृदय की मांसपेशी संकुचन आरंभ करने के लिए आवश्यक है। हृदय एल प्रकार सीए वी 1.2 चैनल एक बहु सबयूनिट प्रोटीन सहायक सब यूनिटों 7-12 α2δ1 मुख्य ताकना बनाने सीए वी α1 सबयूनिट और सीए वी एस एस और सीए वी की रचना की जटिल है। ध्यान दें कि सहायक सब यूनिटों की पूर्ण पूरक प्लाज्मा झिल्ली में कार्यात्मक सीए वी 1.2 चैनलों और गतिशील बातचीत उत्पादन की आवश्यकता है इन सब यूनिटों के बीच 13 दिल के सामान्य बिजली समारोह का समर्थन करने के लिए आवश्यक हैं। सीए वी एसएस सीए वी की कोशिका की सतह अभिव्यक्ति एक गैर सहसंयोजक nanomolar हाइड्रोफोबिक बातचीत 14 के माध्यम से 1.2 चैनलों को बढ़ावा देता है। सीए वी α2δ1 सबयूनिट वाई के सह अभिव्यक्तिवें सीए वी एस एस बाध्य सीए वी α1 शिखर वर्तमान अभिव्यक्ति (5 से 10 गुना करने के लिए) को बढ़ावा देने और अधिक नकारात्मक वोल्टेज पर चैनल सक्रियण को बढ़ावा देता है। लाभ के समारोह ताकना बनाने सबयूनिट सीए वी 1.2 लंबे क्यूटी सिंड्रोम 15 के तीन मुख्य यूनिटों एल प्रकार सीए वी 1.2 चैनल के गठन में बिंदु उत्परिवर्तन के एक मेजबान जबकि कहा जाता वेंट्रिकुलर अतालता के एक फार्म के साथ संबद्ध किया गया है का म्यूटेशन लघु क्यूटी सिंड्रोम प्रपत्र 16,17 के arrhythmias से पीड़ित विषयों में पहचान की गई है। आयन चैनलों झिल्ली प्रोटीन है कि एक जैव रासायनिक परिप्रेक्ष्य (प्रोटीन रसायन विज्ञान) से जांच की जा सकती है या electrophysiological उपकरण (वर्तमान पैदा मशीनों) और अक्सर इन पूरक दृष्टिकोण का उपयोग कर का उपयोग कर रहे हैं। इलेक्ट्रोफिजियोलॉजी, विशेष रूप से पूरे सेल पैच clamping में, एक उपयुक्त दृष्टिकोण आयन चैनल 15 के समारोह को स्पष्ट करने के लिए है लेकिन उनके biophysical में परिवर्तन से प्रोटीन की तस्करी में संशोधनों को हल नहीं कर सकतेगुण। प्रोटीन रसायन विज्ञान, हालांकि, कई बार उपयोग छोटे घुलनशील प्रोटीन के सापेक्ष बड़ी झिल्ली प्रोटीन की अपेक्षाकृत कम अभिव्यक्ति के कारण सीमित है। मजबूत उच्च throughput प्रतिदीप्ति readout का उपयोग तरीकों आदेश विशेष आयन चैनल की कोशिका की सतह अभिव्यक्ति में परिवर्तन के कारण प्रोटीन biogenesis में दोष को संबोधित करने में विकसित किए जाने की जरूरत है।
प्रवाह cytometry एक biophysical सेल गिनती, छंटाई, बायोमार्कर का पता लगाने, और प्रोटीन इंजीनियरिंग 18 में कार्यरत तकनीक है। जीवित कोशिकाओं या कणों का एक नमूना समाधान कोशिकामापी एक प्रवाह में इंजेक्ट किया जाता है, कोशिकाओं एक धारा है कि मशीन का पता लगाने प्रणाली (चित्रा 1) द्वारा जांच की जा सकती में आदेश दिए हैं। 1956 19 में उत्पादित साधन कोशिकामापी पहले प्रवाह केवल एक पैरामीटर का पता चला, लेकिन आधुनिक प्रवाह cytometers कई लेजर और प्रतिदीप्ति डिटेक्टरों कि अधिक से अधिक 30 फ्लोरोसेंट मानकों को 20,21 का पता लगाने की अनुमति है।फिल्टर और दर्पण (उत्सर्जन प्रकाशिकी) एक इलेक्ट्रॉनिक नेटवर्क (photodiode और डिटेक्टरों) कि इसकी तीव्रता को आनुपातिक प्रकाश में परिवर्तित करने के लिए प्रकाश बिखराव या कोशिकाओं के फ्लोरोसेंट प्रकाश प्रत्यक्ष। डिजिटल डेटा विशेष सॉफ्टवेयर का उपयोग विश्लेषण कर रहे हैं और प्राथमिक उत्पादन एक डॉट साजिश 21 के रूप में प्रदर्शित किया जाता है।
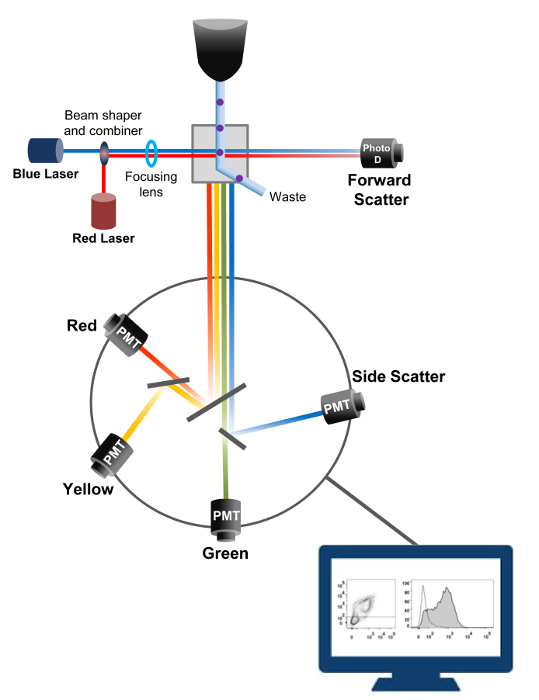
चित्रा 1:। प्रवाह की biophysical सिद्धांतों cytometry छँटाई एकल कक्षों म्यान तरल पदार्थ की एक धारा है जो उन्हें एक या एक से अधिक लेजर पूछताछ अंक के पार ले जाता है के भीतर उच्च दबाव के तहत एक नोजल के माध्यम से धकेल रहे हैं। प्रकाश किरण गुजर कोशिकाओं द्वारा हटाया हुआ है और आगे की दिशा (आगे तितर बितर, एफसीएस) में एकत्र प्रकाश एक photodiode है कि एक संकेत कोशिका के आकार के लिए आनुपातिक में प्रकाश धर्मान्तरित के लिए भेजा है। प्रकाश भी लेजर पथ के लिए एक 90 डिग्री के कोण पर एकत्र की है और डिटेक्टरों (भी बुलाया photomultipliers (पीएमटी)) के लिए भेजा है।यह प्रकाश dichroic दर्पण उस तरफ बिखराव के संकेत (एसएससी) है, जो कोशिकाओं के भीतर विघटन को दर्शाता है का पता लगाने की अनुमति, और फ्लोरोसेंट उत्सर्जन के माध्यम से कराई जाती है, तो उत्साहित fluorochromes सेल में मौजूद हैं। तीन डिटेक्टरों (हरे, पीले और लाल) विभिन्न fluorochromes के एक साथ पता लगाने के लिए अनुमति देता अलग तरंग दैर्ध्य bandpass फिल्टर के साथ प्रतिनिधित्व कर रहे हैं। विभिन्न संकेतों एक बाहरी कंप्यूटर द्वारा डिजीटल और डेटा है कि कोशिकाओं की विशेषताओं यों तो विश्लेषण किया जाएगा में परिवर्तित कर रहे हैं। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
प्रवाह cytometers के उच्च throughput क्षमता पुनः संयोजक जंगली प्रकार और तस्करी की कमी वोल्टेज gated एल प्रकार सीए वी 1.2 चैनलों और जीवित कोशिकाओं में जुड़े सब यूनिटों के रिश्तेदार झिल्ली अभिव्यक्ति यों तो शोषण किया गया था। सीडीएनए सह constructsप्रोटीन के लिए डिंग दोगुना एक साथ एक बाह्य गैर फ्लोरोसेंट मिलान कि एक अभेद्य फ्लोरोसेंट संयुग्मित एंटीबॉडी और एक intracellular fluorophore कि अनिवार्यता से फ्लोरोसेंट है से पता लगाया जा सकता है ले जाने के लिए टैग किया गया। दोनों बाह्य मिलान, प्रोटीन की एक बाह्य पाश में डाला, और intracellular fluorophore, सी टर्मिनस के बाद डाला, प्रोटीन के साथ अनुवाद कर रहे हैं। प्रयोगों की इस श्रृंखला में, सीए वी α2δ1 प्रोटीन एक बाह्य hemagglutinin (हेक्टेयर) मिलान (YPYDVPDYA) एक अभेद्य FITC (Fluorescein आइसोथियोसाइनेट) द्वारा पता लगाया व्यक्त करने के लिए इंजीनियर था आंतरिक intracellular fluorophore के रूप में विरोधी हा और mCherry संयुग्मित। MCherry-सीए वी α2δ1 हा टैग प्रोटीन के रिश्तेदार कोशिका की सतह अभिव्यक्ति के स्तर को निर्धारित करने के लिए, पुनः संयोजक संलयन प्रोटीन व्यक्त कोशिकाओं अभिकर्मक के बाद काटा गया, और FITC संयुग्मित माउस मोनोक्लोनल विरोधी हा मिलान टैग antibod के साथ दागवाई (चित्रा 2)। FITC एक कार्बनिक यौगिक है कि फ्लोरोसेंट एंजाइम संवाददाताओं की तुलना में काफी छोटे रूप में जैविक समारोह के साथ हस्तक्षेप करने की संभावना नहीं है और इसलिए है। mCherry- सीए वी α2δ1-हा-टीएसए 201cells में overexpressed, दो आयामी भूखंडों 22 पर FITC प्रतिदीप्ति और mCherry प्रतिदीप्ति में एक महत्वपूर्ण 3-लॉग वृद्धि पैदा करता है। कि हा मिलान प्रोटीन के बाह्य भाग में स्थित है को देखते हुए, FITC के लिए प्रतिदीप्ति तीव्रता बरकरार कोशिकाओं की उपस्थिति में प्राप्त हा टैग प्रोटीन की कोशिका की सतह अभिव्यक्ति के रिश्तेदार सूचकांक दर्शाते हैं। निर्माणों में हा मिलान की पहुंच व्यवस्थित सेल permeabilization के बाद FITC संकेत को मापने के द्वारा मान्य है। इस उपाय से भी सामान्यीकृत कुल प्रोटीन अभिव्यक्ति की पुष्टि करने के लिए कार्य करता है के बाद से FITC के लिए रिश्तेदार प्रतिदीप्ति तीव्रता permeabilized कोशिकाओं में अनुमानित गुणात्मक रिश्तेदार प्रतिदीप्ति मूल्यों के लिए करने के लिए तुलना कर रहे हैंआर mCherry permeabilized और गैर-permeabilized की स्थिति 22,23 के तहत मापा जाता है। यह ध्यान रखें कि आंतरिक प्रतिदीप्ति स्पेक्ट्रम permeabilization के बाद उच्च मूल्यों की ओर स्थानांतरित कर दिया है, लेकिन है कि केवल मूल्य सूचित किया जा रहा प्रतिदीप्ति तीव्रता में परिवर्तन नियंत्रण निर्माण की तुलना में महत्वपूर्ण है। परीक्षण निर्माणों के लिए प्रतिदीप्ति तीव्रता में रिश्तेदार परिवर्तन ΔMean प्रतिदीप्ति तीव्रता (ΔMFI) प्रत्येक fluorophore (mCherry या FITC) के लिए मूल्यों का उपयोग कर रहे हैं अनुमान। प्रयोगों fluorophore संयुग्मित एंटीबॉडी के आंतरिक प्रतिदीप्ति में प्रयोगात्मक रूपों को सीमित करने का नियंत्रण का निर्माण एक ही परिस्थितियों में व्यक्त की प्रतिदीप्ति तीव्रता के परीक्षण के निर्माण के रिश्तेदार की प्रतिदीप्ति तीव्रता को मापने के लिए तैयार कर रहे हैं। दो झिल्ली प्रोटीन सफलतापूर्वक इस परख का उपयोग कर अध्ययन किया गया: एल प्रकार वोल्टेज gated कैल्शियम चैनल सीए वी 1.2 14,22 की और एक अलग श्रृंखला में ताकना बनाने सबयूनिटप्रयोगों, बाह्य सहायक सीए वी α2δ1 सबयूनिट 22,23। निम्नलिखित प्रोटोकॉल नियंत्रण की शर्तों के तहत और आयन चैनल के posttranslational संशोधन को प्रभावित करने म्यूटेशन के बाद 1.2 चैनल हृदय एल प्रकार सीए वी के वी सीए α2δ1 सबयूनिट की कोशिका की सतह अभिव्यक्ति का निर्धारण करने के लिए इस्तेमाल किया गया था। मानकीकृत प्रयोगात्मक शर्तों के तहत, FITC की कोशिका की सतह प्रतिदीप्ति mCherry-सीए वी α2δ1 हा प्रोटीन (चित्रा 5 संदर्भ 22 से) के लिए कोडिंग सीडीएनए की अभिव्यक्ति के साथ बढ़ जाती है अर्ध रैखिक।
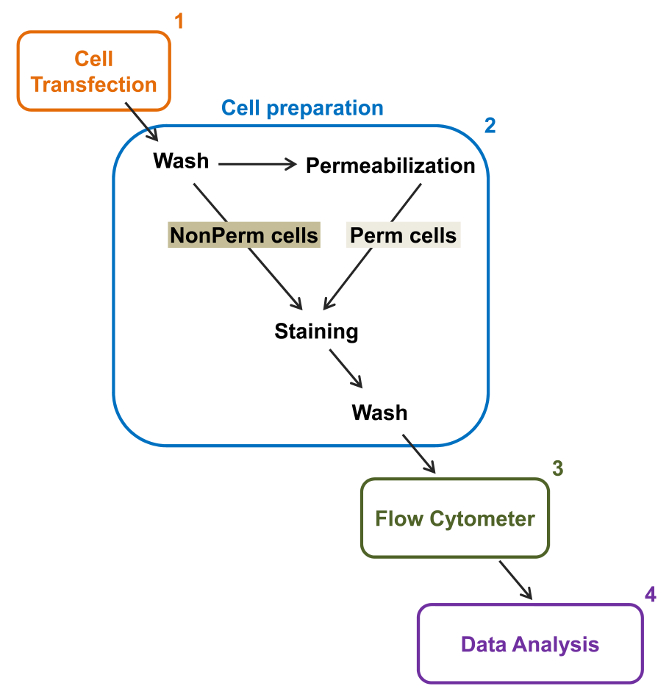
चित्रा 2:। प्रयोगात्मक प्रोटोकॉल प्रवाह cytometry में कुल और झिल्ली लेबलिंग की योजनाबद्ध प्रतिनिधित्व योजना आवश्यक मुख्य कदम से कुछ फ्लोरिडा द्वारा पुनः संयोजक आयन चैनल के सापेक्ष कुल और कोशिका की सतह अभिव्यक्ति यों की रूपरेखाओउ cytometry। प्रकोष्ठों टीएसए-201 कोशिकाओं (1) में डबल टैग निर्माण mCherry-सीए वी α2δ1 हा के साथ ट्रांसफ़ेक्ट और पहले या बाद permeabilization दाग रहे हैं (2)। Multiparameter डेटा एक प्रवाह में अर्जित कर रहे हैं कोशिकामापी (3) बहुभिन्नरूपी विश्लेषण के लिए (4)। यहाँ यह आंकड़ा का एक बड़ा संस्करण देखने के लिए क्लिक करें।
Protocol
Representative Results
Discussion
इस प्रवाह cytometry आधारित परख सफलतापूर्वक वोल्टेज gated कैल्शियम चैनल 14,22,26 के fluorescently लेबल ताकना बनाने और जुड़े सब यूनिटों के सापेक्ष कुल और कोशिका की सतह के स्तर की माप के लिए लागू किया गया था। यह सबसे अच्छा ह?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the “Fondation de l’Institut de Cardiologie de Montréal” to L.P.
Materials
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1,5 mL | Sarstedt | 72-690-001 | |
| Tubes 15 mL | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100-mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35-mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37°C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37°C water bath before use. |
| Trypsin-EDTA (1X) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 mL microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1X | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
References
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).

