Поколение флуоресцентных слитых белков в<em> Кандида</em> Виды
Summary
ПЦР-опосредованный модификация гена может быть использован для создания флуоресцентного белка слитые в видов Candida, что облегчает визуализацию и количественное определение дрожжевых клеток и белков. Здесь мы представляем стратегию построения флуоресцентного белка слияния (Eno1-FP) в Candida parapsilosis.
Abstract
Видов Candida, распространенных колонизаторами кишечника и мочеполового трактов, являются причиной большинства инвазивных грибковых инфекций у людей. Таким образом, молекулярные и генетические инструменты необходимы, чтобы облегчить изучение механизмов их патогенеза. ПЦР-опосредованный модификация гена является простой и быстрый подход к генерации эпитоп-меченных белков для облегчения их обнаружения. В частности, флуоресцентный белок (FP) расплавы являются мощными инструментами, которые позволяют визуализировать и количественно оценивать обоих дрожжевых клеток и белков с помощью флуоресцентной микроскопии и иммуноблотинга, соответственно. Плазмиды , содержащие кодирующие последовательности FP, наряду с питательными маркерные гены , которые облегчают превращение видов Candida, были получены с целью строительства FP и экспрессии в кандида. Здесь мы представляем стратегию построения фьюжн FP в видах Candida. Плазмиды, содержащие nourseothricin resistaсть гена трансформации маркера (NAT1) наряду с последовательностями либо зеленым, желтым или вишневого FPs (GFP, YFP, mCherry) используются наряду с использованием праймеров , которые включают в себя последовательность генов специфических в полимеразной цепной реакции (ПЦР) , чтобы создать кассету FP , Этот ген-специфический кассета имеет возможность интеграции в 3'-конце соответствующего локуса гена посредством гомологичной рекомбинации. Успешное в рамке считывания слияние последовательности FP в локус гена интереса проверяется генетически, с последующим анализом экспрессии слитого белка с помощью микроскопа и / или методов иммуно-обнаружения. Кроме того, для случая с высоким уровнем экспрессии белков, успешные слитые конструкции могут быть подвергнуты скринингу на в основном с помощью методов флуоресцентной томографии.
Introduction
Виды Candida являются синантропных грибы , которые колонизируют кишечника и мочеполового трактов всех людей. В условиях иммунодефицитом, таких как , которые происходят с преждевременными родами или иммуносупрессивные эффекты от лечения рака, виды Candida может стать условно – патогенные возбудители. Из видов Candida, Candida Albicans является наиболее распространенным грибковым колонизатор и вызывает большинство инвазивных грибковых инфекций. Другие виды Candida , такие как C. glabrata, C. parapsilosis, C. tropicalis и C. kruseii также вызывают серьезные инфекции у пациентов с ослабленным иммунитетом, с некоторым проявляющего внутреннее сопротивление к часто используемым противогрибковые антибиотики , такие как флуконазол и амфотерицин В. Следовательно, инфекции с некоторыми из этих видов наблюдаются чаще, особенно у пациентов, проходящих лечение профилактически с противогрибковыми средствами. Даже при надлежащей и своевременной аNTI-грибковое лечение, инвазивные инфекции Candida по- прежнему связаны со значительной заболеваемостью и смертностью 1. Из – за важности видов Candida в состоянии здоровья людей, существует потребность в легко доступных молекулярных инструментов , которые позволяют исследование и выяснение механизмов их патогенеза.
Одним из важных инструментов, который позволяет исследователям визуализировать и количественно микробных клеток и белков, которые они выражают это технология слияния FP. Полимеразная цепная реакция (ПЦР) -опосредованного модификацию гена, как описано в данной работе, позволяет строить слитых конструкций , между ПС последовательностей и белок Кандида интерес последовательность кодирования на его геномного локуса. Стабильной интеграции конструкции облегчает анализ экспрессии белка, а также динамику локализации белков. Плазмиды , содержащие FP последовательности, оптимизированные для экспрессии в Candida Albicans и которые могут быть использованы в ПЦР-опосредованный гСтратегия модификации ена, которые были ранее построены 2, 3, 4, 5. Плазмиды содержат FP трансформация "кассеты": последовательность FP , связанный с питательной маркерного гена , который облегчает преобразование C. Albicans и С. parapsilosis 2, 3, 4, 5, 6, 7. Существующие в настоящее время Плазмиды содержат множество выбираемых питательных генов – маркеров (URA3, HIS1, arg4) для трансформации ауксотрофных штаммов, а также доминирующий устойчивости к лекарственному средству маркер (NAT1), что облегчает преобразование клинических штаммов , не имеющих auxotrophies. Кроме того, плазмиды содержат варианты до четырех различных последовательностей FP (зеленый [GFP], YelloW [YFP], циан [КФП], и вишня [mCherry]) и либо последовательность терминации ADH1 для построения карбоксиконец слитых белков, или последовательность промотора для построения аминоконца слитых белков. Праймеры конструируют с гомологией к плазмидной ДНК, окружающей кассету FP. Кроме того, праймеры также содержат 5'-удлинительные последовательности , несущие гомологию с геном дрожжей , представляющие интерес для быть помеченным, что облегчает интеграцию кассеты в геномную локус посредством гомологичной рекомбинации (рисунок 1). Гено-специфические FP кассеты генерируются с помощью ПЦР , а затем трансформировали в клетки Candida , сделанные компетентными для поглощения ДНК путем обработки ацетатом лития.
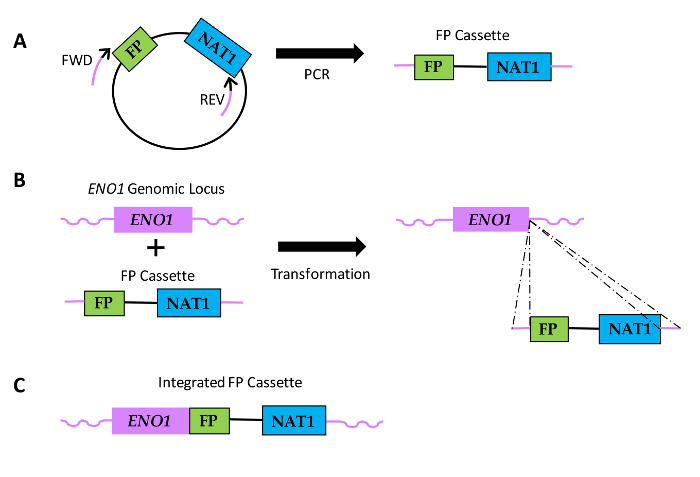
Рисунок 1: Схема , как слитые последовательности FP генерируются видов Candida. (А) плазмидной ДНК ВКЛЮЧАЕТэс последовательность FP и последовательности, кодирующей nourseothricin сопротивления (NAT1). Относительное расположение вперед (FWD) и обратном (REV) праймеров показаны с черными частями праймеров, обозначающих область гомологии с последовательностью плазмиды и фиолетовых участков, обозначающих геноспецифических область гомологии или удлинение праймера. (В) FP кассеты превращаются в Кандида и интегрировать в ENO1 геномного локуса посредством гомологичной рекомбинации (пунктирные линии). (C) результирующую последовательность слитого FP на 3'-ENO1. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Здесь мы приведем пример слитого белка (Eno1-FP) конструкций у видов Candida. Мы используем мечения плазмид , содержащих ген NAT1 преобразование маркера вместе с последовательностями , кодирующими GFP, YFP, илиmCherry (Рисунок 2). Эти плазмиды используются вместе с праймеров в ПЦР для генерации геноспецифических кассет , которые облегчают слияние РЗУ к 3'-концу ENO1, что приводит к экспрессии слитого с Eno1 FPs на его карбокси-конце.
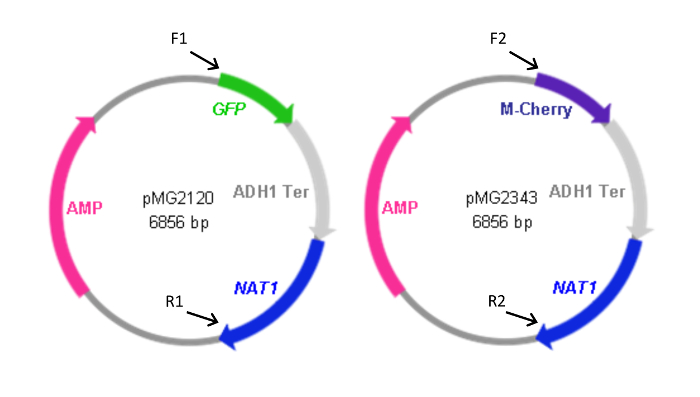
Рисунок 2: Карты FP кассет , содержащих плазмид. Вперед (F) и обратный праймеры (R), которые используются для создания кассеты из плазмид показаны вместе с относительным расположением их гомологии с плазмидами. Последовательности праймеров, которые перечислены в таблице 1. F1 и R1 были также использованы для создания кассеты pYFP- NAT1. Плазмида , содержащая кассету YFP- NAT1 (pMG2263) идентичен pMG2120 за исключением YFP вместо последовательности GFP. Размеры кассеты: GFP-NAT1, 3,7 KBP; mCherry- NAT1, 3,2 т.п.н.; YFP- NAT1, 3.7 т.п.н.. Эта цифра была изменена из герами-Нежада и др. 4 Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Protocol
Representative Results
Discussion
Конструирование эпитопа помечено последовательностей в видов Candida с использованием ПЦР-опосредованный стратегии генной модификации , описанной выше , может быть охарактеризован как трехступенчатый процесс. Во-первых, кассета выполнена с помощью ПЦР, который кодирует и последова…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим Н. Дина за предоставление исходной последовательности mCherry FP, М. герами-Неджад для построения плазмид, Б. Ларсон об оказании технической помощи, а также Т. Heisel за полезные советы в процессе разработки этого проекта. JB был поддержан Европейским Research Council Advanced Award 340087 (RAPLODAPT). Микроскопия и системы визуализации были предоставлены Университетом штата Миннесота Pediatrics Foundation и Университета Миннесоты Центра обработки изображений.
Materials
| 100W mercury lamp | CHIU Technical Corporation | M-100T | |
| 95% Ethanol | Any | NA | |
| Adenine | Any | NA | |
| Ampicillin | Any | NA | |
| Carrier DNA | Ambion | AM9680 | Sheared Salmon Sperm DNA 10 mg/ml |
| CCD Camera | Photometrics | CoolSNAP HQ | |
| Conical Tube | Corning | 430828 | 50ml |
| Culture Tube Rotator | New Brunswick | 2013923 | TC-8, or Any Culture Tube Rotator |
| Deoxynucleotides (dNTP) PCR Grade | Any | NA | |
| Eppendorf Tubes | Eppendorf | 022363719, 022363212 | 0.5ml, 1.5ml |
| Erlenmeyer Flask | Fisher Scientific | 7250089 | 125ml |
| Ethylenediaminetetraacetic Acid (EDTA) | Any | NA | |
| Freezer (-80 °C ) | Thermo Electron Corporation | ULT-1386-9-V | Revco Ultima II |
| GFP, YFP and Texas Red Filter Sets | Chroma Technology Corporation | 49002, 86004v2, 49008 | |
| Glass culture tubes | Fisher Scientific | 1496126 | 75mm |
| HRP goat anti-mouse antibody | Santa Cruz Biotechnology | SC-2005 | |
| HRP goat anti-rabbit antibody | Santa Cruz Biotechnology | SC-2301 | |
| Incubator (30 °C ) | Any | NA | |
| Lithium Acetate | Any | NA | |
| Lysogeny Broth (LB) Media | Any | NA | |
| Magnesium Chloride | Any | NA | |
| Microcentrifuge | Eppendorf | 5415 D | |
| Microscope | Nikon | E600 | Nikon Eclipse E600 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| Mouse anti-GFP antibody | Roche | 11814460001 | |
| Nourseothricin | Fisher Scientific | 50997939 | |
| PCR Thermocycler | Applied Biosystems | 9700 | GeneAmp PCR System |
| PCR tubes | BioExpress, GeneMate | T-3035-1 | 0.2ml |
| Polyethylene Glycol 3350 | Any | NA | |
| Potassium Chloride | Any | NA | |
| Rabbit anti-mCherry antibody | BioVision | 5993-100 | |
| Refrigerator (4°C) | Any | NA | |
| Sodium Acetate | Any | NA | |
| Stereomicroscope | Nikon | SMZ1500 | |
| Table Top Centrifuge | Labnet | Z 400 | Hermle Z 400 |
| Taq DNA Polymerase | Any | NA | |
| Tris(hydroxymethyl)aminomethane (Tris) | Any | NA | |
| Vortex Mixer | Scientific Industries | SI-0236 | Vortex Genie 2 |
| Yeast Extract Peptone Dextrose (YPD) Media | Any | NA |
References
- Bendel, C. M. Colonization and epithelial adhesion in the pathogenesis of neonatal candidiasis. Semin. Perinatol. 27 (5), 357-364 (2003).
- Gerami-Nejad, M., Berman, J., Gale, C. A. Cassettes for PCR-mediated construction of green, yellow, and cyan fluorescent protein fusions in Candida albicans. Yeast. 18 (9), 859-864 (2001).
- Gerami-Nejad, M., Dulmage, K., Berman, J. Additional cassettes for epitope and fluorescent fusion proteins in Candida albicans. Yeast. 26 (7), 399-406 (2009).
- Gerami-Nejad, M., Forche, A., McClellan, M., Berman, J. Analysis of protein function in clinical C. albicans isolates. Yeast. 29 (8), 303-309 (2012).
- Gerami-Nejad, M., Hausauer, D., McClellan, M., Berman, J., Gale, C. Cassettes for the PCR-mediated construction of regulatable alleles in Candida albicans. Yeast. 21 (5), 429-436 (2004).
- Gonia, S., Larson, B., Gale, C. A. PCR-mediated gene modification strategy for construction of fluorescent protein fusions in Candida parapsilosis. Yeast. 33 (2), 63-69 (2016).
- Milne, S. W., Cheetham, J., Lloyd, D., Aves, S., Bates, S. Cassettes for PCR- mediated gene tagging in Candida albicans utilizing nourseothricin resistance. Yeast. 28 (12), 833-841 (2011).
- Ausubel, F. M., et al. . Current Protocols in Molecular Biology. , (1995).
- Wilson, R. B., Davis, D., Mitchell, A. P. Rapid hypothesis testing with Candida albicans through gene disruption with short homology regions. J. Bacteriol. 181 (6), 1868-1874 (1999).
- Pulver, R., et al. Rsr1 focuses Cdc42 activity at hyphal tips and promotes maintenance of hyphal development in Candida albicans. Eukaryotic Cell. 12 (4), 482-495 (2013).
- Falgier, C., et al. Candida species differ in their interactions with immature human gastrointestinal epithelial cells. Pediatr. Res. 69 (5), 384-389 (2011).
- Nosek, J., et al. Genetic manipulation of the pathogenic yeast Candida parapsilosis. Curr. Genet. 42 (1), 27-35 (2002).
- Zemanova, J., Nosek, J., Tomaska, L. High-efficiency transformation of the pathogenic yeast Candida parapsilosis. Curr. Genet. 45 (3), 183-186 (2004).
- Benjamin, D. K., et al. Neonatal candidiasis among extremely low birth weight infants: risk factors, mortality rates, and neurodevelopmental outcomes at 18 to 22 months. Pediatrics. 117 (1), 84-92 (2006).
- Kullberg, B. J., Arendrup, M. C. Invasive Candidiasis. N Engl J Med. 373 (15), 1445-1456 (2015).

