QNsim 1.0'u Kullanarak Elektromanyetik Uyarılmış Dopamin Nörotransmisyon Verisinden Hızlı Tarama Çevrimsel Voltametri Veri Modellenmesi
Summary
Hızlı tarama çevrimsel voltametri, ilaçlar, hastalıklar ve diğer deneysel manipülasyonlar bağlamında in vivo dopamin nörotransmisyonunu izleyebilir. Bu çalışma, dopamin salınımı ve yeniden alım dinamiklerinin tahminlerini nicel nörobiyolojik modele göre nicel modele göre elektrikle uyarılan dopamin tepkilerini modellenebilen QNsim1.0 yazılımının uygulanmasını açıklamaktadır.
Abstract
Merkezi dopaminerjik (DAergik) yolaklar dikkat, motivasyon ve hareket gibi geniş bir işlev yelpazesinde önemli bir role sahiptir. Dopamin (DA), dikkat eksikliği hiperaktivite bozukluğu, Parkinson hastalığı ve travmatik beyin hasarı dahil hastalıklar ve rahatsızlıklarda rol oynar. Böylece, DA sinir iletimi ve onu inceleme yöntemleri bilimsel açıdan yoğun ilgi görür. In vivo hızlı tarama çevrimsel voltametresi (FSCV), ince zamansal ve mekansal çözünürlük ile DA konsantrasyon değişikliklerini seçici olarak izlemenize izin veren bir yöntemdir. Bu teknik, yaygın olarak, dopamin nörotransmisyonunun impuls akışını kontrol etmek için artan DAergik yolların elektriksel uyarımı ile birlikte kullanılır. Uyarılmış DA nörotransmisyon paradigması, berrak morfolojileri ile sağlam DA cevapları üretebilir, ancak bunları kinetik analiz için uygun hale getirirken, yanıtlarını DA yayımı ve clearan açısından yorumlamaya ilişkin çok tartışmalar devam etmektedirCe bileşenleri. Bu endişeyi ortadan kaldırmak için uyarılmış DA cevabının kantitatif nörobiyolojik (QN) bir çerçeve geliştirilmiş ve DA salınımının dinamikleri gerçekte modellenmiştir ve uyarılmış bir DA tepkisi boyunca yeniden toplanmaya başlamıştır. Bu modelin temelleri uyarılmış DA nörotransmisyonundan ve çeşitli araştırmalar dizilerinden alınan sinir iletimi prensiplerine dayanan deneysel verilere dayanmaktadır. QN modeli uyarılan DA serbest bırakma ve modele DA yanıtlarını geri alma dinamikleri ile ilgili 12 parametre uygular. Bu çalışma, QNsim1.0'ı kullanarak DA cevaplarını simüle etmeyi ve uyarılan dopaminin salınımında ve yeniden alım dinamiklerindeki değişiklikleri sistematik olarak ayırt etmek için uygulanan ilkeleri ayrıntılarıyla açıklamaktadır.
Introduction
Dopamin (DA) nörotransmisyonu çeşitli bilişsel ve davranışsal işlevlerde önemli rol oynar ve işlev bozukluğu birkaç yaygın hastalık ve bozuklukla ilişkilendirilir. Bu nedenle DA nörotransmisyonunun hastalık modelleri ve ilaç farmakolojisi bağlamında nasıl değiştirildiğini değerlendirmek için in vivo olarak DA nörotransmisyonunu nicel olarak incelemek için doğru yöntemler geliştirmek önemlidir. Hızlı tarama çevrimsel voltametri (FSCV), in vivo DA nörotransmisyonunun ince uzaysal ve zamansal çözünürlüğü ile izlenmesini sağlar. Uyuşturulmuş, serbestçe hayvanlara davranan fizyolojik DA nörotransmisyonunu izlemek mümkün olmakla birlikte, anestezi altındaki hayvanlarda artan dopaminerjik yolaklarının elektriksel uyarımı, DA nörotransmisyonunun kinetik analizinin kuvvetli olduğu güçlü DA yanıtları üretebilir.
Elektrikle uyarılan DA cevapları, DA salımının ve yeniden alımının dinamik bir etkileşimini yansıtır ve yorumlarBu cevapların çoğunluğu, Michaelis-Menten (MM) modeli 12 olarak adlandırılan uyarılan DA nörotransmisyonunun basit bir modelini ağırlıklı olarak kullanmıştır. MM modeli, Eşitlik 1 tarafından tanımlandığı gibi, sabit DA salınım hızı ve sabit yeniden alım etkinliği ( yani, DA geri alım oranı ve hücre dışı DA konsantrasyonları arasındaki ilişki) açısından DA yanıtlarını tanımlamak için 3 değişkenten oluşur: 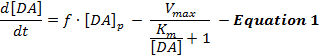
(DA serbest bırakma) (DA yeniden alım)
Denklem 1'de f , stimülasyon frekansıdır; [DA] p , stimülasyon nabzı başına tahmini DA konsantrasyonunun artmasıdır; V max tahmini maksimum geri alım oranını temsil eder; Ve K m , teorik olarak DAT'nin% 50'sini doymuş hücre dışı DA konsantrasyonuna eşdeğer olan, MM'li sabittir, bu da yarı maksimal geri alım oranına neden olur. Bu farklılıkAl eşitliği, [DA] p , V max ve K m parametrelerini tahmin ederek deneysel DA yanıtlarını simüle etmek için bütünleştirilebilir.
Her ne kadar MM modeli çeşitli deneysel bağlamlarda DA nörotransmisyon kinetiğinin anlaşılmasında önemli gelişmeler sağlamış olsa da, MM modeli, suprafizyolojik uyarılar 2 , 13 tarafından ortaya çıkarılan DA yanıtlarını modellediğinde uygulanabilirliğini sınırlayan basit temel varsayımlar yapmaktadır. Örneğin MM modeli, dışbükey bir şekilde yükselirlerse DA yanıt şekillerine yaklaşabilir, ancak dorsal çizgi bölgelerinde bulunan kademeli (konkav) yükselen tepkileri hesaba katamaz 12 . Dolayısıyla, MM modeli varsayımları uyarılan DA nörotransmisyonunun dinamik salınımını ve yeniden alım süreçlerini doğru bir şekilde yakalar.
Uyarılmış DA tepkilerini gerçekçi bir nicelikte modellemek içinNicel nörobiyolojik (QN) çerçeve, tamamlayıcı araştırma ve deneyden türetilmiş uyarılmış nörotransmisyon kinetiği esaslarına dayanılarak geliştirildi. Çeşitli sinir iletim hatları, uyarılmış nörotransmiter salınımının uyarı periyodu boyunca hız düşen dinamik bir süreç olduğunu, (2) bifazik çürüme kinetiği ile uyarı sonrası fazda serbest bırakılmaya devam ettiğini ve (3) DA Stimülasyonun kendisi 2 , 16 süresince tekrar alım etkinliği tedricen engellenir. Bu üç kavram QN çerçevesinin temelini oluşturur ve üç eşitlik, DA serbest bırakma ve yeniden alım dinamikleri tanımlayan 12 parametreden oluşur ( Tablo 1 ). QN çerçevesi, heterojen deneysel DA tepki türlerini ve pUyarıcı parametrelerin ve ilaç uygulamasının deneysel manipülasyonlarının redisyon etkileri 2 , 6 . Veri modelleme yaklaşımını iyileştirmek için daha fazla araştırmaya ihtiyaç duyulsa da, gelecek deneyler, uyarılmış DA neurotransmission paradigmasından elde edilen çıkarsamalara önemli ölçüde katkıda bulunan bu nörobiyolojik temelli modelleme yaklaşımından büyük fayda sağlayabilir.

Tablo 1: Denklemlerin ve Parametrelerin Modellenmesi . Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Bu ders, uyarılmış DA yanıt verilerini, QNsim 1.0'ı kullanarak DA serbest bırakma ve geri alım kinetiklerini tahmin etmek için nasıl modifiye edileceğini açıklamaktadır. Gerçek deneysel veri toplama ve prİşleme burada açıklanmaz ve yalnızca zamansal DA konsantrasyon verisini gerektirir. Kuramsal destek ve QN çerçevesinin temelleri daha önce 2 kapsamlı olarak açıklanmıştır, ancak Q cevaplama modelinin uygulanması için QN çerçevesinin uygulanmasına ilişkin pratik bir bakış açısı aşağıda açıklanmaktadır.
QN çerçevesi, 1) dinamik DA salınımı, 2) DA geri toplanması ve 3) supresimyolojik uyarıların bu süreçler üzerindeki etkilerini, DA cevap verilerinden anlamlı kinetik bilgi çıkarmak için arasındaki etkileşimleri modellemektedir. QN çerçevesi, kinetik analiz için uygun olan sağlam DA yanıtları üreten uzun sürede ( örneğin, 60 Hz, 10 sn uyarılar) son derece suprafizyolojik uyarılarla elde edilen FSCV verilerinin modellenmesi için en uygunudur. Temel serbest bırakma ve yeniden alım süreçlerinin doğru modellenmesini takiben, model parametreleri, eski durumun yaklaşıkına uyması gereken bir DA tepkisini simüle etmek için kullanılabilirÇevresel DA cevabı.
QN çerçevesinin denklemleri, uyarılan DA yanıtları boyunca DA salım oranlarını ve yeniden alım oranlarını tanımlamaktadır. QN çerçevesi uyarılmış DA salınım oranını uyarma başlangıcından itibaren (t stim) zamanın bir fonksiyonu olarak, DA salınım hızı uyarı periyodu boyunca katlanarak düştüğü zaman tarif eder. Bu, vezikül yenilemesi için diğer raporlara ( Denklem 2 ) benzer şekilde, sabit bir durum DA salınım oranına (DARss) sahip, kolaylıkla serbest bırakılabilir bir havuzun tükenmesi ile tutarlıdır 14,17.
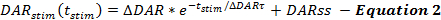
Δ DAR, Δ DAR τ veya DARss'ı arttırmak gibi DA salınım oranını artıran işlemler, zaman aralıklarına karşı DA'da artmış tepki amplitütlerine yol açar. Her parameTer, DA yanıt şekillerine farklı şekilde katkıda bulunur. DARss ve Δ DAR τ ' nın her ikisi de yanıtların yükselen fazını daha doğrusal yapar (daha az konveks). Δ DAR τ'nın azaltılması, Δ DAR'nın büyüklüğü tarafından kontrol edilen dışbükeyliği arttırır. Modelleme deneyimine dayanarak, DARss genel olarak Δ DAR'ın 1 / 5'inden az; Dolayısıyla, Δ DAR, DA yanıtının genel yanıt amplitüdünü öncelikli olarak belirleyen salınma parametresidir.
Uyarımdan sonra DA serbest bırakma oranı, Denklem 3 ile stimülasyondan sonra (DAR ES ) uyarılan DA serbest bırakma oranının uyarılma sonrası zamanın bir fonksiyonu olarak (t post ) bir devamı olarak modellenmiştir. Uyarım sonrası DA serbest bırakma hızı, daha önce tarif edildiği gibi 15 derece hızlı bir üstel bozunma fazı ve iki ca modellenmek için uzunlamasına doğrusal çürüme fazı ile bifazik bir bozunma paternini izlerKalsiyum bağımlı nörotransmitter salınım işlemleri.
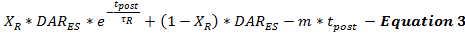
(Hızlı üstel bozunma) (Uzun süreli doğrusal bozunma)
Uyarı sonrası DA salınımının ne kadar gerçekleştiğini belirlemek şu anda mümkün değildir. Bu kısıtlama, uyarılma sonrası DA serbest bırakma tahminlerini sistematik olarak en aza indirgeyerek ve aynı kayıt alanından farklı uyarılma süreleri kullanılarak toplanan deneysel DA yanıtları seti boyunca model parametrelerini doğrulayarak ele alınabilir. Bu küçültme, kullanıcıların serbest bırakma ve yeniden alımın muhafazakar tahminlerini yapmalarını sağlar. Elektriksel uyarılar, uyarılmadan sonra nörotransmiter salınımını sağlayan kalsiyum birikimine neden olduğundan, uyarılmanın süresi uyarılma sonrası nörotransları etkilerMitter serbest bırakma parametreleri 18 , 19 . Modelleme deneyimine dayanarak, stimülasyon süresi arttıkça, τ R artar ve X R , daha büyük bir kalsiyum birikiminin beklenen etkileri ile tutarlı bir şekilde azaldığı 20 bulundu .
Eşitlik 4 , MM çerçevesinin bir uzantısı olarak DA geri alım oranını açıklar ve supraphysiological uyaranlara 2 , 16 neden olan kademeli olarak azalan bir yeniden alım etkinliğini modellemek için uyarılma esnasında artan dinamik bir K m terimini içerir. Uyarımdan sonraki K m , stimülasyonun sonunda K m değerinde sabit tutulur (K mES).
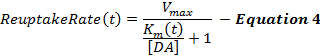
nerede,
<img alt = "Eşitlik 6" src = "/ files / ftp_upload / 55595 / 55595eq6.jpg" />
(Uyarım sırasında) (Uyarılmadan sonra)
Uyarılmış DA yanıtları, özellikle de ventral striatal bölgelerden, başlangıçtaki K m değerindeki (K mi ) değişikliklere genellikle duyarsızdır ve bu da bir K mi değerinin problemli olmasını sağlar. Böylece, orijinal MM çerçevesi gibi, Kmi kontrol edilmemiş hayvanlardan 12 toplanan DA cevapları için 0.1-0.4 μM olarak belirlenmiştir. Δ K m terimi, tecrübelerimizden dolayı yaklaşık 20 olan stimülasyon sırasında geri alım verimliliği değişiminin kapsamını belirler81; M, 60 Hz, 10 sn'lik bir uyarım boyunca. K ve K minf değerleri, Km'nin zamanla nasıl değiştiğini belirler ve bu terimlerin herhangi birini arttırmak, yükselen fazın konkavitesini arttırır. V max , kısmen, dorsolateral gradient 21 için ventromedial gösteren, yerel DA taşıyıcı yoğunluğuyla ilişkilendirilen maksimum geri alım hızıdır. Buna göre, dorsal striatumdaki (D-Str) Vmaks değerleri, genel olarak, akumbens çekirdeği (NAc) 6 gibi, ventral bölgede 30 μ M / s'den daha büyük, ancak genellikle 30 μM / s'den daha düşüktür.
Yukarıdaki genel yönergeler, deneysel DA yanıt verilerini modellemeye yardımcı olabilir, ancak deneysel DA tepkisine yaklaşık bir simülasyon üretmek, model parametrelerini iteratif olarak ayarlamayı gerektirir. Model parametrelerinin doğruluğu, sağlanan suprafizyolojik uyaranlara DA yanıtları elde ederek iyileştirilebilirAynı kayıt sahasında ( örneğin, 60 Hz, 5 s ve 10 sn'lik uyaranlar) farklı sürelerde uyarılara parametre doğruluğunu doğrulamak için birden fazla DA yanıtını elde etme ve modelleme yoluyla simüle etmek için güçlü bir substrat Örnek verilere bakın). Gösterilmesi için, QN çerçevesi kullanılarak halihazırda modellenen farmakolojik bir mücadeleye başlamadan önce ve sonra, akumbens çekirdeği ve dorsal striatumda toplanan, regiospesifik uyarılmış DA yanıtlarını içeren bir yazılım seti içeren bir veri kümesi bulunur. Kullanıcılar, bu metodolojinin, çeşitli hastalık bağlamlarında ve farmakolojik manipülasyonlarda DA nörotransmisyonunun kineticsini karakterize etmek için benzer şekilde uygulanabileceğini bulacaklardır.
Protocol
Representative Results
Discussion
İn vivo uyarılmış DA nörotransmisyonunu incelemek için FSCV'nin kullanımı, 1980'li yıllarda ortaya çıkmış ve yine benzersiz mekansal ve zamansal çözünürlük ile in vivo nörotransmisyon verilerinin zengin bir kaynağı olmaya devam etmektedir. Uyarılmış DA yanıtları, elektriksel uyarılarla kendiliğinden modüle edilen DA salınımı ve geri alımının karmaşık bir dengesini yansıtmaktadır. QN modeli, dinamik salınım ve yeniden alım varsayımları açısından <em…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışmayı desteklemek için UPMC Rehabilitasyon Enstitüsünü kabul ediyoruz.
Materials
| MATLAB R2016a for Mac | Mathworks | ||
| QNsim1.0 | In house software package | Software to model FSCV data using the QN framework |
References
- Taylor, I. M., et al. Kinetic diversity of dopamine transmission in the dorsal striatum. J Neurochem. 133 (4), 522-531 (2015).
- Harun, R., Grassi, C. M., Munoz, M. J., Torres, G. E., Wagner, A. K. Neurobiological model of stimulated dopamine neurotransmission to interpret fast-scan cyclic voltammetry data. Brain Res. 1599, 67-84 (2015).
- Taylor, I. M., Jaquins-Gerstl, A., Sesack, S. R., Michael, A. C. Domain-dependent effects of DAT inhibition in the rat dorsal striatum. Journal of neurochemistry. 122 (2), 283-294 (2012).
- Garris, P. A., Ciolkowski, E. L., Wightman, R. M. Heterogeneity of evoked dopamine overflow within the striatal and striatoamygdaloid regions. 신경과학. 59 (2), 417-427 (1994).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain Res. 487 (2), 311-320 (1989).
- Harun, R., et al. Fast-scan cyclic voltammetry demonstrates that L-DOPA produces dose-dependent regionally selective, bimodal effects on striatal dopamine kinetics in vivo. J Neurochem. , (2015).
- Jones, S. R., Garris, P. A., Wightman, R. M. Different effects of cocaine and nomifensine on dopamine uptake in the caudate-putamen and nucleus accumbens. The Journal of pharmacology and experimental therapeutics. 274 (1), 396-403 (1995).
- Budygin, E. A., John, C. E., Mateo, Y., Jones, S. R. Lack of cocaine effect on dopamine clearance in the core and shell of the nucleus accumbens of dopamine transporter knock-out mice. J Neurosci. 22 (10), RC222 (2002).
- Jones, S. R., et al. Loss of autoreceptor functions in mice lacking the dopamine transporter. Nat Neurosci. 2 (7), 649-655 (1999).
- Wagner, A. K., et al. Chronic methylphenidate treatment enhances striatal dopamine neurotransmission after experimental traumatic brain injury. J Neurochem. 108 (4), 986-997 (2009).
- Wagner, A. K., et al. Controlled cortical impact injury influences methylphenidate-induced changes in striatal dopamine neurotransmission. J Neurochem. 110 (3), 801-810 (2009).
- Wightman, R. M., et al. Real-time characterization of dopamine overflow and uptake in the rat striatum. 신경과학. 25 (2), 513-523 (1988).
- Moquin, K. F., Michael, A. C. Tonic autoinhibition contributes to the heterogeneity of evoked dopamine release in the rat striatum. J Neurochem. 110 (5), 1491-1501 (2009).
- Pyott, S. J., Rosenmund, C. The effects of temperature on vesicular supply and release in autaptic cultures of rat and mouse hippocampal neurons. J Physiol. 539 (Pt 2), 523-535 (2002).
- Atluri, P. P., Regehr, W. G. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci. 18 (20), 8214-8227 (1998).
- Wang, S. R., et al. Role of vesicle pools in action potential pattern-dependent dopamine overflow in rat striatum in vivo. J Neurochem. 119 (2), 342-353 (2011).
- Taschenberger, H., von Gersdorff, H. Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. J Neurosci. 20 (24), 9162-9173 (2000).
- Goda, Y., Stevens, C. F. Two components of transmitter release at a central synapse. Proc Nat Acad of Sci U S A. 91 (26), 12942-12946 (1994).
- Yao, J., Gaffaney, J. D., Kwon, S. E., Chapman, E. R. Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell. 147 (3), 666-677 (2011).
- Hagler, D. J., Goda, Y. Properties of synchronous and asynchronous release during pulse train depression in cultured hippocampal neurons. J Neurophysiol. 85 (6), 2324-2334 (2001).
- Ciliax, B. J., et al. The dopamine transporter: immunochemical characterization and localization in brain. J Neurosci. 15 (3 Pt 1), 1714-1723 (1995).
- Volz, T. J., Farnsworth, S. J., Rowley, S. D., Hanson, G. R., Fleckenstein, A. E. Methylphenidate-induced increases in vesicular dopamine sequestration and dopamine release in the striatum: the role of muscarinic and dopamine D2 receptors. J Pharm Exp Ther. 327 (1), 161-167 (2008).
- Dresel, S. H., Kung, M. P., Plossl, K., Meegalla, S. K., Kung, H. F. Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats. Eur J Nucl Med. 25 (1), 31-39 (1998).
- Near, J. A., Bigelow, J. C., Wightman, R. M. Comparison of uptake of dopamine in rat striatal chopped tissue and synaptosomes. J Pharm Exp Ther. 245 (3), 921-927 (1988).
- Michael, A. C., Ikeda, M., Justice, J. B. Dynamics of the recovery of releasable dopamine following electrical stimulation of the medial forebrain bundle. Neurosci Lett. 76 (1), 81-86 (1987).
- Fierro, L., DiPolo, R., Llano, I. Intracellular calcium clearance in Purkinje cell somata from rat cerebellar slices. The Journal of physiology. 510 (Pt 2), 499-512 (1998).
- Sandoval, V., Riddle, E. L., Hanson, G. R., Fleckenstein, A. E. Methylphenidate redistributes vesicular monoamine transporter-2: role of dopamine receptors. J Neurosci. 22 (19), 8705-8710 (2002).
- Daws, L. C., et al. Cocaine increases dopamine uptake and cell surface expression of dopamine transporters. Biochem Biophys Res Commun. 290 (5), 1545-1550 (2002).
- Little, K. Y., Kirkman, J. A., Carroll, F. I., Clark, T. B., Duncan, G. E. Cocaine use increases [3H]WIN 35428 binding sites in human striatum. Brain Res. 628 (1-2), 17-25 (1993).
- Ewing, A. G., Bigelow, J. C., Wightman, R. M. Direct in vivo monitoring of dopamine released from two striatal compartments in the rat. Science. 221 (4606), 169-171 (1983).
- Janezic, S., et al. Deficits in dopaminergic transmission precede neuron loss and dysfunction in a new Parkinson model. Proc Natl Acad Sci U S A. 110 (42), E4016-E4025 (2013).
- Macdonald, P. A., Monchi, O. Differential effects of dopaminergic therapies on dorsal and ventral striatum in Parkinson’s disease: implications for cognitive function. Parkinsons Dis. 2011, 572743 (2011).
- Kile, B. M., et al. Optimizing the Temporal Resolution of Fast-Scan Cyclic Voltammetry. ACS Chem Neurosci. 3 (4), 285-292 (2012).
- Venton, B. J., Troyer, K. P., Wightman, R. M. Response times of carbon fiber microelectrodes to dynamic changes in catecholamine concentration. Anal Chem. 74 (3), 539-546 (2002).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain research. 487 (2), 311-320 (1989).
- Wu, Q., Reith, M. E., Wightman, R. M., Kawagoe, K. T., Garris, P. A. Determination of release and uptake parameters from electrically evoked dopamine dynamics measured by real-time voltammetry. J Neurosci Methods. 112 (2), 119-133 (2001).

