脳の細胞外空間の体積分率とねじれを定量するためのテトラメチルアンモニウムによるリアルタイムイオントフォレシス
Summary
このプロトコールは、生体内の脳の細胞外空間(ECS)の物理的パラメータを測定する方法であるリアルタイムイオントフォレシスを説明しています。 ECSに放出された不活性分子の拡散を用いて、ECSの体積分率および蛇行度を計算する。これは、脳のECSへの急性の可逆変化を研究するのに理想的です。
Abstract
このレビューでは、生きた脳の細胞外空間(ECS)を探索および定量するための金標準である、リアルタイムイオントフォレーゼ(RTI)法を実行するための基本概念およびプロトコルについて説明しています。 ECSはすべての脳細胞を囲み、間質液と細胞外マトリックスの両方を含む。神経伝達物質、ホルモンおよび栄養素を含む脳活動に必要な多くの物質の輸送は、ECSを通る拡散によって起こる。この空間の容積および形状の変化は、睡眠のような正常な脳プロセスおよび虚血のような病理学的状態の間に生じる。しかしながら、特に罹患した状態での脳ECSの構造および調節は、未だに未解明のままである。 RTI法は、生きた脳の2つの物理的パラメーター、すなわち体積分率および蛇行を測定する。体積分率は、ECSが占める組織体積の割合である。屈曲は、脳に拡散して物質が遭遇する相対的障害の尺度である妨害のない媒体と比較して、 RTIでは、不活性分子が供給源の微小電極から脳ECSにパルスされる。分子がこの供給源から拡散するにつれて、イオンの変化する濃度は、約100μm離れて配置されたイオン選択性微小電極を用いて経時的に測定される。得られた拡散曲線から、体積分率と曲がり率の両方を計算することができる。この技術は、複数の種(ヒトを含む)およびインビボの脳切片において、ECSに対する急性および慢性の変化を研究するために使用されている。 RTIは、他の方法とは異なり、リアルタイムで脳ECSの可逆的および不可逆的変化の両方を調べるために使用することができる。
Introduction
細胞外空間(ECS)は、すべての脳細胞の外部にある相互接続されたチャネルのネットワークであり、間質液および細胞外マトリックスの両方を含む( 図1aおよび図1b )。栄養素、ホルモン、神経伝達物質を含む脳細胞機能に必要な多くの物質の分布は、ECSを通じた拡散によって起こります。体積、形状、および細胞外マトリックスを含む、この空間の物理的パラメータの変化は、急激ECSおよび脳細胞機能1、2に重大な影響を与える脳細胞を浸す局所イオン濃度、を通して拡散に影響を与えることができます。
、体積分率及びねじれ3、4:リアルタイムイオントフォレーシス(RTI)は、脳の領域の2つの構造的特徴を決定するために使用されます"xref"> 5。体積分率( α )は、代表的な基本体積における全組織体積( V 組織 )に対するECS( V ECS )が占める組織体積の割合である。
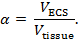
屈曲( λ )は、物質が障害のない媒体と比較して脳領域を通って拡散するときに遭遇する相対的障害である。
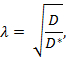
ここで、 D * (cm 2 s -1 )は脳内の物質の有効拡散係数であり、 D (cm 2 s -1 )は希薄アガロースゲルなどの遊離媒質中の物質の自由拡散係数である。
現在、Rに最も一般的に使用されるプローブ物質TI法は、小さなカチオンのテトラメチルアンモニウム(TMA)である。 TMAは74g / molの分子量を有し、溶液中で完全に解離し、1つの正電荷を有する。このイオンによるRTIの研究は、 α 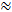 0.2とλ
0.2とλ 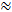 1.6 1、2。これは、ECSが総脳容積のおよそ20%であり、小さな不活性分子の拡散が、障害物のない媒体と比較してECSにおいて約2.5倍遅くなることを意味する3 。しかし、 αとλの両方は、脳の年齢、地域、状態、および病的状態によって変化する1 。これらのパラメータの変更は、脳の発達、老化、睡眠、てんかん、および脳の多くの他の基本的なプロセスおよび疾患に関連している1、 6 。他の技術はαおよびλを測定するが、RTIはリアルタイムで生体組織の局所化された領域で両方を測定することができる。このため、RTIは、急性および可逆性挑戦中のαおよびλの変化を調査するために不可欠なツールとなっている。
1.6 1、2。これは、ECSが総脳容積のおよそ20%であり、小さな不活性分子の拡散が、障害物のない媒体と比較してECSにおいて約2.5倍遅くなることを意味する3 。しかし、 αとλの両方は、脳の年齢、地域、状態、および病的状態によって変化する1 。これらのパラメータの変更は、脳の発達、老化、睡眠、てんかん、および脳の多くの他の基本的なプロセスおよび疾患に関連している1、 6 。他の技術はαおよびλを測定するが、RTIはリアルタイムで生体組織の局所化された領域で両方を測定することができる。このため、RTIは、急性および可逆性挑戦中のαおよびλの変化を調査するために不可欠なツールとなっている。
RTIを支持する理論は、もともとニコルソンとフィリップスによって検証し、及び技術は、その時4,7ため広く使用されてきました。 RTIを用いた実験は、希薄アガロースゲル中へのイオン導入法によって、源微小電極からTMAのパルスを放出することから始まる。いったん放出されると、イオンは、潜在的に無数のランダムな経路から選択して、点源から自由に拡散する( 図1d )。イオンの変化する濃度は、大まかに位置付けられたイオン選択性微小電極(ISM)を用いて経時的に測定される100μm離れている( 図1c )。 TMA濃度の変化をグラフ化し、イオントフォレーシス微小電極(プロトコルで議論されたパラメータ)のDおよび輸送数の両方の計算を可能にする曲線に適合させる。これらの値を用いて、脳の関心領域で手順を繰り返してD *を求め、 αとλの両方を計算する。イオントフォレーシス微小電極の制御、データ収集、TMA濃度曲線のグラフ化およびフィッティング、および実験パラメータの計算はすべて、典型的にはこの目的のために特別に設計されたプログラムWandaおよびWalterによって行われる(ソフトウェアおよびそのマニュアルは要求に応じて著者から自由に入手可能)。
このレビューの議定書のセクションでは、げっ歯類の脳スライスをRTIで設計および実施するために必要な基本的な手順について説明しています。この技術はまた、非ロッドヒト脳切片を含むとインビボ脳調製物1、4、6、8、9 で ENTモデル、。代表結果セクションでは、データ解釈のニュアンスを強調する理想的な結果と理想的でない結果の両方を提供します。最後に、ディスカッション・セクションでは、トラブルシューティング手法、RTIの制限事項、ECSの研究に使用される代替技術、およびRTIの今後のアプリケーションについて簡単に説明します。
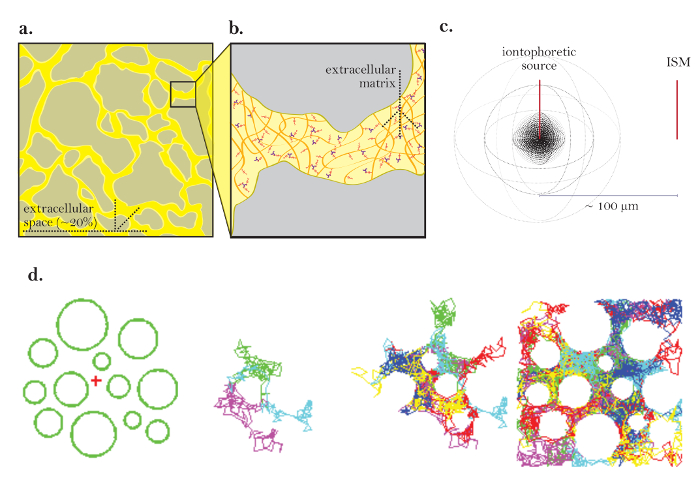
図1:ECSによる拡散の図。 ( a )ECSの図:典型的な脳切片におけるECSの大きさと位置を示す。黄色は、灰色の脳細胞プロセス間のECSをマークする。 ECSの体積は、全組織体積の約20%である( すなわち、体積率= 0)。2)。 ( b )ECSの拡大図:脳細胞の形状(灰色)および細胞外マトリックス(多糖グリコサミノグリカンおよびプロテオグリカンのメッシュとして図示)を含む、蛇行に寄与する物理的パラメータを強調する。 ( c )点源からの拡散の3D図:イオントフォレシス源からISMへの不活性分子の正味の移動を示す。拡散障壁および細胞摂取を除いて、分子はあらゆる方向に外側に拡散し、球状の濃度の前面を生成する。 ISMは、イオントフォレシス源から放出された不活性分子の局所濃度を定量化する。 ( d )脳のECSにおける拡散のコンピュータシミュレーション:[Far left]モンテカルロシミュレーションのセットアップ;緑色の球体は脳細胞プロセスを表し、赤色の十字形は点源を表す。このセットアップは、 図1aに示す脳組織をモデリングします 。 [中間画像] 3と6分子は、2次元で示される脳の細胞外空間を通って拡散する際にランダムな動きをする。 [原爆]点源から放出された多くの分子のランダムな散歩。 図1cに示すように、点源からのすべての分子の正味の移動は外向きである。累積ランダムウォークは、細胞間の空間を概説する( すなわち、 ECS;さらなる説明については、参考文献5を参照)。 この図の拡大版を見るには、ここをクリックしてください。
Protocol
Representative Results
Discussion
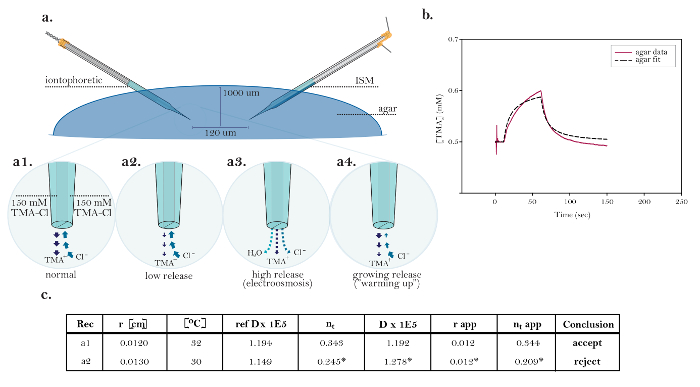
図10:一般的な技術的問題を示す理想的でないデータ ( a )イオントフォレーシス微小電極による一般的な技術的問題の図:機能的イオントフォレーシス微小電極からのTMAの正常放出と、技術的問題を示す3つの供給源との比較。 [高倍率、a1]理想的なイオン導入源の電流は、TMA放出および塩化物の取り…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、NIH NINDS助成金R01 NS047557によって支持された。
Materials
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate – do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. 신경과학. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).

