Ионтофорез в реальном времени с тетраметиламмонием для количественного определения объемной доли и торможности внеклеточного пространства мозга
Summary
Этот протокол описывает ионтофорез в реальном времени, метод измерения физических параметров внеклеточного пространства (ECS) живых мозгов. Диффузия инертной молекулы, высвобождаемой в ECS, используется для расчета объемной доли ECS и извилистости. Он идеально подходит для изучения острых обратимых изменений в ECS мозга.
Abstract
В этом обзоре описаны основные концепции и протокол для выполнения метода ионтофореза в реальном времени (RTI), золотой стандарт для исследования и количественной оценки внеклеточного пространства (ECS) живого мозга. ECS окружает все клетки мозга и содержит как интерстициальную жидкость, так и внеклеточный матрикс. Транспортировка многих веществ, необходимых для активности мозга, включая нейротрансмиттеры, гормоны и питательные вещества, происходит путем диффузии через ECS. Изменения объема и геометрии этого пространства происходят при нормальных мозговых процессах, таких как сон и патологические состояния, такие как ишемия. Однако структура и регуляция ECS головного мозга, особенно в больных государствах, по-прежнему в значительной степени не изучены. Метод RTI измеряет два физических параметра живого мозга: объемную долю и извилистость. Объемная доля – это доля объема ткани, занимаемого ECS. Тортютность – это мера относительного препятствия, с которым сталкивается вещество при рассеивании через мозгПо сравнению со средой без препятствий. В RTI, инертная молекула пульсирует от исходного микроэлектрода в мозг ECS. Когда молекулы диффундируют от этого источника, изменяющаяся концентрация ионов измеряется во времени с использованием ион-селективного микроэлектрода, расположенного примерно на расстоянии 100 мкм. Из полученной диффузионной кривой можно рассчитать как объемную долю, так и извилистость. Этот метод использовался в срезах мозга у нескольких видов (включая людей) и in vivo для изучения острых и хронических изменений в ECS. В отличие от других методов, RTI может использоваться для изучения как обратимых, так и необратимых изменений в ECS мозга в реальном времени.
Introduction
Внеклеточное пространство (ECS) представляет собой сеть взаимосвязанных каналов, внешних по отношению ко всем клеткам мозга, и содержит как интерстициальную жидкость, так и внеклеточный матрикс ( рис. 1а и рис. 1b ). Распределение многих веществ, необходимых для функционирования мозговых клеток, включая питательные вещества, гормоны и нейротрансмиттеры, происходит путем диффузии через ECS. Изменения физических параметров этого пространства, включая объем, геометрию и внеклеточную матрицу, могут существенно повлиять на диффузию через ECS и локальные концентрации ионов, которые купают клетки головного мозга, которые оказывают глубокое влияние на функцию клеток мозга 1 , 2 .
В настоящее время ионтофорез (RTI) используется для определения двух структурных характеристик области мозга: объемная доля и извилистость 3 , 4 ,"Xref"> 5. Объемная доля ( α ) представляет собой долю объема ткани, занимаемого ECS ( V ECS ) относительно общего объема ткани ( V- ткань ) в типичном элементарном объеме;
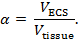
Tortuosity ( λ ) является относительным препятствием, которое вещество встречает при рассеивании через область мозга по сравнению со средой без препятствий;
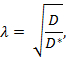
Где D * (см 2 с -1 ) – эффективный коэффициент диффузии вещества в головном мозге, а D (см 2 с -1 ) – коэффициент свободной диффузии вещества в свободной среде, такой как разбавленный агарозный гель.
Сегодня наиболее часто используемое зондирующее вещество для RМетод ТИ представляет собой небольшой катион тетраметиламмоний (ТМА). TMA имеет молекулярную массу 74 г / моль, полностью диссоциирует в растворе и имеет один положительный заряд. RTI с этим ионом показали, что α 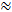 0,2 и λ
0,2 и λ 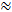 1.6 1 , 2 . Это означает, что ECS составляет примерно 20% от общего объема мозга и что диффузия небольшой инертной молекулы в ECS происходит примерно в 2,5 раза медленнее, чем в среде без препятствий 3 . Однако как α, так и λ изменяются в зависимости от возраста, региона и состояния мозга, а также в патологических условиях 1 . Изменения этих параметров были связаны с развитием мозга, старением, сном, эпилепсией и многими другими фундаментальными процессами и заболеваниями мозга 1, 6 . В то время как другие методы измеряют α и λ , RTI может измерять как в локализованных областях живой ткани в реальном времени. По этой причине RTI стала незаменимым инструментом для исследования изменений α и λ во время острых и обратимых проблем.
1.6 1 , 2 . Это означает, что ECS составляет примерно 20% от общего объема мозга и что диффузия небольшой инертной молекулы в ECS происходит примерно в 2,5 раза медленнее, чем в среде без препятствий 3 . Однако как α, так и λ изменяются в зависимости от возраста, региона и состояния мозга, а также в патологических условиях 1 . Изменения этих параметров были связаны с развитием мозга, старением, сном, эпилепсией и многими другими фундаментальными процессами и заболеваниями мозга 1, 6 . В то время как другие методы измеряют α и λ , RTI может измерять как в локализованных областях живой ткани в реальном времени. По этой причине RTI стала незаменимым инструментом для исследования изменений α и λ во время острых и обратимых проблем.
Теория, поддерживающая RTI, была первоначально подтверждена Николсоном и Филлипсом, и этот метод был широко использован с того времени 4 , 7 . Эксперименты с использованием RTI начинаются с высвобождения импульса ТМА из исходного микроэлектрода путем ионтофореза в разбавленный агарозный гель. После выталкивания ионы свободно диффундируют от точечного источника, выбирая из потенциально бесконечного числа случайных путей ( рис. 1d ). Меняющаяся концентрация ионов измеряется во времени с использованием ион-селективного микроэлектрода (ISM), расположенного примерно100 мкм ( рис. 1в ). Изменения концентрации ТМА рисуются и привязаны к кривой, которая позволяет рассчитывать как D, так и транспортный номер микроэлектрода ионофореза (параметры, обсуждаемые в Протоколе). С этими значениями процедура повторяется в интересующей области мозга для получения D * и для вычисления как α, так и λ . Управление микроэлектроном ионтофореза, сбор данных, графическое отображение и подгонка кривой концентрации ТМА, а также расчет экспериментальных параметров обычно выполняются программами Wanda и Walter, которые были специально разработаны для этой цели (программное обеспечение и их руководства Свободно предоставляется авторам по запросу).
В разделе «Протокол» настоящего обзора описаны основные процедуры, необходимые для проектирования и проведения РТИ в мозговых срезах грызунов. Этот метод также использовался в не-стержнеЛОР – модели, в том числе срезов головного мозга человека и в естественных препаратов мозга 1, 4, 6, 8, 9. В разделе «Репрезентативные результаты» представлены как идеальные, так и неидеальные результаты для выявления нюансов в интерпретации данных. Наконец, в разделе «Обсуждение» вкратце рассматриваются методы устранения неполадок, ограничения RTI, альтернативные методы, используемые для изучения ECS, и будущие приложения RTI.
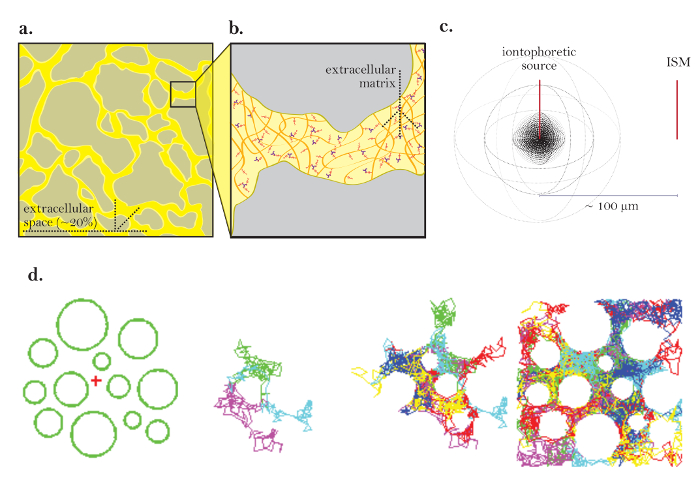
Рисунок 1: Диаграммы диффузии через ECS. (А) Схема ECS: Демонстрирует размер и расположение ECS в типичной секции мозга. Желтый обозначает ECS между процессами серой клетки головного мозга. Объем ECS составляет примерно 20% от общего объема ткани ( т. Е. Объемная доля = 0.2) в физиологических условиях. ( B ) Увеличенная диаграмма ECS: показывает физические параметры, способствующие извилистости, включая геометрию мозга (серый) и внеклеточный матрикс (схематично как сетка разноцветных гликозаминогликанов и протеогликанов). ( C ) Трехмерная диаграмма диффузии из точечного источника: Демонстрирует чистое движение инертных молекул от ионтофоретического источника до ISM. Исключая диффузионные барьеры и поглощение клеток, молекулы диффундируют наружу во всех направлениях, создавая сферический фронт концентрации. МСМ количественно определяет локальную концентрацию инертных молекул, высвобождаемых из ионтофоретического источника. ( D ) Компьютерное моделирование диффузии в ECS головного мозга: [Далеко слева] Настройка для моделирования методом Монте-Карло; Зеленые сферы представляют собой процессы в мозговых ячейках, а красный крест – точечный источник. Эта установка моделирует мозговую ткань, показанную на рисунке 1a . [Средние изображения] 3 и6, выполняющие случайные движения, когда они диффундируют через внеклеточное пространство головного мозга, показано в двух измерениях. [Крайний правый] Случайные блуждания многих молекул, выпущенных из точечного источника. Чистое движение всех молекул от точечного источника наружу, как показано на рисунке 1в . Кумулятивные случайные блуждания описывают пространства между ячейками ( т. Е. ECS, см. Ссылку 5 для дальнейшего объяснения). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
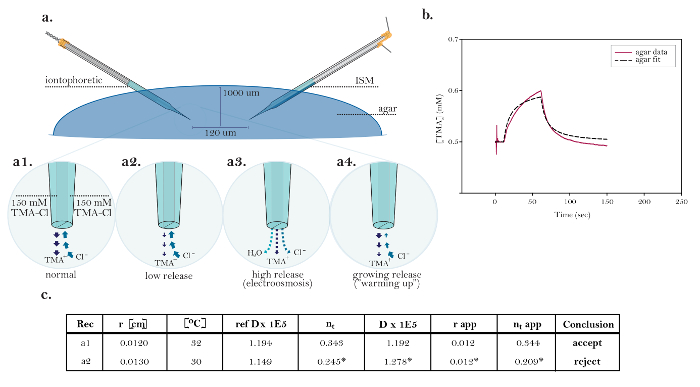
Рисунок 10: Неидеальные данные, демонстрирующие общие технические проблемы. (А) Диаграмма общих технических вопросов с ионофорезом микроэлектродами: Сравнение нормального высвобождения ТМА из функционирования ио?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Работа была поддержана грантом NIH NINDS R01 NS047557.
Materials
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate – do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. 신경과학. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).

