Real-time Iontophoresis med tetrametylammonium for å kvantifisere volumfraksjon og tortuositet i hjernens ekstracellulære rom
Summary
Denne protokollen beskriver sanntids-iontoforese, en metode som måler fysiske parametere for det ekstracellulære rommet (ECS) av levende hjerner. Spredningen av et inert molekyl som slippes i ECS, brukes til å beregne ECS volumfraksjonen og tortuositeten. Det er ideelt for å studere akut reversible endringer i hjerne ECS.
Abstract
Denne anmeldelsen beskriver de grunnleggende konseptene og protokollen for å utføre realtids iontoforese-metoden (GI), gullstandarden for å undersøke og kvantifisere det ekstracellulære rommet (ECS) av levende hjerne. ECS omgir alle hjerneceller og inneholder både interstitiell væske og ekstracellulær matrise. Transport av mange stoffer som kreves for hjernens aktivitet, inkludert nevrotransmittere, hormoner og næringsstoffer, skjer ved diffusjon gjennom ECS. Endringer i volum og geometri i dette rommet forekommer under normale hjerneprosesser, som søvn og patologiske forhold, som iskemi. Men strukturen og reguleringen av hjernen ECS, særlig i sykdommer, forblir stort sett uutforsket. RTI-metoden måler to fysiske parametere av levende hjerne: volumfraksjon og tortuositet. Volumfraksjon er andelen av vevvolumet okkupert av ECS. Tortuosity er et mål på den relative hindringen et stoff møter når det diffunderes gjennom hjernenGion i forhold til et medium uten hindringer. I RTI pulses et inert molekyl fra en kilde-mikroelektrode til hjernen ECS. Som molekyler diffunderer vekk fra denne kilden, måles den skiftende konsentrasjonen av ionet over tid ved å bruke en ion-selektiv mikroelektrode plassert omtrent 100 μm unna. Fra den resulterende diffusjonskurven kan både volumfraksjon og tortuositet beregnes. Denne teknikken har blitt brukt i hjerneskiver fra flere arter (inkludert mennesker) og in vivo for å studere akutte og kroniske endringer i ECS. I motsetning til andre metoder kan RTI brukes til å undersøke både reversible og irreversible endringer i hjernens ECS i sanntid.
Introduction
Det ekstracellulære rommet (ECS) er nettverket av sammenkoblede kanaler utvendig til alle hjerneceller og inneholder både interstitialvæske og ekstracellulær matrise ( figur 1a og figur 1b ). Fordelingen av mange stoffer som kreves for hjernecellens funksjon, inkludert næringsstoffer, hormoner og nevrotransmittere, oppstår ved diffusjon gjennom ECS. Endringer i de fysiske parametrene til dette rommet, inkludert volum, geometri og ekstracellulær matrise, kan drastisk påvirke diffusjon gjennom ECS og de lokale ionkonsentrasjonsbadinghjerneceller, som har en dyp innvirkning på hjernecellens funksjon 1 , 2 .
Real-time iontophorese (RTI) brukes til å bestemme to strukturelle egenskaper i en hjerneområde: volumfraksjon og tortuosity 3 , 4 ,"Xref"> 5. Volumfraksjon ( α ) er andelen av vevvolum okkupert av ECS ( V ECS ) i forhold til totalvevvolumet ( V- vev ) i et representativt elementært volum;
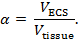
Tortuosity ( λ ) er den relative hindringen som et stoff møter når det diffunderer gjennom en hjerneområde i forhold til et medium uten hindringer;
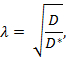
Hvor D * (cm 2 s -1 ) er den effektive diffusjonskoeffisienten av stoffet i hjernen og D (cm 2 s -1 ) er den frie diffusjonskoeffisienten av stoffet i et fritt medium, slik som fortynnet agarosegel.
I dag er den mest brukte probesubstansen for RTI-metoden er den lille kationtetrametylammonium (TMA). TMA har en molekylvekt på 74 g / mol, dissocieres fullstendig i oppløsning, og har en positiv ladning. RTI studier med dette ionet har vist at α 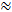 0,2 og λ
0,2 og λ 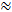 1,6 1 , 2 . Dette betyr at ECS er omtrent 20% av total hjernevolum, og at diffusjonen av et lite inert molekyl forekommer omtrent 2,5 ganger langsommere i ECS enn i et medium uten hindringer 3 . Imidlertid varierer både a og λ med hjernealder, region og tilstand og i patologiske forhold 1 . Endringer av disse parametrene har vært knyttet til hjernens utvikling, aldring, søvn, epilepsi og mange andre grunnleggende prosesser og sykdommer i hjernen 1, 6 . Mens andre teknikker måler α og λ , kan RTI måle både i lokaliserte områder av levende vev i sanntid. Av denne grunn har RTI blitt et uunnværlig verktøy for å undersøke endringer i a og λ under akutte og reversible utfordringer.
1,6 1 , 2 . Dette betyr at ECS er omtrent 20% av total hjernevolum, og at diffusjonen av et lite inert molekyl forekommer omtrent 2,5 ganger langsommere i ECS enn i et medium uten hindringer 3 . Imidlertid varierer både a og λ med hjernealder, region og tilstand og i patologiske forhold 1 . Endringer av disse parametrene har vært knyttet til hjernens utvikling, aldring, søvn, epilepsi og mange andre grunnleggende prosesser og sykdommer i hjernen 1, 6 . Mens andre teknikker måler α og λ , kan RTI måle både i lokaliserte områder av levende vev i sanntid. Av denne grunn har RTI blitt et uunnværlig verktøy for å undersøke endringer i a og λ under akutte og reversible utfordringer.
Teorien som støttet RTI ble opprinnelig godkjent av Nicholson og Phillips, og teknikken har blitt brukt mye siden den tiden 4 , 7 . Eksperimenter som benytter RTI begynner med frigjøring av en puls av TMA fra en kilde-mikroelektrode ved iontoforese inn i en fortynnet agarosegel. Når de er utkastet, diffunger ioner fritt fra punktkilden, og velger fra et potensielt uendelig antall tilfeldige veier ( figur 1d ). Den endrede konsentrasjonen av ionet måles over tid ved å bruke en jon-selektiv mikroelektrode (ISM) plassert grovt100 μm unna ( figur 1c ). Endringene i TMA-konsentrasjonen er grafet og montert på en kurve som gjør det mulig å beregne både D og transportnummeret til iontoforese mikroelektroden (parametere diskutert i protokollen). Med disse verdiene gjentas prosedyren i en hjerneområde av interesse for å oppnå D * og å beregne både a og λ . Kontroll av iontophorese mikroelektroden, datainnsamling, grafing og montering av TMA-konsentrasjonskurven og beregning av eksperimentelle parametere gjøres vanligvis av programmene Wanda and Walter, som er spesielt designet for dette formålet (programvaren og deres håndbøker er Fritt tilgjengelig fra forfatterne på forespørsel).
Protokolldelen i denne anmeldelsen beskriver de grunnleggende prosedyrene som trengs for å designe og utføre RTI i hjerneskjær av gnagere. Teknikken har også blitt brukt i ikke-stangEnt modeller, inkludert humane hjerne skiver og in vivo hjernen preparater 1 , 4 , 6 , 8 , 9 . Den Representative Results-delen inneholder både ideelle og ikke-ideelle resultater for å markere nyanser i datatolkning. Endelig dekker diskusjonsseksjonen feilsøkingsteknikker, begrensninger av RTI, alternative teknikker som brukes til å studere ECS, og fremtidige applikasjoner av RTI.
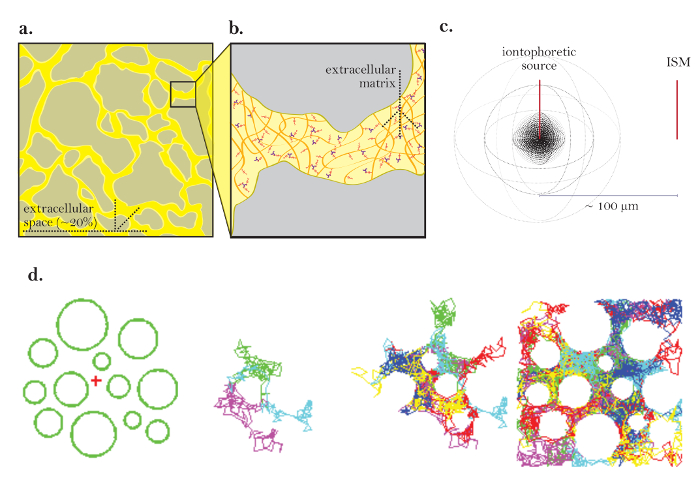
Figur 1: Diagrammer av diffusjon gjennom ECS. ( A ) Diagram over ECS: Demonstrer størrelsen og plasseringen av ECS i en typisk hjerneseksjon. Gul markerer ECS mellom de grå hjernecelleprosessene. Volumet av ECS er omtrent 20% av det totale vevvolumet ( dvs. volumfraksjon = 0.2) under fysiologiske forhold. ( B ) Forstørret diagram av ECS: Fremhever fysiske parametre som bidrar til tortuositet, inkludert hjernecellet geometri (grå) og ekstracellulær matrise (diagrammet som et maske av flerfarget glykosaminoglykaner og proteoglycaner). ( C ) 3D-diagram av diffusjon fra en punktkilde: Demonstrerer netto bevegelse av inerte molekyler fra en iontoforetisk kilde til en ISM. Uten diffusjonsbarrierer og opptak av cellene diffunderer molekylene utover i alle retninger, og produserer en sfærisk konsentrasjonsfront. ISM kvantifiserer den lokale konsentrasjonen av de inerte molekylene frigjort fra den iontoforetiske kilden. ( D ) Datasimulering av diffusjon i hjernens ECS: [Langt til venstre] Oppsett for Monte Carlo-simulering; Grønne sfærer representerer hjernecelleprosesser og det røde kors representerer en punktkilde. Dette oppsettet modellerer hjernevævet diagrammet i figur 1a . [Midtbilder] 3 og6 molekyler utfører tilfeldige bevegelser som de diffunderer gjennom hjernens ekstracellulære rom, vist i 2 dimensjoner. [Langst til høyre] Tilfeldige turer av mange molekyler utgitt fra punktkilden. Netto bevegelse av alle molekyler fra punktkilden er utover som vist i figur 1c . De kumulative tilfeldige turene skisserer mellomromene mellom cellene ( dvs. ECS, se referanse 5 for videre forklaring). Vennligst klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
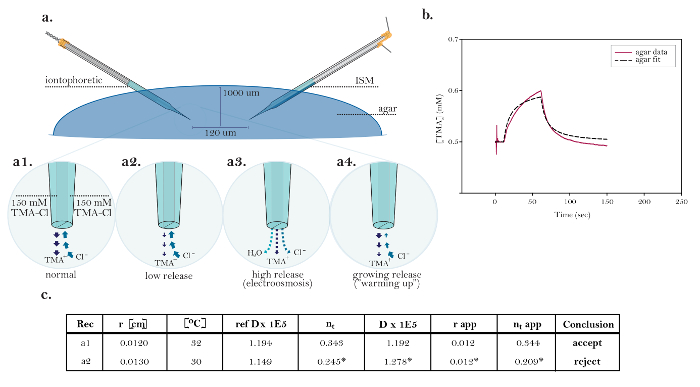
Figur 10: Ikke-ideelle data som demonstrerer vanlige tekniske problemer. ( A ) Diagrammer av vanlige tekniske problemer med iontophores mikroelektroder: Sammenligning av normal frigivelse av TMA fra en fungerende iontoforese mikroelektrode med tre kilder som viser tekniske problemer. [Høy forstørrelse, a1] Strømmen i en ideell iontoforetisk kilde bæres like ved TMA-frigivelse og kloridopptak. [H…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Arbeidet ble støttet av NIH NINDS stipend R01 NS047557.
Materials
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate – do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. 신경과학. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).

