Échelle atomique des études structurales des assemblages macromoléculaires par spectroscopie RMN à l’état solide
Summary
Structures des assemblages supramoléculaires protéine à résolution atomique sont de grande importance en raison de leur rôle crucial dans une variété de phénomènes biologiques. Ici, nous présentons un protocole pour effectuer des études structurales à haute résolution sur des ensembles de protéines macromoléculaire insoluble et non cristalline par magie-angle spinning spectroscopie RMN à l’état solide (MAS SSNMR).
Abstract
Assemblages supramoléculaires protéines jouent un rôle fondamental dans les processus biologiques allant de l’interaction hôte-pathogène, infection virale à la propagation de maladies neurodégénératives. Ces assemblys consistent en plusieurs sous-unités protéiques organisées d’une manière non covalentes pour former de grands objets macromoléculaires qui peuvent exécuter une variété de fonctions cellulaires ou provoquer des conséquences néfastes. Perspicacités atomiques dans les mécanismes de l’assemblage et le fonctionnement de ces assemblages macromoléculaires restent souvent peu abondantes depuis leur insolubilité inhérente et non-cristallinité souvent radicalement réduit la qualité des données obtenues de la plupart des techniques utilisé en biologie structurale, tels que la cristallographie aux rayons x et la solution de résonance magnétique nucléaire (RMN). Nous présentons ici la spectroscopie RMN à l’état solide de rotation à l’angle magique (SSNMR) comme une méthode puissante pour étudier les structures des assemblages macromoléculaires à résolution atomique. SSNMR peut révéler des détails atomiques sur le complexe assemblé sans limites de taille et de la solubilité. Le protocole présenté ici décrit les étapes essentielles de la production de 13C /15N les assemblys marqués isotope macromoléculaires protéiques à l’acquisition du standard des spectres de SSNMR et leur analyse et leur interprétation. À titre d’exemple, nous montrons le pipeline d’une analyse structurale de le SSNMR d’un assemblage de protéines filamenteuses.
Introduction
Les progrès dans la filature de la spectroscopie RMN à l’état solide (SSNMR) à l’angle magique offrent un outil efficace pour la caractérisation des assemblages macromoléculaires protéiques à une résolution atomique. Ces ensembles de protéines sont des systèmes ubiquitaires qui jouent un rôle essentiel dans de nombreux processus biologiques. Leurs structures moléculaires, les interactions et les dynamiques sont accessibles par des études SSNMR, comme l’a montré pour virale (capsides1) et des mécanismes d’infection bactérienne (sécrétion systèmes2,3, pili,4), membrane protéines complexes5,6,7,8 et fonctionnelle amyloïdes 9,10,11. Ce type d’assemblage moléculaire peut également provoquer des pathologies telles que les maladies neurodégénératives où les protéines se réunissent dans des États mal repliées, amyloïdes et provoquent un comportement aberrant de cellule ou cellule mort 12,13. Ensembles de protéines sont souvent construits par l’oligomérisation symétrique des copies multiples de sous-unités protéiques en gros objets supramoléculaires de différentes formes, y compris les fibrilles, les filaments, les pores, les tubes ou les nanoparticules. L’architecture du Quaternaire est définie par des interactions faibles entre les sous-unités protéiques d’organiser l’Assemblée spatiale et temporelle et pour permettre des fonctions biologiques sophistiquées. Enquêtes structurelles à l’échelle atomique sur ces assemblées sont un défi pour les techniques de haute résolution depuis leur insolubilité intrinsèque et très souvent leur cristallinité-non restreint l’utilisation de la diffraction conventionnelle ou solution NMR approches. Magie-angle spinning SSNMR (MAS) est une technique émergente d’obtenir des données de résolution atomique sur des assemblages macromoléculaires insolubles et a prouvé son efficacité pour résoudre les modèles atomiques 3D pour un nombre croissant de systèmes biomoléculaires complexes y compris filaments bactériens, les assemblys amyloïdes et les particules virales 14,15,16,17,18,19,20, 21,22. Des progrès techniques sur les champs magnétiques élevés, des développements méthodologiques et préparation des échantillons a établi SSNMR MAS dans une méthode robuste pour étudier les protéines insolubles dans divers environnements, notamment dans leur biologiquement pertinente macromoléculaires assemblées d’État ou dans les membranes cellulaires, ce qui rend la technique très complémentaire de cryo-microscopie électronique. Dans de nombreux cas, un très haut degré de symétrie caractérise ces assemblys de protéine. MAS SSNMR exploite cette fonctionnalité, comme toutes les sous-unités protéiques dans un assembly homomolecular aurait la même structure locale et donc pratiquement la même de signature SSNMR, réduisant considérablement la complexité de l’analyse.
Un protocole efficace pour des études structurales des assemblages macromoléculaires protéiques par MAS modérées (< 25KHz) SSNMR est présenté dans cette vidéo et peut être subdivisée en différentes étapes (Figure 1). Nous allons démontrer les étapes cruciales du flux de travail d’une étude structurale de SSNMR illustrée sur un assemblage de protéines filamenteuses (voir mis en évidence les étapes à la Figure 1), à l’exception de purification de protéine de sous-unité, différentes pour chaque protéine l’Assemblée mais d’une importance cruciale pour les études structurales et sans entrer dans les détails techniques/méthodologiques de calcul de structure et de la spectroscopie SSNMR pour quels tutoriels spécialisés sont disponibles en ligne. Alors que le présent Protocole se concentrera principalement sur les expériences de RMN à l’état solide effectués dans des conditions de MAS, l’utilisation d’alignés environnements biologiques 23,24,25,26 , 27, tels que bicelles alignées, permettre l’enquête de la conformation des protéines et l’interaction dynamique de protéine-protéine dans les médias de type membrane sans la technologie MAS. Nous allons montrer l’expression de la protéine et étapes de l’assemblage ainsi que l’enregistrement des spectres SSNMR cruciales et leur analyse et l’interprétation. Notre but est de donner un aperçu de l’oléoduc d’analyse structurale permettant au lecteur d’effectuer une étude structurale d’atomique-résolution d’une Assemblée macromoléculaire par des techniques SSNMR.
Le protocole comprend 3 sections :
1. à l’état solide production d’échantillon de NMR
Comme une condition préalable à une analyse par RMN à l’état solide, les constituants protéiques de la nécessité de macromoléculaires Assemblée de s’exprimer, isotopes marqués, purifiée et assemblé in vitro dans l’état natif complexe (pour un exemple, voir Figure 2) . Pour assurer la haute sensibilité de NMR, enrichissement isotopique 13C et 15N étiquetage est nécessaire grâce à l’utilisation de médias minime expression bactérienne additionné de 13C et sources d’azote 15, comme uniformément 13 C-étiqueté glucose/glycérol et 15NH4Cl respectivement. Dans le stade avancé du protocole, sélectivement 13C marqué échantillons produit avec sélectivement 13C marqué des sources telles que (1, 3 –13C)- et (2 –13C)-glycérol (ou (1 –13C)- et (2 –13C)- le glucose) sont utilisés pour faciliter l’analyse par RMN. Échantillon étiqueté mélangé correspondant à un mélange équimolaire de soit 50 % 15N – et 50 % 13C marqué ou 50 % (1, 3 –13C)- et 50 % (2 –13C)-glucose ont été introduites pour décrire la détection d’intermoléculaire interactions. Un haut degré de pureté de la protéine ainsi que des conditions rigoureuses au cours de l’étape d’assemblage sont des facteurs clés pour assurer un ordre structurel homogène de l’échantillon final.
2. préliminaire caractérisation structurale basée sur unidimensionnelle (1D) à semi-conducteurs NMR
Nous présentons les expériences essentielles pour l’analyse structurale par SSNMR. Unidimensionnelle (1D) polarisation croisée (CP) et INEPT / RINEPT28 expériences, détectés sur les noyaux de 13C sont utilisées pour détecter des segments rigides et flexibles de protéine dans l’Assemblée, respectivement et d’estimer le degré de structure homogénéité et polymorphisme local (pour un exemple, voir Figure 3).
Rong > 3. Détermination de structure de l’analyse conformationnelle et 3D
Les paragraphes 1 et 2 concernent l’analyse conformationnelle, qui repose sur l’affectation de résonance SSNMR de tous les résidus rigides de l’Assemblée de protéines, comme les déplacements chimiques sont des sondes très sensibles à l’environnement local et peuvent être utilisés pour prédire la phi/psi dièdre angles et déterminer ainsi la structure secondaire. La figure 4 illustre un exemple d’une cession de résonance séquentielle dans le noyau rigide d’un assemblage de protéines. La détermination de la structure 3D repose sur la collecte des données structurelles, telles que les contraintes de distance encodage fermer proximités (< Å 7-9), contenant aussi bien intra – et intermoléculaires informations. Les paragraphes 3 et 4 décrivent interprétation et collection de retenue lointain à longue distance. Contacts à longue distance sont définis comme intramoléculaires 13C –13C proximités provenant de tout résidu i à j, avec | i-j | ≥ 4, définissant ainsi le giron de la protéine tertiaire de la sous-unité monomère ou intermoléculaires 13C –13C proximités, définir les interfaces intermoléculaires entre les sous-unités protéiques dans l’assembly. Intra – et intermoléculaires interfaces sont illustrées à la Figure 5. Dispositifs de retenue pour SSNMR détectée par le biais de 13C –13C et 15N –13C raccordement expériences habituellement codent pour des distances internucléaires < 1 nm. Paragraphe 4 explique la détection des dispositifs de retenue de la distance intermoléculaire. Dans les assemblys de protéine symétrique, l’utilisation d’échantillons étiquetés de façon homogène (c’est-à-dire 100 % uniformément ou sélectivement marqués) pour identifier les interactions intermoléculaires sous-unité sous-unité est limité, comme les deux intra – et inter-moléculaires contacts aboutissent à signaux détectables. La détection sans ambiguïté des proximités intermoléculaires est obtenue en utilisant mixtes échantillons étiquetés, contenant un mélange équimolaire de deux échantillons différemment étiquetées, combiné avant l’agrégation. Paragraphe 5 présente brièvement la modélisation de la structure.
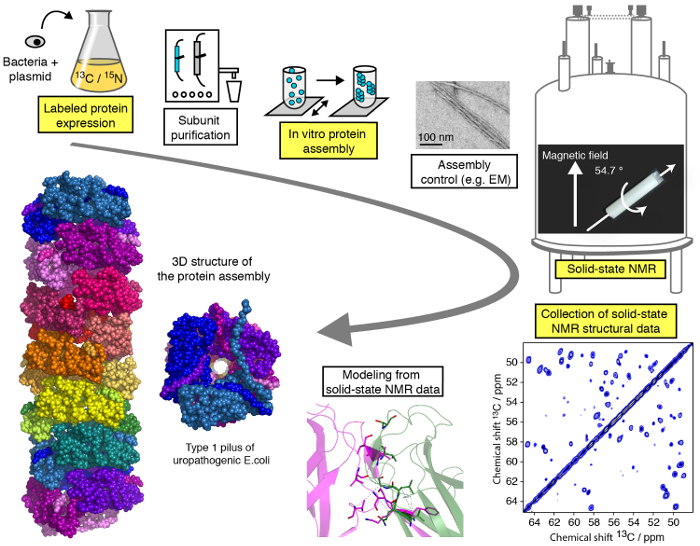
Figure 1 : D’une étude d’atomique-résolution structurale par RMN à l’état solide, les flux de travail. 13 C, 15N isotopique marqué la production de protéines, purification de la sous-unité, Assemblée de sous-unité, contrôle de la formation de l’Assemblée, SSNMR des expériences, analyse expérience SSNMR et extraction des contraintes de distance et modélisation de la structure sont indiqués. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
La RMN à l’état solide (SSNMR) est une méthode de choix pour la caractérisation des assemblages macromoléculaires protéiques au niveau atomique. Une des questions centrales dans la détermination de la structure axée sur les SSNMR est la qualité spectrale du système étudié, qui permet d’établir des modèles structurels 3D de précision différents, qui vont généralement de modèles basse résolution (contenant l’image secondaire structure des éléments et peu d’information 3D) aux structures 3D Pseudo-aléatoire atomiques. La quantité et la qualité des informations structurales extraites des expériences multidimensionnelles de SSNMR est la clé pour calculer une structure RMN haute résolution de l’Assemblée.
Le protocole décrit repose sur la détection de 13C –13C et 15N –13C structurelle retenue nécessitant l’enregistrement de plusieurs spectres 2D (et parfois 3D) avec signal sur bruit élevé. À des fréquences de MAS modérées (< 25 kHz), l’échantillon est introduit dans les rotors avec tailles de 3,2 à 4 mm de diamètre permettant de quantités de protéine jusqu’à ~ 50 mg, dépendant de l’hydratation de l’échantillon. La quantité de l’échantillon à l’intérieur du rotor est directement proportionnelle à la ratio signal-bruit dans les spectres SSNMR, un facteur décisif pour la détection des contraintes de distance longue portée ainsi que leur affectation sans ambiguïté.
La résolution spectrale est un paramètre crucial lors de la cession de résonance séquentielle et la collection de restrictions. Pour obtenir des résultats optimaux, les paramètres de préparation d’échantillon doivent être optimisés, notamment dans la purification de la sous-unité et les conditions de montage (pH, tampon, secouant, température, etc.). Pour l’optimisation de l’échantillon, il est recommandé de préparer les échantillons non étiquetées pour plusieurs conditions distinctes pour lesquelles l’Assemblée a été observée et d’enregistrer un 1D 1H13C CP spectre (décrit à l’étape 2.1) sur chaque échantillon préparé. Les spectres permettent de confronter la résolution spectrale et la dispersion entre les différentes préparations, selon qui les conditions optimales peuvent être jugées.
La qualité des données SSNMR dépend fortement du choix des paramètres d’acquisition du NMR, surtout pour les étapes de transfert de polarisation. L’utilisation des intensités de champ magnétique élevées (fréquence de 1H ≥600 MHz) est essentielle pour la haute sensibilité et résolution spectrale, nécessaire face à des cibles complexes tels que les assemblages macromoléculaires protéiques.
Un facteur limitatif dans bien des cas est la disponibilité de spectromètre. Par conséquent, un choix judicieux des échantillons pour être préparé doit précéder la session spectromètre. Dans tous les cas, uniformément 13C, 15échantillon marqué N est une condition sine qua non pour effectuer l’assignation de résonance séquentielle et intra-résiduelle. Pour les protéines assignés par des techniques de RMN à l’état solide voir71. Détermination de la structure des assemblages macromoléculaires à des fréquences de MAS modérées nécessite sélectivement 13échantillons marqués au C ; pour la détection à longue distance 13C –13C et 13C –15N entre en contact avec échantillons basée sur 1, 3 –13C – et 2 –13C-gylcerol ou 1 –13C – et 2 –13C-glucose étiquetage sont couramment utilisés, comme décrit ci-dessus. Le choix entre les deux régimes d’étiquetage est issu de la spectrale ratio signal-bruit et de la résolution. Pour distinguer entre intra – et intermoléculaires contacts à longue distance, mixtes échantillons étiquetés et dilués ont révélé efficace.
En bref, les étapes essentielles pour une étude structurale de SSNMR atomique sont : (i) la préparation des sous-unités et la nécessité de l’Assemblée d’être optimisée pour obtenir l’excellent échantillon quantitatif et qualitatif, les paramètres de résistance et d’acquisition du champ spectromètre (ii) doivent être choisis avec soin ; (iii) sélectifs étiquetage stratégies sont nécessaires pour une détermination de la structure 3D et la quantité de données requises dépend de la qualité des données et la disponibilité de données complémentaires.
Malgré son applicabilité à un large éventail de systèmes supramoléculaires allant de protéines membranaires à homomultimeric nano-objets, SSNMR est souvent limitée par la nécessité pour les mg-quantités de matériau isotopiquement étiqueté. Les récents développements technologiques en ultra-rapide SSNMR MAS (≥100 kHz) ouvert vers le haut de l’avenue à 1H-détecté NMR et pousser la limite de la quantité d’échantillon minimal pour sub-mg 72,,du7374. Néanmoins, pour des études structurelles détaillées 13C marqué échantillons sont indispensables, ce qui limite l’application de SSNMR d’échantillons rassemblés en vitro ou de systèmes exprimés dans les organismes qui survivent dans un milieu minimal lorsque dans la cellule SSNMR est une nouvelle méthode (pour 75,76,77,78, voir commentaires).
Un facteur important dans l’application SSNMR pour obtenir des structures 3D haute résolution est la résolution spectrale : intrinsèque hétérogénéité conformationnelle dans un assembly peut limiter l’analyse spectrale de spectres et de résolution. Résidus spécifiques 13C étiquetage peut dans certains cas fournir une alternative pour obtenir des informations de distance spécifique sur les résidus de stratégiques afin d’obtenir des modèles structuraux (pour une récente voir du 79,d’exemples80).
SSNMR pour la détermination de la structure 3D nécessite toujours la collecte de plusieurs ensembles de données avec des temps de collection de données souvent long sur des instruments sophistiqués, selon l’approche et le système de plusieurs jours à plusieurs semaines sur un 600-1000 MHz (fréquence de1H) spectromètre. Par conséquent, l’accès au temps du spectromètre peut être un facteur limitant dans une étude approfondie de la SSNMR.
Dans le cas des ensembles de protéines homomultimeric, conduisant à des données SSNMR d’une qualité suffisante pour identifier un grand nombre de contraintes structurelles telles que dans 3,57,64,70, SSNMR ne donne toujours aucun accès aux dimensions microscopiques. Par conséquent, dans une détermination de structure SSNMR de novo d’un assembly homomultimeric, EM ou par longueur-masse (MPL) données idéalement complément données SSNMR pour calculer les paramètres de la symétrie. Données SSNMR seules fournissent atomique intra – et intermoléculaires interfaces
SSNMR est très complémentaire avec les techniques structurelles telles que les mesures EM ou MPL, mais les données peuvent aussi parfaitement être combinées avec la structure atomique obtenue par cristallographie aux rayons x ou la RMN en solution sur des sous-unités mutées ou tronquées. Un nombre croissant d’études se trouvent dans la littérature où la conjonction de différentes données structurelles a permis de déterminer des modèles 3D atomiques des assemblages macromoléculaires (voir Figure 6 exemples représentatifs).
Dans le domaine de la biologie structurale, SSNMR apparaît comme une technique prometteuse pour étudierassemblys insolubles et non cristalline à l’atomique niveau, c.-à-d. fournissant structurelle des données à l’échelle atomique. À cet égard, SSNMR est le pendentif à solution NMR et cristallographie de rayon x pour assemblages moléculaires, y compris les protéines membranaires de leurs assemblées d’environnement et de la protéine natives comme enveloppes virales, bactériennes filaments ou amyloïdes, RNA et Complexes ARN-protéine (voir, par exemple,81). Ses applications hautement versatile in vitro et dans le contexte cellulaire, comme le suivi des modifications de structures secondaires, tertiaires et quaternaires, identification des surfaces d’interaction avec les molécules de partenaire à l’échelle atomique (par exemple, 82) et cartographie dynamique moléculaire dans le cadre des assemblées complexes, indiquent le potentiel important de SSNMR dans de futures études structurales sur les assemblys biomoléculaire complexes.
| Composant | Moyen de M9 |
| NaCl | 0,5 g/L |
| KH2PO4 | 3 g/L |
| Na2HPO4 | 6.7 g/L |
| MgSO4 | 1 mM |
| ZnCl2 | 10 ΜM |
| FeCl3 | 1 ΜM |
| CaCl2 | 100 ΜM |
| Mélange de vitamine MEM 100 X | 10 mL/L |
| 13 C-glucose | 2 g/L |
| 15 NH4Cl | 1 g/L |
Tableau 1 : Composition du milieu minimal d’expression de protéine recombinante production de E. coli cellules BL21.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail est financé par l’ANR (13-CDRP-0017-01 B.H. et ANR-14-CE09-0020-01 à A.L.), « Investissements d’avenir » Programme IdEx Bordeaux/CNRS (PEPS 2016 à B.H.) référence ANR-10-IDEX-03-02 à B.H., la Fondation pour la Recherche Médicale) FRM-AJE20140630090 à A.L.), le programme FP7 (pcrd7-personnes-2013-CIG à A.L.) et le Conseil européen de la recherche (CER) en vertu du programme de recherche et d’innovation Horizon 2020 de l’Union européenne (ERC Starting Grant à A.L., contrat N° 639020) et le projet ” WEAKINTERACT. »
Materials
| Instruments | |||
| NMR Spectrometer (> 11.7 Tesla) | Bruker | – | |
| triple resonance MAS SSNMR probehead | Bruker | – | |
| SSNMR rotors 4mm | Bruker | K1910 | |
| Centrifuge 5804 R | Eppendorf | 5805000629 | |
| GeneQuant 1300 spectrometer | Dutscher | 28-9182-13 | |
| IGS60 INCUBATEUR HERATHERM 75 L | Dutscher | 228001 | |
| MaxQ 4450 bench top orbital shaker | Dutscher | 78376 | |
| Tube Revolver Agitator | Dutscher | 79547 | |
| sonopuls HD 3100 | Bandelin | 3680 | |
| MicroPulser electroporator | Biorad | 165-2100 | |
| mini-PROTEAN tetra cell system | Biorad | 165-8000 | |
| AKTA pure system | GE Healthcare | 29-0182-24 | |
| capillary microman M25 pipet | Gilson | F148502 | |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| amiconR ultra-15 | sigma | Z740199-8EA | |
| capillaries and pistons | Gilson | F148112 | |
| spatula | Fisher | 13263799 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| D-glucose 13C6 | Sigma | 389374 | |
| Ammonium-15N-chloride | Sigma | 299251 | |
| 1,3 13C2 glycerol | Sigma | 492639 | |
| 2 13C glycerol | Sigma | 489484 | |
| Kanamycin | Sigma | K1876 | |
| Carbenicillin | Sigma | C3416 | |
| Sodium phosphate dibasic | Sigma | S7907 | |
| Potassium phosphate monobasic | Sigma | P5655 | |
| Sodium chloride | Sigma | 71380 | |
| calcium chloride | Sigma | C1016 | |
| Magnesium sulfate | Sigma | 208094 | |
| Iron Chloride | Sigma | 157740 | |
| Zinc chloride | Sigma | 793523 | |
| MEM Vitamin Solution (100×) | Sigma | M68954 | |
| IPTG | Fisher | BP1755 | |
| Trizma base | Sigma | T1503 | |
| Tricine | Sigma | T0377 | |
| SDS | Sigma | 436143 | |
| sodium azide | sigma | 71289 | |
| 4,4-dimethyl-4-silapentane-1-sulfonic acid | Sigma | 178837 | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Unicorn 6.3 | GE Healthcare | Akta systems | |
| ccpNMR | CCPN | spectrometer systems |
References
- Morag, O., Sgourakis, N. G., Baker, D., Goldbourt, A. The NMR-Rosetta capsid model of M13 bacteriophage reveals a quadrupled hydrophobic packing epitope. Proc Natl Acad Sci U S A. 112 (4), 971-976 (2015).
- Loquet, A., et al. Atomic model of the type III secretion system needle. Nature. 486 (7402), 276-279 (2012).
- Demers, J. P., et al. High-resolution structure of the Shigella type-III secretion needle by solid-state NMR and cryo-electron microscopy. Nat Commun. 5 (4976), (2014).
- Habenstein, B., et al. Hybrid Structure of the Type 1 Pilus of Uropathogenic Escherichia coli. Angew Chem Int Ed Engl. 54 (40), 11691-11695 (2015).
- Cady, S. D., et al. Structure of the amantadine binding site of influenza M2 proton channels in lipid bilayers. Nature. 463 (7281), 689-692 (2010).
- Park, S. H., et al. Structure of the chemokine receptor CXCR1 in phospholipid bilayers. Nature. 491 (7426), 779-783 (2012).
- Kaplan, M., et al. Probing a cell-embedded megadalton protein complex by DNP-supported solid-state NMR. Nat Methods. 12 (7), 649-652 (2015).
- Wang, S., et al. Solid-state NMR spectroscopy structure determination of a lipid-embedded heptahelical membrane protein. Nat Methods. 10 (10), 1007-1012 (2013).
- Daskalov, A., et al. Signal transduction by a fungal NOD-like receptor based on propagation of a prion amyloid fold. PLoS Biol. 13 (2), e1002059 (2015).
- Daskalov, A., et al. Identification of a novel cell death-inducing domain reveals that fungal amyloid-controlled cell death is related to necroptosis. Proc Natl Acad Sci U S A. , (2016).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nat Rev Mol Cell Biol. 15 (6), 384-396 (2014).
- Aguzzi, A., Lakkaraju, A. K. Cell Biology of Prions and Prionoids: A Status Report. Trends Cell Biol. 26 (1), 40-51 (2016).
- Habenstein, B., Loquet, A. Solid-state NMR: An emerging technique in structural biology of self-assemblies. Biophys Chem. , (2015).
- Meier, B. H., Bockmann, A. The structure of fibrils from ‘misfolded’ proteins. Curr Opin Struct Biol. 30, 43-49 (2015).
- Miao, Y., Cross, T. A. Solid state NMR and protein-protein interactions in membranes. Curr Opin Struct Biol. 23 (6), 919-928 (2013).
- Tang, M., Comellas, G., Rienstra, C. M. Advanced solid-state NMR approaches for structure determination of membrane proteins and amyloid fibrils. Acc Chem Res. 46 (9), 2080-2088 (2013).
- Weingarth, M., Baldus, M. Solid-state NMR-based approaches for supramolecular structure elucidation. Acc Chem Res. 46 (9), 2037-2046 (2013).
- Loquet, A., Habenstein, B., Lange, A. Structural investigations of molecular machines by solid-state NMR. Acc Chem Res. 46 (9), 2070-2079 (2013).
- Yan, S., Suiter, C. L., Hou, G., Zhang, H., Polenova, T. Probing structure and dynamics of protein assemblies by magic angle spinning NMR spectroscopy. Acc Chem Res. 46 (9), 2047-2058 (2013).
- Tycko, R., Wickner, R. B. Molecular structures of amyloid and prion fibrils: consensus versus controversy. Acc Chem Res. 46 (7), 1487-1496 (2013).
- Hong, M., Zhang, Y., Hu, F. Membrane protein structure and dynamics from NMR spectroscopy. Annu Rev Phys Chem. 63, 1-24 (2012).
- Jelinek, R., Ramamoorthy, A., Opella, S. J. High-Resolution Three-Dimensional Solid-state NMR Spectroscopy of a Uniformly 15N-Labeled Protein. J Am Chem Soc. 117, 12348-12349 (1995).
- Xu, J., et al. Bicelle-enabled structural studies on a membrane-associated cytochrome B5 by solid-state MAS NMR spectroscopy. Angew Chem Int Ed Engl. 47 (41), 7864-7867 (2008).
- Durr, U. H., Gildenberg, M., Ramamoorthy, A. The magic of bicelles lights up membrane protein structure. Chem Rev. 112 (11), 6054-6074 (2012).
- Yamamoto, K., et al. Probing the transmembrane structure and topology of microsomal cytochrome-p450 by solid-state NMR on temperature-resistant bicelles. Sci Rep. 3, 2556 (2013).
- Huang, R., et al. Probing the transmembrane structure and dynamics of microsomal NADPH-cytochrome P450 oxidoreductase by solid-state NMR. Biophys J. 106 (10), 2126-2133 (2014).
- Durr, U. H., Yamamoto, K., Im, S. C., Waskell, L., Ramamoorthy, A. Solid-state NMR reveals structural and dynamical properties of a membrane-anchored electron-carrier protein, cytochrome b5. J Am Chem Soc. 129 (21), 6670-6671 (2007).
- Hong, M. Determination of multiple phi-torsion angles in proteins by selective and extensive (13)C labeling and two-dimensional solid-state NMR. J Magn Reson. 139 (2), 389-401 (1999).
- Lundstrom, P., et al. Fractional 13C enrichment of isolated carbons using [1-13C]- or [2- 13C]-glucose facilitates the accurate measurement of dynamics at backbone Calpha and side-chain methyl positions in proteins. J Biomol NMR. 38 (3), 199-212 (2007).
- Loquet, A., Lv, G., Giller, K., Becker, S., Lange, A. 13C spin dilution for simplified and complete solid-state NMR resonance assignment of insoluble biological assemblies. J Am Chem Soc. 133 (13), 4722-4725 (2011).
- Castellani, F., et al. Structure of a protein determined by solid-state magic-angle-spinning NMR spectroscopy. Nature. 420 (6911), 98-102 (2002).
- Higman, V. A., et al. Assigning large proteins in the solid state: a MAS NMR resonance assignment strategy using selectively and extensively 13C-labelled proteins. J Biomol NMR. 44 (4), 245-260 (2009).
- Bockmann, A., et al. Characterization of different water pools in solid-state NMR protein samples. J Biomol NMR. 45 (3), 319-327 (2009).
- Cavanagh, J., Fairbrother, W. J., Palmer, A. G., Skelton, N. J. . Protein NMR spectroscopy, principles and practice. , (1996).
- Hartman, S. R., Hahn, E. L. Nuclear Double Resonance in the Rotating Frame. Phys Rev. 128 (5), 2042-2053 (1962).
- Harris, R. K., et al. Further conventions for NMR shielding and chemical shifts IUPAC recommendations 2008. Solid State Nucl Magn Reson. 33 (3), 41-56 (2008).
- Wang, Y., Jardetzky, O. Probability-based protein secondary structure identification using combined NMR chemical-shift data. Protein Sci. 11 (4), 852-861 (2002).
- Shaka, A. J., Baker, P. B., Freeman, R. Computer-Optimized Scheme for Wideband Applications and Low-Level Operation. J Magn Reson. 64, 547-552 (1985).
- Szeverenyi, N. M., Sullivan, M. J., Maciel, G. E. Observation of Spin Exchange by Two-Dimensional Fourier-Transform C-13 Cross Polarization-Magic-Angle Spinning. J Magn Reson. 47, 462-475 (1982).
- Baldus, M., Petkova, A. T., Herzfeld, J., Griffin, R. G. Cross polarization in the tilted frame: assignment and spectral simplification in heteronuclear spin systems. Mol Phys. 95 (5), 1197-1207 (1998).
- Verel, R., Ernst, M., Meier, B. H. Adiabatic dipolar recoupling in solid-state NMR: the DREAM scheme. J Magn Reson. 150 (1), 81-99 (2001).
- . Sparky – NMR Assignment and Integration Software Available from: https://www.cgl.ucsf.edu/home/sparky/ (2017)
- Luca, S., et al. Secondary chemical shifts in immobilized peptides and proteins: a qualitative basis for structure refinement under magic angle spinning. J Biomol NMR. 20 (4), 325-331 (2001).
- Shen, Y., Bax, A. SPARTA+: a modest improvement in empirical NMR chemical shift prediction by means of an artificial neural network. J Biomol NMR. 48 (1), 13-22 (2010).
- Berjanskii, M. V., Neal, S., Wishart, D. S. PREDITOR: a web server for predicting protein torsion angle restraints. Nucleic Acids Res. 34 (Web Server issue), W63-W69 (2006).
- Bardiaux, B., Malliavin, T., Nilges, M. ARIA for solution and solid-state NMR. Methods Mol Biol. 831, 453-483 (2012).
- Guerry, P., Herrmann, T. Comprehensive automation for NMR structure determination of proteins. Methods Mol Biol. 831, 429-451 (2012).
- Vasa, S., et al. beta-Helical architecture of cytoskeletal bactofilin filaments revealed by solid-state NMR. Proc Natl Acad Sci U S A. 112 (2), E127-E136 (2015).
- He, L., et al. Structure determination of helical filaments by solid-state NMR spectroscopy. Proc Natl Acad Sci U S A. 113 (3), E272-E281 (2016).
- Tang, M., et al. High-resolution membrane protein structure by joint calculations with solid-state NMR and X-ray experimental data. J Biomol NMR. 51 (3), 227-233 (2011).
- Paravastu, A. K., Leapman, R. D., Yau, W. M., Tycko, R. Molecular structural basis for polymorphism in Alzheimer’s beta-amyloid fibrils. Proc Natl Acad Sci U S A. 105 (47), 18349-18354 (2008).
- Schutz, A. K., et al. Atomic-resolution three-dimensional structure of amyloid beta fibrils bearing the Osaka mutation. Angew Chem Int Ed Engl. 54 (1), 331-335 (2015).
- Sgourakis, N. G., Yau, W. M., Qiang, W. Modeling an in-register, parallel "iowa" abeta fibril structure using solid-state NMR data from labeled samples with rosetta. Structure. 23 (1), 216-227 (2015).
- Lewandowski, J. R., De Paepe, G., Griffin, R. G. Proton assisted insensitive nuclei cross polarization. J Am Chem Soc. 129 (4), 728-729 (2007).
- Carlon, A., et al. How to tackle protein structural data from solution and solid state: An integrated approach. Prog Nucl Magn Reson Spectrosc. 92-93, 54-70 (2016).
- Judge, P. J., Taylor, G. F., Dannatt, H. R., Watts, A. Solid-state nuclear magnetic resonance spectroscopy for membrane protein structure determination. Methods Mol Biol. 1261, 331-347 (2015).
- Wang, S., Ladizhansky, V. Recent advances in magic angle spinning solid state NMR of membrane proteins. Prog Nucl Magn Reson Spectrosc. 82, 1-26 (2014).
- Sborgi, L., et al. Structure and assembly of the mouse ASC inflammasome by combined NMR spectroscopy and cryo-electron microscopy. Proc Natl Acad Sci U S A. 112 (43), 13237-13242 (2015).
- Loquet, A., et al. Atomic structure and handedness of the building block of a biological assembly. J Am Chem Soc. 135 (51), 19135-19138 (2013).
- Walti, M. A., et al. Atomic-resolution structure of a disease-relevant Abeta(1-42) amyloid fibril. Proc Natl Acad Sci U S A. 113 (34), E4976-E4984 (2016).
- Colvin, M. T., et al. Atomic Resolution Structure of Monomorphic Abeta42 Amyloid Fibrils. J Am Chem Soc. 138 (30), 9663-9674 (2016).
- Xiao, Y., et al. Abeta(1-42) fibril structure illuminates self-recognition and replication of amyloid in Alzheimer’s disease. Nat Struct Mol Biol. 22 (6), 499-505 (2015).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human alpha-synuclein. Nat Struct Mol Biol. 23 (5), 409-415 (2016).
- Wasmer, C., et al. Amyloid fibrils of the HET-s(218-289) prion form a beta solenoid with a triangular hydrophobic core. Science. 319 (5869), 1523-1526 (2008).
- Van Melckebeke, H., et al. Atomic-resolution three-dimensional structure of HET-s(218-289) amyloid fibrils by solid-state NMR spectroscopy. J Am Chem Soc. 132 (39), 13765-13775 (2010).
- Lamley, J. M., et al. Solid-state NMR of a protein in a precipitated complex with a full-length antibody. J Am Chem Soc. 136 (48), 16800-16806 (2014).
- Agarwal, V., et al. De novo 3D structure determination from sub-milligram protein samples by solid-state 100 kHz MAS NMR spectroscopy. Angew Chem Int Ed Engl. 53 (45), 12253-12256 (2014).
- Stanek, J., et al. NMR Spectroscopic Assignment of Backbone and Side-Chain Protons in Fully Protonated Proteins: Microcrystals, Sedimented Assemblies, and Amyloid Fibrils. Angew Chem Int Ed Engl. 55 (50), 15504-15509 (2016).
- Baker, L. A., Baldus, M. Characterization of membrane protein function by solid-state NMR spectroscopy. Curr Opin Struct Biol. 27, 48-55 (2014).
- Luchinat, E., Banci, L. In-cell NMR: a topical review. IUCrJ. 4 (Pt 2), 108-118 (2017).
- Freedberg, D. I., Selenko, P. Live cell NMR. Annu Rev Biophys. 43, 171-192 (2014).
- Selenko, P., Wagner, G. Looking into live cells with in-cell NMR spectroscopy. J Struct Biol. 158 (2), 244-253 (2007).
- Qiang, W., Yau, W. M., Luo, Y., Mattson, M. P., Tycko, R. Antiparallel beta-sheet architecture in Iowa-mutant beta-amyloid fibrils. Proc Natl Acad Sci U S A. 109 (12), 4443-4448 (2012).
- Bateman, D. A., Tycko, R., Wickner, R. B. Experimentally derived structural constraints for amyloid fibrils of wild-type transthyretin. Biophys J. 101 (10), 2485-2492 (2011).
- Marchanka, A., Simon, B., Althoff-Ospelt, G., Carlomagno, T. RNA structure determination by solid-state NMR spectroscopy. Nat Commun. 6, 7024 (2015).
- Schutz, A. K., et al. The amyloid-Congo red interface at atomic resolution. Angew Chem Int Ed Engl. 50 (26), 5956-5960 (2011).

