In-vitro- Ovulum Anbau für Live Cell Imaging der Zygote Polarisation und Embryo Musterung in Arabidopsis thaliana
Summary
Dieses Manuskript beschreibt eine in-vitro- Ovulum Anbaumethode, die live Cell Imaging von Arabidopsis Zygoten und Embryonen ermöglicht. Diese Methode wird genutzt, um die intrazellulären Dynamik während der Zygote Polarisation und die Zelle Schicksal Spezifikation bei der Entwicklung von Embryonen zu visualisieren.
Abstract
In den meisten Blütenpflanzen die Zygote und Embryo sind tief in das Gewebe der Mutter versteckt, und so es ist seit langem ein Rätsel wie sie dynamisch entwickeln; z. B. polarisiert wie die Zygote um Körperachse und wie der Embryo gibt verschiedene Zelle Schicksale während Orgel Bildung zu schaffen. Dieses Manuskript beschreibt eine in-vitro- Ovulum Kultur-Methode ausführen live Cell Imaging Zygoten und Embryonen von Arabidopsis Thalianazu entwickeln. Das optimierte Anbau Medium ermöglicht Zygoten oder frühen Embryonen bis zu fruchtbaren Pflanzen heranwachsen. Durch die Kombination mit einem poly(dimethylsiloxane) (PDMS) Micropillar Array Gerät, wird das Ovulum in das flüssige Medium in der gleichen Position gehalten. Diese Fixierung ist entscheidend für die gleichen Eizelle unter dem Mikroskop für mehrere Tage aus der zygotic Division Spätstadium Embryo zu beobachten. Das resultierende live-Cell Imaging kann verwendet werden, um die Echtzeit-Dynamik der Zygote Polarisation, wie nukleare Migration und Cytoskelett Neuordnung, und auch das Timing der Zellteilung und Zelle Schicksal Spezifikation beim Embryo Musterung zu überwachen. Darüber hinaus sind diese Ovulum Anbausystem mit Inhibitor Behandlungen, die Auswirkungen verschiedener Faktoren auf die Entwicklung des Embryos zu analysieren und mit optischen Manipulationen wie z. B. Laser-Unterbrechung, die Rolle der Zell-Zell-Kommunikation zu untersuchen kombinierbar.
Introduction
Der Grundkörper Plan eines Organismus entwickelt sich aus einem einzelligen Zygote. Bei den meisten Blütenpflanzen erzeugt zygotic Division eine apikale und eine basale Zelle, die zu dem Shooting und Wurzel, bzw.1zu entwickeln. Daher ist es wichtig zu verstehen, wie der Pflanzenkörper in der Embryogenese gebildet wird, aber es wurde kein wirksames Instrument, um die Dynamik des lebendigen Zygoten und Embryonen direkt zu beobachten, weil sie tief in der Blüte entwickeln. Eine in-vitro- Befruchtung-Methode wurde in mehreren Monocot Arten, wie Mais und Reis etablierten2,3. Bei dieser Methode isolierten Spermien und Eizellen sind verschmolzen, elektrisch oder chemisch, und die generierten Zelle in eine fruchtbare Pflanze entwickeln kann. In Dicot Pflanzen ist jedoch keine in-vitro- Befruchtung Methode, die richtige Embryonen, vermutlich aufgrund der nicht synchronisierten Zellzyklus von männlichen und weiblichen Gameten4,5produzieren kann. Darüber hinaus spielt das Embryo umgebenden Gewebe (Endosperm) eine wichtige Rolle im Embryo Entwicklung6.
In einem Modell Dicot Arten, A. Thaliana, wurde eine in-vitro- Kultivierung Methode entwickelt, durch die Konzentration auf das ganze Ovulum, das den Embryo und Endosperm7enthält. Dieses System wurde erfolgreich verwendet, um die Auswirkungen der verschiedenen chemischen Reagenzien auf Embryogenese analysieren, aber es ist nicht geeignet für Zeitraffer-imaging, weil es eine geringe Überlebensrate hat. Daher wurde eine neuartige in-vitro- Ovulum Anbausystem entwickelt, um so früh wie die Zygote Bühne und fruchtbaren Pflanzen in einem hohen Verhältnis8zu produzieren. Nach verschiedenen Studien wurde festgestellt, dass Nitsch-Medium und Trehalose erheblich verbessert die Überlebensrate der Eizellen8. Da das Ovulum erweitert wird, wie es wächst und so häufig bewegt sich weg vom Feld der Beobachtung des Mikroskops, wurde darüber hinaus ein PDMS Gerät entwickelt, um das Ovulum im mittleren9zu beheben. Das PDMS-Gerät aktiviert die langfristige Imaging für 3-4 Tage, die ausreicht, um die Entwicklung von einer Zygote zu einem Herz-Bühne Embryo zu verfolgen. Mit dieser Methode wird es möglich, die Dynamik der Zygote Polarisation und Embryo-Strukturierung, nicht nur unter normalen Bedingungen, aber auch in Anwesenheit von chemische Inhibitoren oder in verschiedenen mutierten Hintergründe8,10 visualisieren ,11.
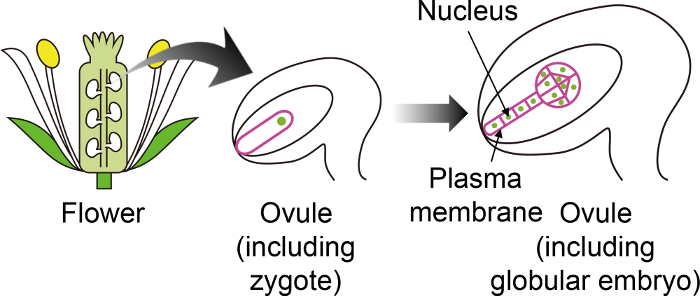
Abbildung 1: Schematische Darstellung der spezifischen fluoreszierenden Marker verwendet, um zu visualisieren Zygoten und Embryonen durch das Ovulum.
Die Arabidopsis Zygote entwickelt sich ein Embryo in das Ovulum, die tief im Inneren der Blume erzeugt wird. In dieser in-Vitro -Anbausystem der Zygote und Embryo durch das Ovulum eingehalten werden, und so ist es wichtig, bestimmte fluoreszierende Marker zu verwenden, die nicht in anderen Ovulum Geweben ausgedrückt werden. Klicken Sie bitte hier, um eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
Dieses Manuskript stellt eine einfachen in Vitro Ovulum Anbau-Protokoll, die effizient für den Einsatz in live Cell Imaging Zygoten und Embryonen zu entwickeln ist.
Das Design des Geräts PDMS ggf. Optimierung nach dem Embryonalstadium. Das erste entwickelte Gerät war ein Microcage Array die Ausrichtung anpassen und die Position der Eizellen9zu fixieren, und dann ein Micropillar Gerät wurde gebaut, um Eizellen effizienter trap8. Darü…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Mikroskopie in dieser Arbeit wurde durchgeführt an das Institut der transformativen Biomoleküle (WPI-ITbM) der Universität Nagoya und von Japan Advanced Plant Science Network unterstützt. Diese Arbeit wurde unterstützt durch Zuschüsse von der Japan Science and Technology Agency (ERATO Projekt, t.h. und M.U.) und der Japan Society zur Förderung der Wissenschaften: eine Beihilfe für die wissenschaftliche Forschung an innovativen Bereichen (Nos. JP24113514, JP26113710, JP15H05962 und JP15H05955 für M.U. und Nos. JP16H06465, JP16H06464 und JP16K21727 für T.H), eine Beihilfe für den wissenschaftlichen Nachwuchs (B, Nos. JP24770045 und JP26840093 für M.U.), und eine Beihilfe für anspruchsvolle Pionierforschung (No. JP16K14753 für M.U.).
Materials
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
References
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).

