In Vivo EPR valutazione di pH, pO2, lo stato Redox e le concentrazioni di fosfato e glutatione nel microambiente tumorale
Summary
Risonanza paramagnetica elettronica di basso campo (banda L, 1.2 GHz) usando le sonde nitrossidi e trityl solubile è dimostrata per la valutazione dei parametri fisiologicamente importanti nel microambiente tumorale in modelli murini di cancro al seno.
Abstract
Questo protocollo dimostra le capacità di risonanza paramagnetica elettronica di basso campo (EPR)-basato su tecniche in combinazione con sonde paramagnetiche funzionale a fornire informazioni quantitative sul microambiente tumorale chimica (TME), tra cui p O2, lo stato redox, pH, concentrazioni di fosfato inorganico interstiziale (Pi) e intracellulare del glutatione (GSH). In particolare, un’applicazione di una sonda sviluppata di recente solubile trityl multifunzionale offre opportunità insuperabile per in vivo misure simultanee di pHe pO2 Pi a E spazio inases (sonda di speranza). Le misure dei tre parametri utilizzando una singola sonda permettono per le loro analisi di correlazione indipendente di distribuzione sonda e ora delle misurazioni.
Introduction
Un ruolo chiave della TME nella progressione del cancro e nella terapia è sempre più apprezzato1. Tra le importanti parametri fisiologici della TME in tumori solidi, di ipossia del tessuto2, acidosi3,4, alta riduzione capacità5, elevate concentrazioni di GSH intracellulare6,7, e interstiziale Pi8 sono ben documentati. Valutazioni di2, pH, Pi, GSH e redox non invasiva in vivo pO forniscono intuizioni uniche i processi biologici nella TME e aiutano anticipo strumenti per lo screening pre-clinico di farmaci anti-cancro e strategie terapeutiche mirate TME. Una radiofrequenza ragionevole profondità di penetrazione nei tessuti da formazione immagine a risonanza magnetica (MRI) e tecniche basate su EPR a basso campo li rende gli approcci più appropriati per la valutazione non invasiva di questi parametri TME. MRI si basa in gran parte su imaging protoni di acqua ed è ampiamente usato nelle regolazioni cliniche fornire risoluzione anatomica ma manca funzionale ad alta risoluzione. Le misure di risonanza magnetica nucleare di fosforo-31 (31P-NMR) di extracellulare Pi concentrazione e pH basato su un segnale da fosfato endogeno sono potenzialmente interessanti per la caratterizzazione di TME, ma normalmente sono mascherate da diverse volte superiore intracellulare Pi concentrazioni9,10. Al contrario, misure EPR si basano sulla spettroscopia e imaging del appositamente progettato sonde paramagnetiche per fornire la risoluzione funzionale. Nota che esogeno EPR sonde hanno un vantaggio su esogeno NMR sonde dovuto la sensibilità intrinseca molto più elevata di EPR e assenza di segnali EPR sfondo endogeno. Il recente sviluppo di una duplice funzione pH e redox nitrossidi sonda11 e multifunzionale trityl sonda12 fornisce opportunità insuperabile per in vivo misure simultanee di diversi parametri di TME e loro analisi di correlazione indipendente sulla sonda distribuzione e tempo di misura. A nostra conoscenza, non ci sono nessun altri metodi disponibili per valutare simultaneamente in vivo fisiologicamente importanti parametri TME chimici in soggetti viventi, come pO2, pHe, Pi, redox e GSH.
Sonde per In Vivo Misure funzionali:
La figura 1 Mostra strutture chimiche delle sonde paramagnetiche utilizzate per accedere ai parametri TME, che comprendono le sonde del particolato e solubile. Alta sensibilità funzionale, stabilità nel tessuto vivente e tossicità minima sono alcuni vantaggi che fanno del particolato sonde preferiti sopra solubile sonde per in vivo ossimetria EPR. Ad esempio, sonde di particolato sono aumentati tempi di ritenzione al sito di impianto del tessuto rispetto alle sonde solubile che permette di misurare longitudinale del tessuto pO2 sopra parecchie settimane. D’altra parte, sonde solubile sovraperformare particolati sonde fornendo misurazioni spaziali risolto utilizzando basati su EPR tecniche di imaging nonché consentendo analisi concomitante da molteplici funzionalità (pO2, pH, Pi, redox, e GSH).
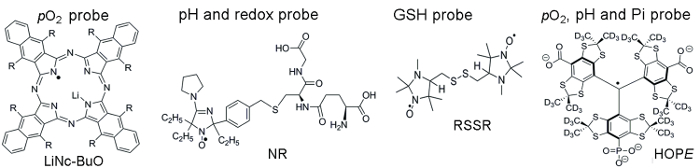
Figura 1. Strutture chimiche delle sonde paramagnetiche che assemblare analisi valutazione TME. Questo include il particolato pO2 sonda, LiNc-BuO (R = – O (CH2)3CH3) e sonde solubile: sonda di pH e redox di funzione dual, NR; Sonda di GSH-sensibili, Simonerasetti; e multifunzionale pO2, pH e sonda di Pi del microambiente extracellulare, la sonda di speranza. La sintesi di queste sonde è stato descritto nei riferimenti forniti 11,12. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
I metodi presentati consentono per la valutazione non invasiva in vivo dei parametri critici della TME chimica, vale a dire pO2, pH, stato redox e le concentrazioni di GSH intracellulare e interstiziale Pi. Tecniche di risonanza magnetica, quali MRI e basso campo EPR, sono i metodi di scelta per non invasiva in vivo profilatura di questi parametri TME. MRI Visualizza le strutture anatomiche, ma manca di sensibilità funzionale. In contrasto con MRI, EPR tecniche forniscono sensibilit…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato parzialmente sostenuto da NIH concede CA194013, CA192064 e U54GM104942. Il WVCTSI è riconosciuto per start-up a VVK, AB e TDE. Gli autori ringraziano il Dr. M. Gencheva e K. Steinberger per l’assistenza con gli esperimenti illustrativi. Il contenuto è di esclusiva responsabilità degli autori e non rappresentano necessariamente il punto di vista ufficiale del NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
References
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

