תמונה מונחה כריתה של גליובלסטומה, ההשתלה תוך-גולגולתי של פיגומים נזרע תאי גזע טיפולית
Summary
שוחרת הגידול טיפולית בתאי גזע mesenchymal (MSCs) מבטיחים לטיפול פולשני גליובלסטומה. השתלת אופטימלית כולל משלוח של MSCs לתוך חלל כריתה הגידול על פיגומים. כאן, טכניקות פרה כדי ללמוד טיפול MSC גליובלסטומה הינם מסופקים לרבות: כריתה הגידול תמונה מונחה; השרשת נזרע MSC פיגומים; טיפול לאחר הניתוח מעקב.
Abstract
גליובלסטומה (GBM), שכיחה ביותר אגרסיבי הסרטן במוח העיקרי, נושא תוחלת חיים של 12-15 חודשים. תוחלת החיים קצרה הוא בחלקו בשל חוסר היכולת של הטיפול הנוכחי, המורכב כריתה כירורגית ולאחריו הקרנות וכימותרפיה, כדי למנוע גידול פולשני מוקדים. טיפול של מוקדים אלה עשוי להשתפר עם tumoricidal האנושי בתאי גזע mesenchymal (MSCs). MSCs התערוכה הגידול חזק tropism, ניתן לתכנן חלבונים אקספרס טיפולית להרוג תאים סרטניים. החידושים במודלים פרה מציינים כי כריתה כירורגית גורם אובדן MSC מוקדמת מפחית את היעילות הטיפולית. היעילות של טיפול MSC יכולים להשתפר על ידי זריעה MSCs על גרדום poly(lactic acid) מתכלה (PLA). MSC משלוח לתוך חלל כריתה כירורגית על גרדום PLA משחזר תא השמירה, התמדה, ורצח הגידול. לחקור את ההשפעות של פלה נזרע MSC השרשה ב- GBM, דרושה מודל פרה מדויק. כאן אנו מספקים פרה פרוטוקול ניתוח כריתה הגידול תמונה מונחה של GBM בעכברים חיסונית לקויה ואחריו מתחילה MSC לגרדום השרשה. MSCs מתוכננים עם בונה lentiviral צורונים אקספרס, מפרישים טיפוליות הקשורות TNFα בתדר אפופטוזיס ליגנד (שובל), כמו גם חלבון פלואורסצנטי ירוק (GFP) כדי לאפשר מעקב פלורסנט. באופן דומה, לתאי הגידול U87 מתוכננים mCherry אקספרס ו גחלילית לוציפראז, מתן כפול פלורסנט/זורח מעקב. בעוד בשימוש כיום עבור חוקרים תאי גזע מתווכת מסירת הרפוי, פרוטוקול זה יכול להיות שונה כדי לחקור את ההשפעה של כריתה כירורגית על התערבויות אחרות GBM.
Introduction
גליובלסטומה (GBM) הוא הסרטן השכיח ביותר במוח העיקרי בקרב מבוגרים, עם עגומה חציון ההישרדות של רק 12-15 חודשים1,2,3,4,5. הישרדות שלא חל שיפור משמעותי מאז 2005 כאשר קליני הסטנדרטי העכשווי של כריתה כירורגית מקסימלי ולאחריו הקרנות וכימותרפיה temozolomide הנלווה ו אדג’וונט היה מאומץ6,7. בעוד טיפול זה מספק חולים עם הקלה זמנית של הסימפטומים, סטנדרט של טיפול לטיפול תמיד תוצאות הישנות סרטן פולשני foci להתחמק כריתה, מוגנים מפני טיפולים מערכתית על ידי מחסום הדם – מוח (BBB). אסטרטגיות אשר המטרה גידול פולשני foci תוך עקיפת BBB נחוצים בדחיפות לה לתוכניותיך נגד המחלה הזאת אגרסיביים, מתישה.
האדם גזע mesenchymal (MSCs) מבטיחים כמו סמים רכבי ההעברה עבור GBM עקב שלהם8,tropism הגידול מקורית9. MSCs בעלי קולטנים ל ולהעביר כלפי גורמים מסיסים להפריש גידולים, כולל 1α סטרומה תא-derived factor (דגכ-1α), מטריקס מטאלו-פרוטאינאז-1 (MMP-1), ומונוציט chemoattractant חלבון-1 (MCP-1) בין היתר10, 11 , 12 , 13. הנדסה MSCs כדי לבטא להפריש תרופות ציטוטוקסיות מאפשר להם להיות רתום כמו גידול-יונת משלוח סמים כלי רכב. MSCs מהונדסים לנוע לעבר גידול פולשני foci ולספק חלבונים טיפולית. גישה זו הוכיחה כדאיות במגוון של פרה GBM מודלים9,14. עם זאת, הרוב המכריע של מודלים אלה אינן כוללות כריתה כירורגית למרות הרלוונטיות הקלינית של רכיב זה. מתעוררים מחקרים באמצעות דגמים חדשים של כריתה חשף כי הסרת גידול כירורגי מפחית את התמדתו של תאי גזע מוזרקים ישירות לתוך חלל כירורגי ה-15. אובדן יכולת הקיום, גרמו יעילות מופחתת, ככל הנראה בגלל ירידות מינון, משך הזמן של סמים להעביר מוקדי גידול פולשני.
כדי להגדיל את תאי הגזע הכדאיות ואת משלוח סמים, MSCs יכול להיות נזרע על גבי פיגומים לפני ההשתלה. ב פרוטוקול זה, מסתיימים, resorbable electrospun nanofibrous poly(lactic acid) (PLA) משמש פיגומים עבור ה-PLA MSCs. הגמשת תואמת את הצורה של חלל כריתה על השתל, אשר ממקסם טיפולית כיסוי ומצמצמת מרחק MSCs חייב לנסוע כדי להגיע תאים סרטניים. MSCs יישארו על הגרדום במהלך ההשתלה, עוברים את לגרדום לכיוון תאים סרטניים לאחר ההשתלה16,17. MSCs ותרופות ציטוטוקסיות שהם נושאים ואז להצטבר על מוקדים הגידול. מסירת תרופות ציטוטוקסיות הגידול דורש MSC הכדאיות והתמדה, אשר שניהם נמצאים שנעזר השרשה על פיגומים.
בהליך זה, משמשים וקטורים lentiviral לזירוז ביטוי יציב של פלורסנט (במבחנה מעקב), זוהרים (ויוו מעקב) סמני סרטן וגם תאי שורות. הקו GBM האנושי U87 נגוע עם mCherry ו גחלילית לוציפראז (U87 mCh-Fl), וכן את MSCs טיפולית-שאינם עם GFP, renilla לוציפראז (MSC GFP-Rluc). הווריאציה טיפולית של MSCs אקספרס הקשורות TNFα אפופטוזיס גרימת ליגנד (MSC-שובל). שובל, חלבון מופרש צורונים, נקשר בקרבת מקום המוות רצפטורים על סרטן תאים, יוזם אפופטוזיס בתיווך קספאז18.
כאן, אנו מספקים פרוטוקול פרה תמונה מונחה GBM כריתה כירורגית של השרשת נזרע MSC פיגומים. בקצרה, עכברים עירום ניתנת גולגולת ואחריו שלושה ימים מאוחר יותר orthotopic סטיאוטטי הזרקה של U87 mCh-Fl להקים הגידול העיקרי. הגידול engrafted גדל במשך תקופה של שבוע. PLA פיגומים הם נזרע עם MSCs 48 שעות לפני ניתוח כריתה. הגידול הוא resected אז תחת הדרכתו פלורסנט, לגרדום MSC-טעון הוא מושתל לתוך חלל כריתה. הישרדות נטל ועכבר הגידול מתבצע לאחר מכן וכאב לאחר הניתוח עם ביולומינסנציה הדמיה (בלי). ציר זמן של הליכים אלה מוצגים להלן (איור 1).
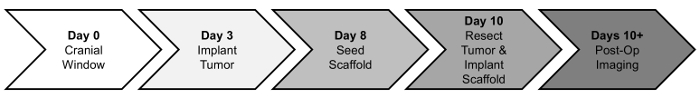
איור 1: השתלשלות ההליכים. עכברים בתחילה מקבלים חלון גולגולתי (יום 0). לאחר תקופה של התאוששות של שלושה ימים, הם גידולים מושתל (3 ביום) ולגדול למשך שבוע. פיגומים הם נזרע עם MSCs (יום 8) יומיים לפני הגידול כריתה, ועל ההשתלה ההליך (10 יום). התקדמות הגידול והיעילות הטיפולית יוערכו באמצעות שלאחר הניתוח הדמיה לאחר מכן (יום 10 +). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
Representative Results
Discussion
ניתוח יכול בדרך כלל להסתיים בתוך 30 דקות לכל עכבר, בהתחשב בכך הנקודות הבאות נלקחים בחשבון כדי למקסם את דיוק ולהימנע מלכודות זמן רב. ראשית, ודא שכשהעכבר ממוקם כראוי בכלי stereotaxic לפני הפעלת ההליך. תנועות ראש לא רצויים יגביל דיוק כירורגי של הניתוח, המיקום של הגידול השרשה, וכן מידת כריתה הגידול. ל?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים להכיר תרומות העריכה של ד ר קתרין Pietrosimone. PLA פיגומים יוצרו על ידי המעבדה של ד ר אליזבת Loboa, צפון קרוליינה סטייט. עבודה זו נתמכה על ידי קרן המחקרים UNC Lineberger מקיף במרכז לחקר הסרטן של אוניברסיטת סרטן UNC Translational ואת המכון למדעי קלינית (KL2TR001109, UL1TR001111).
Materials
| Just for mouse stereotaxic instrument | Stoelting | 51730 | Maintains steady head positioning during surgery |
| Fluorescence dissecting stereomicroscope | Leica | M165 FC | Allows real-time imaging of tumor during resection |
| Motorized integrated stereotaxic injector (ISI) system | Stoelting | 53315 | Allows precise tumor cell injection volume and rate |
| Vetbond tissue adhesive | 3M | 1469 | Sugical glue to close skin wound |
| Artificial tears | Akorn | 664268 | Prevents eyes from drying during surgery |
| Webcol alcohol preps | Covidien | 6818 | Sterilize incision site |
| Betadine surgical scrub | Purdue Fredick Company | 6761815117 | Sterilize incision site |
| Cotton-tipped applicators | Fisherbrand | 23-400-115 | Surgery tool |
| E-vac aspirating system | Argos | EV310 | Vacuum pump used to resect tumor |
| Fibrinogen and thrombin extracted from as-received TISSEEL | Baxter | To temporarily secure the scaffold in the resection cavity | |
| IVIS Kinetic in vivo optical imaging system | Caliper Life Science | Bioluminescent Imager | |
| D-Luciferin potassium salt | PerkinElmer | 122799 | In vivo imaging agent |
References
- Adamson, C., et al. Glioblastoma multiforme: a review of where we have been and where we are going. Expert opinion on investigational drugs. 18 (8), 1061-1083 (2009).
- Asthagiri, A. R., Pouratian, N., Sherman, J., Ahmed, G., Shaffrey, M. E. Advances in Brain Tumor Surgery. Neurologic Clinics. 25 (4), 975-1003 (2007).
- Affronti, M., et al. Overall survival of newly diagnosed glioblastoma patients receiving carmustine wafers followed by radiation and concurrent temozolomide plus rotational multiagent chemotherapy. Cancer. 115 (15), 3501-3511 (2009).
- Erpolat, O., Akmansu, M., Goksel, F., Bora, H., Yaman, E., Büyükberber, S. Outcome of newly diagnosed glioblastoma patients treated by radiotherapy plus concomitant and adjuvant temozolomide: a long-term analysis. Tumori. 95 (2), 191-197 (2009).
- Minniti, G., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma in elderly patients. Journal of Neuro-Oncology. 88 (1), 97-103 (2008).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Delgado-López, P., Corrales-García, E. Survival in glioblastoma: a review on the impact of treatment modalities. Clinical and Translational Oncology. 18 (11), 1062-1071 (2016).
- Wu, X., et al. In vivo tracking of superparamagnetic iron oxide nanoparticle-labeled mesenchymal stem cell tropism to malignant gliomas using magnetic resonance imaging. Laboratory investigation. Journal of Neurosurgery. 108 (2), 320-329 (2008).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Research. 65 (8), 3307-3318 (2005).
- Xu, F., Shi, J., Yu, B., Ni, W., Wu, X., Gu, Z. Chemokines mediate mesenchymal stem cell migration toward gliomas in vitro. Oncology Reports. 23 (6), 1561-1567 (2010).
- Park, S., et al. CXCR4-transfected human umbilical cord blood-derived mesenchymal stem cells exhibit enhanced migratory capacity toward gliomas. International Journal of Oncology. 38 (1), 97-103 (2011).
- Ho, I., et al. Matrix Metalloproteinase 1 Is Necessary for the Migration of Human Bone Marrow-Derived Mesenchymal Stem Cells Toward Human Glioma. STEM CELLS. 27 (6), 1366-1375 (2009).
- Bexell, D., Svensson, A., Bengzon, J. Stem cell-based therapy for malignant glioma. Cancer Treatment Reviews. 39 (4), (2012).
- Nouri, F., Wang, X., Hatefi, A. Genetically engineered theranostic mesenchymal stem cells for the evaluation of the anticancer efficacy of enzyme/prodrug systems. Journal of Controlled Release. 200, 179-187 (2015).
- Kauer, T., Figueiredo, J. -. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Bagó, J., Pegna, G., Okolie, O., Hingtgen, S. Fibrin matrices enhance the transplant and efficacy of cytotoxic stem cell therapy for post-surgical cancer. Biomaterials. 84, 42-53 (2016).
- Bagó, J., Pegna, G., Okolie, O., Mohiti-Asli, M., Loboa, E., Hingtgen, S. Electrospun nanofibrous scaffolds increase the efficacy of stem cell-mediated therapy of surgically resected glioblastoma. Biomaterials. 90, 116-125 (2016).
- Loebinger, M., Eddaoudi, A., Davies, D., Janes, S. Mesenchymal Stem Cell Delivery of TRAIL Can Eliminate Metastatic Cancer. Cancer Research. 69 (10), 4134-4142 (2009).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. J. Vis. Exp. (12), e680 (2008).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), e1986 (2010).

