Isoleren en de integratie van licht-oogst antennes van Diatomee Cyclotella Meneghiniana in liposomen met thylakoïde lipiden
Summary
Hier presenteren we een protocol om te isoleren fucoxanthin chlorofyl a/c bindende proteïnen (FCP) van diatomeeën en in liposomen met natuurlijke lipide composities aan het bestuderen van excitatie energieoverdracht op ion samenstelling veranderingen te integreren.
Abstract
De fotosynthetische prestaties van planten, algen en diatomeeën afhankelijk sterk van de snelle en efficiënte regulering van de lichte oogsten en energie overdracht processen in het membraan van de thylakoïde van chloroplasten. Het licht oogsten antenne van diatomeeën, de zogenaamde fucoxanthin chlorofyl a/c bindende proteïnen (FCP), zijn vereist voor de absorptie van licht en efficiënte overdracht naar de fotosynthetische reactie centra alsmede voor foto-bescherming tegen buitensporige licht. Het schakelen tussen deze twee functies is een langdurige kwestie van onderzoek. Veel van deze studies zijn uitgevoerd met FCP in wasmiddel micellen. Voor studies van de interactie, zijn de detergentia verwijderd, die leidde tot een aspecifieke samenvoeging van FCP complexen. In deze aanpak is het moeilijk te discrimineren tussen artefacten en fysiologisch relevante gegevens. Vandaar, meer waardevolle informatie over FCP en andere membraan gebonden licht complexen oogst kan worden verkregen door het bestuderen van eiwit-eiwitinteractie, energie-overdracht en andere spectroscopische functies als ze zijn ingesloten in de omgeving van hun oorspronkelijke lipide. Het belangrijkste voordeel is dat liposomen hebben een gedefinieerde grootte en een gedefinieerde lipide/eiwitverhouding waarmee de mate van FCP clustering wordt gecontroleerd. Verder, veranderingen in de pH en ion samenstelling die regelen van licht oogsten in vivo kunnen gemakkelijk worden gesimuleerd. In vergelijking met het membraan van thylakoïde zijn de liposomen homogener en minder complex is, waardoor gemakkelijker te verkrijgen en te begrijpen van spectroscopische gegevens. Het protocol wordt de procedure beschreven van FCP isolatie en zuivering, liposomen voorbereiding en opneming van FCP in liposomen met natuurlijke lipide samenstelling. Het gevolg is van een typische toepassing zijn gegeven en besproken.
Introduction
Fotosynthetische organismen zoals diatomeeën moeten omgaan met veranderende lichtomstandigheden en reageren met verfijnde acclimatisering mechanismen die fotosynthetische hoogrenderende ondersteunen en beschermen tegen foto-oxidatieve schade veroorzaakt door het overmatige licht. Een grote licht-beschermende proces in fotosynthetische eukaryoten is de hoge energie blussen (qE) van geabsorbeerde licht dat zich als de belangrijkste bijdrage aan de niet-fotochemische blussen (NPQ) onder lichte stress voorwaarden1,2 voordoet ,3. De lichte oogsten antenne complexen (LHC) zijn betrokken bij de regulering van excitatie energie overdracht trajecten. In antwoord op hoge licht geïnduceerde lage pH in de chloroplast lumen, de antenne systeem schakelopties van het licht oogsten van status naar status het blussen. Deze dissipatief energietoestand beschermt photosystems (PS) en andere complexen in het membraan van thylakoïde foto-oxidatie. In fotosynthetische eukaryoten, wordt de qE meestal veroorzaakt door twee factoren1,–2,3. Een factor is het gespecialiseerde licht oogsten eiwit dat op de lage pH reageert. De publieke omroepen proteïne induceert de qE in hogere planten4. LhcSRs5, gemoduleerd door publieke omroepen activiteit, veroorzaken de qE in groene algen6. Diatomeeën bezitten Lhcx-achtige eiwitten die structuur verwant zijn aan de LHCSRs7,,8,,9,10.
De tweede factor van qE is de Xantofyl-cyclus waar carotenoïden van de antenne door de-epoxidatie omgezet in de vorm van een foto-beschermende en teruggekeerd door epoxidatie. In planten en groene algen, wordt Violaxanthine geconverteerd naar zeaxanthine. In diatomeeën, wordt diadinoxanthin geconverteerd naar diatoxanthin, die vervolgens met de omvang van NPQ11 correleert. Het licht van de Diatomee oogsten antenne bezit enkele eigenaardigheden, hoewel het evolutionaire gerelateerde te planten en algen LHCs. De overgang van licht aan foto-bescherming is enorm snel en de capaciteit van NPQ is hoger in vergelijking met planten12. Dit zou een reden waarom diatomeeën zijn ijzersterk in verschillende ecologische niches op een manier die zij verantwoordelijk voor 45% van de oceanische netto primaire productie13 zijn. Diatomee lichte oogsten systemen zijn dus een interessant object voor fotosynthese onderzoek.
Diatomeeën, zoals de centric soorten Cyclotella meneghiniana, intrinsieke licht thylakoïde oogsten systemen vernoemd naar de pigmenten die ze bezitten bind – fucoxanthin, chlorofyl (chl) a en c, vandaar FCP. Light oogsten van eiwitten, zoals FCPs, zijn ingebed in de thylakoïde membraan systeem dat bestaat uit verschillende lagen van het membraan. Diatomeeën vormen bands van drie thylakoiden. Dit complex situatie maakt het moeilijk om ze te bestuderen op moleculair niveau in het membraan van thylakoïde. Bovendien, vele componenten dragen bij aan de verordening van licht oogsten (zie hierboven). Daarom waren de complexen in vele benaderingen, geïsoleerd van het membraan met behulp van milde wasmiddelen, bijvoorbeeld n-Dodecyl-β-D-maltopyranoside (β-DDM), die solubilize van het membraan, maar de FCP-complexen intact te houden. Vele spectroscopische studies werden uitgevoerd met behulp van ontbindend FCP te onderzoeken intramoleculaire energie overdracht14,15,16,17. Deze voormalige aanpak was echter beperkt omdat de regulering van energie-overdracht excitonic interactie met andere antenne complexen of photosystems moet. Vandaar worden dit soort studies niet uitgevoerd met ontbindend complexen omdat de interactie tussen complexen verloren is.
Een belangrijk kenmerk in antenne verordening is de “moleculaire verdringing” van de antenne en photosystems in de thylakoïde membraan18. Voorheen, een eenvoudige benadering werd uitgevoerd om te simuleren van dit effect in vitro. Het wasmiddel werd verwijderd, wat leidt tot willekeurige aggregatie van antenne complexen. Hoewel sommige redelijke gegevens werd verkregen door deze aanpak17,19, de wasmiddel verwijdering weerspiegelt niet de situatie in vivo en kent een aantal beperkingen omdat het complexen zijn niet in hun reguliere tertiaire interactie structuur.
Het gebruik van liposomen overwint verscheidene van de vroegere beperkingen. De tertiaire structuur is nog volledig intact. Het liposoom membraan biedt een quasi-eigen omgeving voor de antenne-complexen. Het membraan scheidt de binnenkant van de liposomen van de buitenomgeving. Langs deze weg bieden liposomen twee reactie compartimenten voor studies van ion en pH verlopen ook wat transportprocessen. Verder kunnen de parameters van het experimentele systeem gemakkelijker worden beheerd voor studies in het membraan van thylakoïde. Liposomen bleken al te zijn een uitstekend hulpmiddel om te studeren fotosynthetische complexen. Een belangrijk aandachtspunt in het verleden was op de plant waar het effect van de gewijzigde lipide samenstelling is getest op LHC II20LHC. In andere benaderingen waren de eiwit-eiwit interactie tussen verschillende LHC II onderzochte21. Ook werden sommige studies in groene algen uitgevoerd die beschrijven spontane clustering tussen LHC22. Gezien het belang van diatomeeën voor aquatische ecosystemen, relatief weinig studies werden uitgevoerd met antenne complexen van diatomeeën. Twee studies onderzocht de complexen van de antenne van de centric Cyclotella meneghiniana, waar de clustering van de FCP antenne23 en reactievermogen van FCP elektrochemische verlopen24 werden getoond. Dus, liposomen zijn een uitstekend hulpmiddel om te studeren Diatomee antennes en hun interactie en de verordening in bijna oorspronkelijke omstandigheden. De liposomen zijn veelzijdig sinds vele aandoeningen zoals lipide samenstelling, grootte van de liposomen, eiwit dichtheid en de omliggende waterfase kan worden gecontroleerd. De methode vereist bovendien lage bedragen van monsters. Het experimentele systeem is robuust en zeer reproduceerbaar. De opdeling van liposomen zorgt voor het bestuderen van pH en ion hellingen, die zijn belangrijke factoren in de regulering van de antenne complexen.
Hier beschrijven we de isolatie van FCP antenne complexen van C. meneghiniana en hun opneming in liposomen met natuurlijke thylakoïde lipide samenstelling. Ook wij voorbeeldige gegevens leveren voor de spectroscopische karakterisering van ontbindend FCP en vergelijk deze met FCP in liposomen. De methode geeft een overzicht van kennis en gestandaardiseerde protocollen verkregen van de verbeteringen van de Gundermann en Büchel 201223, Natali et al. 201622en Ahmad en Dietzel 201724.
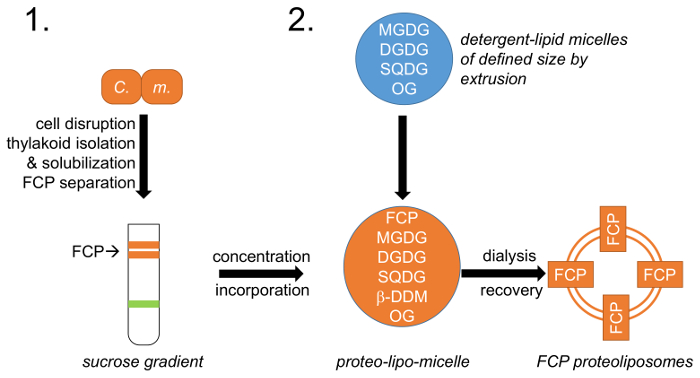
Figuur 1: schematische weergave van de werkstroom. (1) verwijst naar alinea 1 die beschrijft celgroei, verstoring en thylakoïde isolatie met FCP scheiding aanleiding sacharose dichtheid verlopen; C. m. –Cyclotella meneghiniana cellen. (2) voorbereiding van natuurlijke thylakoïde lipide mengsel (MGDG, DGDG en SQDG) als beschreven in lid 2 en oprichting van lipide-wasmiddel micellen met octylglycoside (OG). Een gedefinieerde lipide-micel grootte wordt bereikt door met behulp van membranen met een diameter van gedefinieerde porie extrusie. FCP en lipide-micellen zijn herenigd op een vooraf gedefinieerde lipide: eiwitverhouding en de detergentia OG en β-DDM zijn verwijderd via gecontroleerde dialyse FCP proteoliposomes vormen. Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
FCP liposomen met natuurlijke lipide samenstelling verstrekt een handige, eenvoudige en reproduceerbare hulpmiddel om te onderzoeken van spectroscopische eigenschappen in vitro. Het lipide-milieu in FCP liposomen lijkt op de situatie binnen de thylakoïde membraan, die aanleiding geven tot experimentele resultaten die zich dichter bij het natuurlijke omstandigheden.
Er zijn verschillende voordelen van het gebruik van C. meneghiniana als een modelsysteem voor FCP antenne. Het …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wij danken Rana Adeel Ahmad voor bijstand in FCP zuivering. Prof. Claudia Büchel is erkend voor nuttige discussies en het lezen van het manuscript. Dit werk werd gesteund door de Duitse Research Foundation naar LD (DI1956-1/1) en de Humboldt foundation voor een Feodor-Lynen fellowship aan LD.
Materials
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel – por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer – Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | |||
| For specific safety instructions please refer to material safety sheets and repective manuals. | |||
| Standard lab material and substances are not listed. |
References
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. 생화학. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. 생화학. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. 생화학. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).

